4-я городская клиническая больница, Минск, 19-я центральная районная клиническая поликлиника, Минск, Центр экспертиз и испытаний в здравоохранении, Минск
Malaschitsky D.A.1, Varaksa A.N.2, Rozhdestvensky D.A.3
1City Clinical Hospital №4, Minsk, Belarus
2Central District Policlinic №19, Minsk, Belarus
3Center for Examinations and Tests in Health Service, Minsk, Belarus
Conservative therapy of benign prostatic hypertrophy and comparison
of the effectiveness of Unoprost and Prostamol uno
Резюме. Представлен краткий обзор фармакотерапевтических подходов при доброкачественной гиперплазии предстательной железы (ДГПЖ), в том числе с применением экстракта Serenoa repens. Описаны ход и результаты многоцентрового контролируемого рандомизированного клинического испытания лекарственных средств на основе Serenoa repens – Унопроста и Простамола УНО. В ходе 12-недельной терапии пациентов с ДГПЖ I–II стадии выявлена равная эффективность и безопасность применения препаратов Унопрост и Простамол УНО.
Ключевые слова: доброкачественная гиперплазия предстательной железы, Serenoa repens, Унопрост, Простамол УНО.
Summary. There is a brief overview of pharmacotherapeutic approaches in benign prostatic hyperplasia (BPH), including the usage of Serenoa repens extract. There are described the course and results of multicenter controlled randomized clinical trial of the drugs based on Serenoa repens – Unoprost and Prostamol UNO. The patients with 1st-2nd stages of BPH underwent a twelve-week therapy with the named drugs. As a result there was observed equal effectiveness and safety of Unoprost and Prostamol UNO.
Key words: benign prostatic hyperplasia, Serenoa repens, Unoprost, Prostamol UNO.
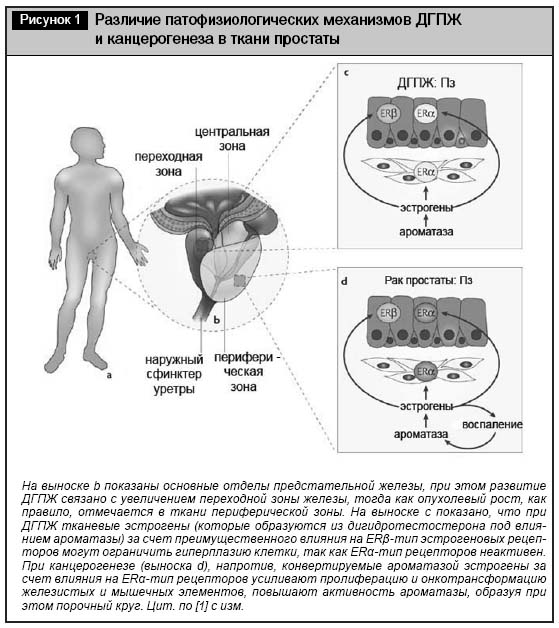
Доброкачественная гиперплазия предстательной железы (ДГПЖ) относится к группе заболеваний, которые наиболее существенно изменяют качество жизни мужчины. Несмотря на относительно хорошо изученную патоморфологию и семиотику заболевания, причины и патофизиологический механизм его развития остаются до конца неясными. Активно изучается связь ДГПЖ с ожирением. Известные патофизиологические концепции развития ДГПЖ рассматривают ее в тесной связи с процессами, имеющими место при раке предстательной железы (РПЖ) [1]. Однако ключевыми отличиями при этом являются различная рецепторная и тканевая специфичность патологического процесса (табл. 1).
Патофизиологические механизмы развития РПЖ и ДГПЖ [1]
|
Патофизиологический фактор
|
РПЖ
|
ДГПЖ
|
|
Андрогены
|
Пролиферация клеток
|
Пролиферация клеток
|
|
Эстрогеновые
рецепторы ERα
|
Негативное воздействие: индукция опухолевой трансформации, воспаление, пролиферация
|
Роль не установлена
|
|
Эстрогеновые
рецепторы ERβ
|
Позитивное воздействие (?): проапоптотическое действие, антипролиферативный эффект
|
Позитивное воздействие: антипролиферативный эффект, проапоптотическое действие
|
|
Ароматаза
|
Воспаление резко повышает активность
|
|
|
Патогенетическая терапия
|
Депривация андрогенов
Антагонисты ERα
|
Депривация андрогенов
Агонисты ERβ
|
В настоящее время полагают, что при ДГПЖ имеет место локальное повышение чувствительности андрогеновых рецепторов в области переходной зоны простаты к действию активной формы тестостерона – дигидротестостерона. При этом активность обоих типов эстрогеновых рецепторов – ERα и ERβ остается на фоновом уровне (рис. 1). Вследствие этого на фоне усиления пролиферации клеток переходной зоны не происходит одновременной активации апоптоза «излишних» структур через ERβ-опосредованные механизмы. Одновременно возрастает активность 5&alpha-редуктазы в ткани переходной зоны за счет 1-го и 2-го типов изофермента в 1,5–2,0 раза по сравнению с его фоновой активностью в здоровой ткани предстательной железы [1, 2].
Исходя из сформулированных выше патофизиологических механизмов, выделяют следующие основные типы патогенетической и симптоматической фармакотерапии ДГПЖ:
– активное наблюдение;
– фитотерапия;
– применение α-адреноблокаторов;
– применение ингибиторов 5α- редуктазы.
Перспективным направлением в фармакотерапии ДГПЖ является поиск и применение лекарственных средств из группы локальных простатспецифических активаторов ERβ-типа эстрогеновых рецепторов.
Фармакоэпидемиологические исследования 2006–2007 гг. показали различную приверженность врачей к тем или иным фармакотерапевтическим группам лекарственных средств и стандартам терапии ДГПЖ в странах европейского региона (рис. 2) [2]. В табл. 2 суммированы основные характеристики фармакотерапевтических агентов, используемых при консервативном лечении ДГПЖ.
Фармакотерапевтические характеристики основных групп лекарственных средств при ДГПЖ
|
Группа
|
Режим дозирования
|
Полное развитие эффекта
|
Связанные эффекты
|
|
α1-адренергические
антагонисты (теразозин, доксазозин)
|
1 раз в день,
титрационный
интервал 2–3 недели
|
4–6 недель
|
Ортостатическая гипотензия, головокружение, слабость, головная боль
|
|
α1А-адренергические
антагонисты (тамсулозин)
|
1 раз в день,
нет титрационного интервала
|
1 неделя
|
Ринит, нарушения
эякуляции, инфекции, головокружение
|
|
Ингибиторы 5α-редуктазы (финастерид, дутастерид)
|
1 раз в день,
нет титрационного интервала
|
6–12 месяцев
|
Снижение либидо, нарушение эякуляции, импотенция, снижение уровня PSA
|
|
Экстракт Serenoa repens (Пермиксон, Простамол, Унопрост)
|
1–2 раза в день, нет титрационного интервала
|
6–12 месяцев
|
Гинекомастия
|
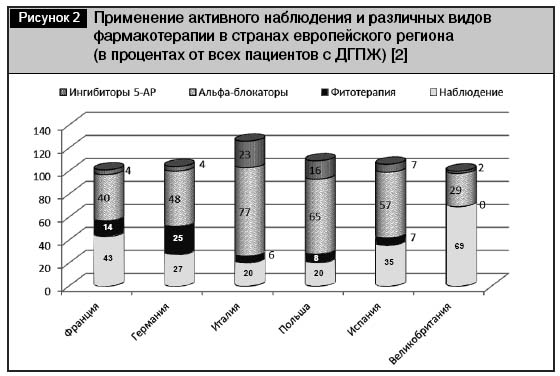
Традиционно относительно высокая приверженность к средствам фитотерапевтического ряда наблюдается в Германии (до 25% всех пациентов). В 2002 г. доля фитопрепаратов в лечении ДГПЖ составляла в Германии более 50%; в США 1,1% взрослого населения (или 2,5 млн человек) принимали лекарственные средства на основе Serenoa repens [3]. Подобных фармакоэпидемиологических исследований на территории СНГ не проводилось, однако среди пациентов России, Украины и Беларуси традиционно также отмечается высокая приверженность лечению средствами фитотерапевтического ряда.
Экстракт Serenoa repens как средство терапии ДГПЖ. Экстракт Serenoa repens, или Сабаля мелкопильчатого, представляет собой липостероловое извлечение из плодов растения, стандартизированное по содержанию свободных жирных кислот (70–95%) и фитостеролов (β-ситостерола) [4].
Точные молекулярные механизмы активности экстракта изучены недостаточно. Однако имеются работы, в которых показано, что в условиях in vitro компоненты экстракта снижают активность изоферментов 5α-редуктазы, препятствуют взаимодействию дигидротестостерона с цитозольными андрогеновыми рецепторами в тканях предстательной железы, обладают слабым α1-адреноблокирующим действием, нарушают передачу сигнала в системе пролактин–рецептор, оказывают слабое противовоспалительное действие [5].
В исследованиях in vivo было установлено, что на фоне применения экстракта снижается уровень дигидротестостерона и повышается уровень его предшественника – тестостерона, показано также, что экстракт оказывает антиэстрогеновое действие в отношении ERα-подтипа рецепторов, увеличивает апоптоз и снижает клеточную пролиферацию в тканях предстательной железы у пациентов с ДГПЖ [6–8]. Однако, в отличие от ингибиторов 5α-редуктазы, экстракт Serenoa repens практически не изменяет уровни PSA и оказывает менее выраженное влияние на объем предстательной железы [9].
Систематизированный обзор (2001 г.) продемонстрировал достоверное преимущество препаратов на основе Serenoa repens по сравнению с плацебо в отношении облегчения симптомов ДГПЖ [10]. В основу обзора был положен ряд рандомизированных клинических испытаний с участием более 1500 пациентов. Однако авторами обзора отмечено, что роль данного лекарственного средства в отношении замедления прогрессирования заболевания или предотвращения развития осложнений ДГПЖ остается неустановленной. Один из факторов, препятствующих точной оценке данного вида терапии, – слишком короткий (менее 3 месяцев) период наблюдения за пациентами.
В Окленде (Калифорния, США) в 2001–2004 гг. было проведено двойное слепое рандомизированное плацебо-контролируемое исследование экстракта Serenoa repens с участием 225 пациентов [3]. Была изучена 12-месячная эффективность терапии стандартизированным экстрактом в дозе 160 мг 2 раза в день. На фоне терапии не отмечалось достоверного улучшения показателей функции простаты как при оценке по шкале симптомов Американской урологической ассоциации (индекс AUASI), так и при оценке показателей урофлуометрии и УЗ-сканирования мочевого пузыря (объем остаточной мочи). Тем не менее полученные результаты не являются бесспорными [11], поскольку в исследование включались пациенты с исходно низкими показателями индекса AUASI (что снижало исходную чувствительность метода индексной оценки), использованная доза (160 мг) была в 2 раза ниже стандартно рекомендуемой на прием (320 мг).
В связи с этим интересны результаты, полученные в национальном многоцентровом рандомизированном клиническом испытании по сравнению эффективности двух генерических препаратов на основе экстракта Serenoa repens: Простамол УНО (Berlin-Chemie AG, Гемания) и Унопрост (УП «Минскинтеркапс», Республика Беларусь).
Результаты многоцентрового
контролируемого
рандомизированного
клинического испытания
лекарственных средств
Унопрост и Простамол УНО
Испытание включало фазу скринирования (не более 5 дней) и фазу лечения (3 месяца).
Критерии включения пациентов в исследование:
– возраст старше 50 лет;
– клинически верифицированный диагноз ДГПЖ;
– индекс IPSS 20–30 баллов;
– пиковая скорость потока мочи Qmax=5–15 мл/с;
– уровень остаточной мочи не более 125 мл;
– уровень PSA в крови менее 4 нг/мл;
– подписанное информированное согласие.
Критерии исключения пациентов из исследования:
– хирургические вмешательства на органах малого таза в настоящее время или в анамнезе;
– термотерапия или лучевая терапия органов малого таза в настоящее время или в анамнезе;
– осложненное течение ДГПЖ (включая конкременты и дивертикулы мочевого пузыря);
– острая задержка мочи в настоящее время или в анамнезе;
– гиперчувствительность к компонентам препарата;
– участие в иных клинических испытаниях менее чем за 30 дней до включения в настоящее исследование.
Первоначально по протоколу планировалось включение в исследование 60 пациентов при дисперсии (ς) показателей индекса IPSS в группах 10% и гарантированном выявлении отличий (δ) в эффекте между препаратами 5% по указанному показателю для обеспечения 80% мощности (β) испытания при чувствительности (α) 5%.
В исследование было отобрано 46 пациентов, критерии включения выполнены по 42 пациентам, которые и вошли в испытание – популяция ВВБ. Первую группу (основную) составили 20 пациентов, принимавших Унопрост, вторую (контрольную) – 22 пациента, принимавших Простамол УНО.
Фактическая мощность исследования на 42 пациентах показала величину дисперсии 4,7%, что для гарантированного уровня выявления отличий (δ) в эффекте между препаратами 5% по указанному показателю при чувствительности (α) 5% давало мощность 100% (при стремлении ошибки второго рода к 0). Как следует из представленного на рис. 3 графика, для данного уровня величины дисперсии достаточная мощность исследования была достигнута уже после включения в каждую группу 10 пациентов.
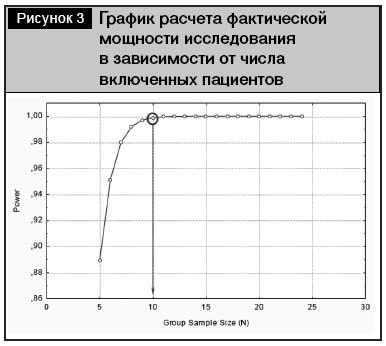
В ходе выполнения протокола из исследования выбыло 5 пациентов, у одного пациента протокол был завершен досрочно в связи с осложнением течения сопутствующего заболевания. Таким образом, испытание окончили 36 пациентов (по 18 в каждой группе) – популяция ПП.
Средний возраст пациентов составил 73,9±9,4 года (медиана возраста 74 года) в группе контроля и 70,0±10,6 года (медиана возраста 73 года) в опытной группе. Индекс массы тела в группах составлял соответственно 26,5±2,9 и 28,3±5,2 кг/м2. При этом группы статистически не отличались между собой по демографическим показателям (р>0,05).
Показатели исходного (при включении) уровня PSA составляли 2,13±1,76 нг/мл в группе Унопроста и 2,69±2,23 нг/мл – в группе Простамола УНО.
Данные о сопутствующей патологии у пациентов представлены в табл. 3, о сопутствующей терапии – в табл. 4.
Характеристика групп Простамол УНО и Унопрост по наличию у пациентов сопутствующей патологии, абс, %
|
Нозология
|
Простамол УНО
|
Унопрост
|
|
ИБС. Стенокардия
|
8 (36,4±10,3)
|
5 (25,0±9,7)
|
|
Артериальная гипертензия
|
4 (18,2±8,2)
|
0
|
|
ХОБЛ
|
1 (4,5±4,4)
|
0
|
|
Хронический гастрит
|
1 (4,5±4,4)
|
1 (5,0±4,9)
|
|
МКБ
|
1 (4,5±4,4)
|
0
|
|
Сахарный диабет
|
0
|
2 (10,0±6,7)
|
Характеристика сопутствующей фармакотерапии в группах, абс, %
|
Лекарственный препарат
|
Простамол УНО
|
Унопрост
|
|
Ингибиторы АПФ
|
8 (36,4±10,3)
|
5 (25,0±9,7)
|
|
Блокаторы каналов кальция
|
4 (18,2±8,2)
|
0
|
|
Нитраты
|
4 (18,2±8,2)
|
5 (25,0±9,7)
|
|
β-адреноблокаторы
|
2 (9,1±6,1)
|
3 (15,0±8,0)
|
|
β-адреномиметики
|
1 (4,5±4,4)
|
0
|
|
Сульфанилмочевины
|
0
|
1 (5,0±4,9)
|
|
Метформин
|
0
|
1 (5,0±4,9)
|
Первичный параметр эффективности (частота прогрессии заболевания по данным динамики IPSS) оценивался на популяциях ПП и ВВБ. В анализ были включены пациенты, у которых имелись исходное измерение и не менее одного измерения в ходе 12-недельной терапии.
Вторичные параметры эффективности (количественные вторичные параметры – изменение объема предстательной железы и данных урофлуометрии) анализировали с использованием однофакторного дисперсионного анализа (ANOVA) и попарных сравнений методом Ньюмена–Кейлса при выявлении отличий. Анализ выполнялся в популяциях ПП и ВВБ. При этом основное значение имели показатели популяции ВВБ. Категорийные переменные – данные ранговой оценки по шкалам IPSS и интегральной оценки качества жизни в урологии (L) охарактеризованы методом анализа Крускала–Уоллеса при уровне статистической значимости (α=0,05) и мощности метода (1-β=0,8).
Ни в одной из групп не наблюдалось пациентов с прогрессированием заболевания по шкале IPSS после 3 месяцев стандартной терапии лекарственными средствами на основе экстрактов Serenoa repens. Напротив, в обеих группах имела место положительная обратная попарная динамика индекса IPSS, начиная уже с 6-й недели терапии, которая составляла 3,0–4,5 балла (рис. 4).
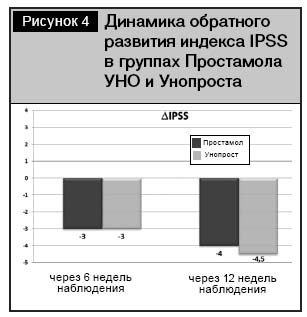
Анализ оценки индекса IPSS в среднем (на 6-й и 12-й неделях терапии), по сравнению с исходными показателями, установил достоверное снижение индекса тяжести расстройства мочеиспускания, обусловленного ДГПЖ в обеих группах, начиная с 6-й недели (рис. 5). IPSS в группе Унопроста снизился с 22 (21÷23) баллов до 15 (12÷17,5) (р<0,01), что было сопоставимо с группой Простамола УНО, где IPSS снизился с 25,5 (21,75÷29,25) до 21 (18,5÷24,25) балла.
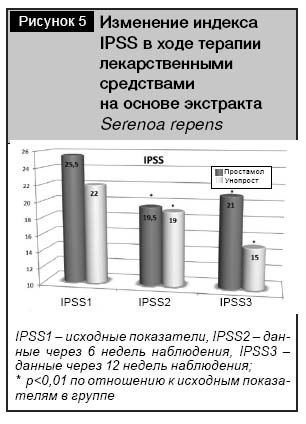
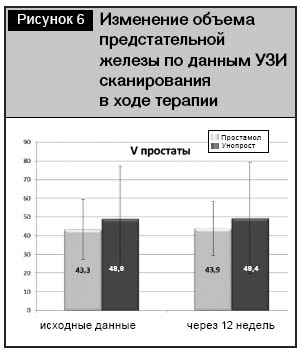
Аналогичное отсутствие негативной динамики отмечено и при анализе показателя объема предстательной железы в ходе УЗ-сканирования. В течение 12-недельного курса терапии не было выявлено статистически достоверных изменений в обеих группах как в сторону увеличения, так и в сторону уменьшения (что, очевидно, свидетельствует об отсутствии способности у данной группы лекарственных средств в целом уменьшать объем простаты на фоне ДГПЖ). Фактические показатели объема предстательной железы у пациентов в группе Простамола УНО составляли 43,3±16,0 см3 в начале терапии и 43,9±14,6 см3 – в конце (р>0,05). В группе Унопроста объем предстательной железы увеличился с 48,9±28,2 до 49,4±29,9 см3 (р>0,05) (рис.6).
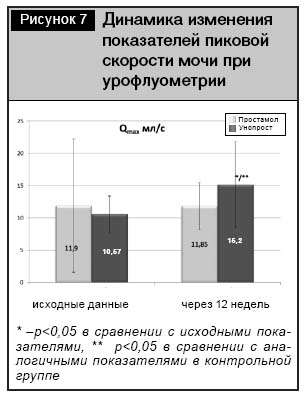
По данным урофлуометрии, в группе пациентов с применением в терапии Унопроста показатели пиковой скорости мочеиспускания в конце 12-недельной терапии были достоверно лучше по сравнению с исходными показателями: 10,6±2,8 мл/с исходно, 15,2±6,6 мл/с – в конце терапии (р<0,05), а также по сравнению с показателями на фоне применения препарата сравнения – Простамола УНО: 11,9±3,6 мл/с (р<0,05) (рис. 7).
В ходе 12-недельной терапии препаратом Унопрост (УП «Минскинтеркапс», Беларусь) у пациентов с ДГПЖ I–II стадии выявлена равная эффективность и безопасность по сравнению с использованием Простамола УНО (Berlin-Chemie AG, Германия) по показателям влияния на скорость прогрессии заболевания и изменения индекса IPSS, отражающего степень прогрессии заболевания. Лечение с использованием Унопроста позволяет добиться достоверно лучших показателей урофлуометрии к 12-й неделе терапии по сравнению с контрольной группой пациентов. Терапия с использованием лекарственных средств на основе экстракта Serenoa repens не сопровождалась развитием симптоматических или лабораторно подтвержденных нежелательных явлений, а также негативными изменениями кардиореспираторных показателей.
Таким образом, белорусские пациенты имеют возможность получать финансово доступное лечение отечественным лекарственным средством Унопрост на основе экстрактаSerenoa repens. Эффективность препарата Унопрост, хорошая переносимость и удобство в применении позволяют рекомендовать его для терапии пациентов с доброкачественной гиперплазией предстательной железы.
Л И Т Е Р А Т У Р А
1. Ellem S.J., Risbridger G.P. // Natur. Rev. Cancer. – 2007. – Vol.7. – P. 621–627.
2. Djavan B. // Eur. Urol. Suppl. – 2007. – Vol.6. – P. 446–453.
3. Saw Palmetto for Benign Prostatic Hyperplasia / S.Bent, C.Kane, K.Shinohara et al. // N. Engl. J. Med. – 2006. – Vol.354, N6. – P.557–566.
4. Esmet P. // N. Engl. J. Med. – 2002. – Vol.347, N25. – P.2046–2056.
5. Gerber G.S. Saw palmetto for the treatment of men with lower urinary tract symptoms // J. Urol. – 2000. – Vol.163. – P.1408–1412.
6. Effects of long-term treatment with Serenoa repens (Permixon) on the concentrations and regional distribution of androgens and epidermal growth factor in benign prostatic hyperplasia / Di Silverio F., Monti S., Sciarra A. et al. // Prostate. – 1998. – Vol.37. – P.77–83.
7. Evidence that Serenoa repens extract displays an antiestrogenic activity in prostatic tissue of benign prostatic hypertrophy patients / F.Di Silverio, G.D’Eramo, C.Lubrano et al. // Eur. Urol. – 1992. – Vol.21. – P.309–314.
8. Induction of apoptosis and inhibition of cell proliferation by the lipido-sterolic extract of Serenoa repens (LSESr, Permixon) in benign prostatic hyperplasia / F.Vacherot, M Azzouz., S.Gil-Diez-De-Medina et al. // Prostate. – 2000. – Vol.45. – P.259–266.
9. Comparison of phytotherapy (Permixon) with finasteride in the treatment of benign prostate hyperplasia: a randomized international study of 1,098 patients / J.C.Carraro, J.P.Raynaud, G.Koch et al. // Prostate. – 1996. – Vol.29. – P. 231–240.
10. Serenoa repens for benign prostatic hyperplasia / T.Wilt, A.Ishani, G.Stark et al. // Cochrane Database Syst. Rev. – 2001. – Vol.2. – CD001423.
11. Saw Palmetto for Benign Prostatic Hyperplasia // N. Engl. J. Med. – 2006. – Vol.354, N18. – P.1950–1951.
Медицинские новости. – 2012. – №12. – С. 93-99.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.