Savchenko M.A., Yarmolovich V.V., Vlasenkova E.S., Boris M.A.
Belarusian State Medical University, Minsk
Usage of thiotriazolinum in outpatient practice: experience and prospects
Резюме. В результате выполненного исследования по амбулаторной терапии пациентов с различными вариантами ИБС тиотриазолином в течение как минимум 30 дней выявлено клинически значимое уменьшение тяжести стенокардии, суточной потребности в препаратах нитроглицерина, положительная динамика инструментальных показателей функции сердца. Выявлено уменьшение количества нарушений ритма, в том числе частой желудочковой экстрасистолии, а также уменьшение числа эпизодов безболевой ишемии миокарда. Получены данные о хорошей переносимости препарата при применении в амбулаторной практике.
Ключевые слова: ишемическая болезнь сердца, метаболическая терапия, тиотриазолин.
Медицинские новости. – 2013. – № 9. – С. 69–74.
Summary: There were studied 4423 patients with different variants of ischemic heart disease, treated with thiotriazolinum for at least 30 days. There was revealed clinically significant reduction of stenocardia, daily requirement in nitroglycerin drugs, and positive dynamics of instrumental indices of heart function. There were observed fewer rhythm disorders, including ventricular beats, and also fewer episodes of painless myocardial ischemia. There was made a conclusion about good tolerance of the drug.
Keywords: ischemic heart disease, metabolic therapy, thiotriazolinum.
Meditsinskie novosti. – 2013. – N 9. – P. 69–74.

Cовременная медицинская наука достигла существенного успеха в увеличении продолжительности жизни, снижении показателей смертности пациентов с социально значимой патологией, в том числе сердечно-сосудистыми заболеваниями. В последние десятилетия активно прогрессирует инвазивная, оперативная тактика ведения пациентов с различными вариантами ишемической болезни сердца (ИБС), также разрабатываются алгоритмы медикаментозного лечения и реабилитационные программы. Особую социальную значимость имеет подгруппа пациентов старшего возраста, число которых прогрессивно увеличивается, причем почти 3/4 случаев смерти от ИБС приходится на лиц старше 65 лет, и почти 80% умерших от инфаркта миокарда относятся к этой возрастной группе [1–3]. Терапия пациентов старших возрастных групп имеет свои особенности, связанные с частым наличием сочетанной патологии, что приводит к ограничениям в применении некоторых лекарственных препаратов, а также с необходимостью использования большого количества лекарств, что приводит к снижению комплаентности пациента. Кроме того, особое внимание у пациентов старшей возрастной группы должно уделяться показателям качества жизни, включая как физические, так и психологические аспекты.
Одним из ключевых патогенетических механизмов прогрессирования ИБС у пожилых и развития ее осложнений является активация свободнорадикального окисления. В результате обеднения васкуляризации и снижения проницаемости капилляров в пожилом возрасте нарушается кислородное снабжение тканей, развивается их гипоксия. Нарушения метаболизма в миокарде заключаются в снижении процессов окислительного фосфорилирования, синтеза макроэргов, появлении тенденции к переходу на анаэробный гликолиз [4]. В связи с этим в последние годы отмечается возобновление использования средств, способных поддержать и улучшить энергетическое состояние клетки миокарда в условиях ишемии в ситуациях, когда гемодинамические возможности уже исчерпаны.
Немаловажным при выборе лечения пациентам с ИБС является понимание того, что в течении данного заболевания имеются периоды нестабильности, поэтому препараты, которые пациент получает регулярно, не должны оказывать негативного воздействия на функцию сердечно-сосудистой системы в случае появления признаков нестабильного состояния. Учитывая это, в настоящее время уделяется существенное внимание исследованию влияния препаратов, в том числе имеющих метаболические эффекты, у пациентов с острым коронарным синдромом, инфарктом миокарда и нестабильной стенокардией [5–8], поскольку накоплен ряд данных (в частности, результаты многоцентрового исследования EMIP-FR) о неоднозначных эффектах некоторых лекарств у пациентов с острой коронарной патологией [9].
В то же время большинство пациентов с ИБС получают амбулаторное лечение, находясь в относительно компенсированном состоянии. Стандарты терапии имеют достаточную доказательную базу и призваны существенно увеличить продолжительность жизни и улучшить ее качество, однако несмотря на большой арсенал медикаментозных средств в лечении наиболее распространенного варианта ИБС, стенокардии, широкомасштабными исследованиями (TRIMPOLII, 2000; TRIKET, 2000) установлено, что 66% пациентов со стенокардией оценивают качество своей жизни как «неудовлетворительное» и «плохое» и лишь 17% не ощущают ангинозных болей. В связи с этим возобновился интерес к применению групп препаратов, способных обеспечить более эффективную жизнедеятельность кардиомиоцита при условии полного соблюдения рекомендаций и стандартов терапии стенокардии.
История применения препаратов неспецифического действия (метаболических средств, антиоксидантов, протекторов и т.д.) имеет свои взлеты и падения. С начала прошлого века количество лекарственных средств этого ряда неуклонно росло, их эффективность была подтверждена во многих исследованиях, и поэтому они были широко внедрены в клиническую практику. Начиная с 1980–90-х гг. ситуация стала меняться, поскольку было выполнено большое количество крупных исследований, базирующихся на принципах доказательной медицины, результаты которых заставили врачей пересмотреть традиционные подходы к назначению неспецифических препаратов. Например, было показано, что эффекты рибоксина, АТФ, кокарбоксилазы практически не отличаются от эффектов плацебо и поэтому назначение этих средств вряд ли можно считать обоснованным. Естественно, что поток подобной информации привел к развитию нигилизма и падению интереса к применению препаратов неспецифического действия. Однако очень скоро пессимистические настроения сменились ощущением вакуума. В последние годы фармакологические компании всего мира занялись поиском новых лекарственных средств неспецифической терапии, которая могла бы стать надежным подспорьем при проведении специфического лечения. За основу были приняты эффективность, безопасность и достоверность получаемых эффектов [10].
В норме между доставкой кислорода к кардиомиоцитам и потребностью в нем имеется четкое соответствие, обеспечивающее нормальный метаболизм и, следовательно, функции клеток сердца. В нормальных условиях основными субстратами для выработки энергии в кардиомиоцитах служат свободные жирные кислоты (СЖК), окисление которых обеспечивает от 60 до 80% синтеза АТФ, и глюкоза (20–40% синтеза АТФ).
Коронарный атеросклероз приводит к развитию дисбаланса между доставкой кислорода к кардиомиоцитам и потребностью в нем, возникает нарушение перфузии миокарда и как следствие – его ишемия. Недостаток кислорода вызывает изменения метаболизма кардиомиоцитов. Ограниченное количество кислорода распределяется между окислением глюкозы и СЖК, причем активность обоих путей метаболизма снижается. При ишемии глюкоза расщепляется преимущественно путем анаэробного гликолиза, образующийся пируват не подвергается окислительному декарбоксилированию, а переходит в лактат, что потенцирует внутриклеточный ацидоз. Остаточный аэробный синтез АТФ осуществляется в основном за счет СЖК, происходит так называемый сдвиг от окисления глюкозы к бета-окислению СЖК. Известно, что такой путь образования АТФ требует больших затрат кислорода и в условиях ишемии оказывается метаболически невыгодным. Избыток СЖК и ацетил-КоА ингибирует пируватдегидрогеназный комплекс и приводит к дальнейшему разобщению процессов гликолиза и окислительного декарбоксилирования, активации свободнорадикального окисления (СРО). Накопление СЖК – основного субстрата СРО – в цитоплазме оказывает повреждающее действие на мембрану кардиомиоцита, нарушает его функции [11–13].
Клеточный ацидоз, локальное воспаление и пероксидация, нарушение ионного равновесия, уменьшение синтеза АТФ лежат в основе развития электрофизиологической и функциональной дисфункции миокарда. Клинические проявления заболевания в данном случае представляют собой по сути верхушку айсберга, в основании которого лежат возникшие из-за нарушений перфузии изменения метаболизма миокарда [14].
Принципиально можно выделить два основных направления метаболической терапии при заболеваниях миокарда – оптимизацию процессов образования и расхода энергии, а также нормализацию баланса между интенсивностью СРО и антиоксидантной защитой.
Первые попытки оптимизации метаболизма миокарда при ИБС были сделаны более 50 лет назад. Одной из первых с этой целью была использована глюкозо-инсулино-калиевая смесь (ГИК). Применение ГИК приводило к увеличению потребления глюкозы, синтеза гликогена, уменьшало высвобождение адипозоцитами СЖК. В 1962 г. Содди-Поллярис в небольшом нерандомизированном исследовании показал, что применение ГИК улучшало раннюю выживаемость больных с острыми формами ИБС. Это же подтвердили более поздние проспективные рандомизированные исследования ECLA [15] и DIGAMI [16], в которых отмечено существенное снижение показателя смертности у больных, перенесших инфаркт миокарда, на фоне введения ГИК. Однако в большинстве работ, включающих в курс лечения назначение ГИК, была выявлена существенная зависимость эффекта от дозы вводимого препарата, что, естественно, осложняло его применение.
Качественно новым этапом в истории метаболической терапии стало создание класса ингибиторов окисления СЖК [17, 18]. На сегодняшний день в этом классе выделяют прямые ингибиторы карнитинпальмитоилтрансферазы-I (пергекселин, этомоксир), парциальные ингибиторы окисления жирных кислот (ранолазин, триметазидин, милдронат) и непрямые ингибиторы окисления жирных кислот (карнитин).
Участие свободных радикалов в сердечно-сосудистой патологии в настоящее время не вызывает сомнений. В частности, при стенокардии активация перекисных процессов обусловлена частыми ангинальными приступами, вызывающими гиперкатехоламинемию, стимулирующую липолиз, в результате которого увеличивается содержание СЖК, являющихся доступным субстратом для окисления. При гипоксии (ишемии) миокарда окислительные процессы в митохондриях кардиомиоцитов нарушаются, в результате чего накапливаются промежуточные метаболиты цикла Кребса, крайне легко подверженные восстановлению с образованием свободных радикалов и перекисных соединений, угнетающих систему антиоксидантной защиты. В конечном итоге создается парадоксальная ситуация – уменьшение кислорода в клетке приводит к увеличению кислородных радикалов. Развивающаяся после каждого эпизода транзиторной ишемии реперфузия миокарда также сопровождается значительной (в сотни раз) активацией свободнорадикальных процессов и выбросом липопероксидов в кровоток. Выраженная активация процессов СРО и следующая за ним реакция тканей и систем организма получили название оксидативного стресса [19, 20].
Особенно значим этот момент у пожилых людей, один из ключевых патогенетических механизмов прогрессирования ИБС и развития ее осложнений у которых связан именно с активацией СРО (преимущественная роль активации СРО в патогенезе ИБС у лиц старшего возраста обусловлена доказанной значимостью перекисных процессов в механизме старения).
Современным направлением фармакологического поиска эффективных антиишемических препаратов является создание лекарственных форм, обладающих антиишемической, метаболической и антиоксидантной активностью, при этом имеющих минимальное количество побочных эффектов. В качестве примера такого фармакологического средства предложен препарат «Тиотриазолин» (фармацевтическая корпорация «Артериум»), обладающий как метаболическим, так и антиоксидантным эффектом. В основе противоишемического эффекта тиотриазолина лежит его способность усиливать компенсаторную активацию анаэробного гликолиза, снижать степень угнетения окислительных процессов в цикле Кребса с сохранением внутриклеточного фонда АТФ, стабилизировать метаболизм кардиомиоцитов. В то же время тиотриазолин активирует антиоксидантную систему ферментов и тормозит процессы перекисного окисления липидов в ишемизированных участках миокарда. Тиотриазолин активирует антирадикальные ферменты – супероксиддисмутазу и каталазу, глутатионпероксидазу, способствует экономии расхода токоферола. Препарат тормозит образование начальных и конечных продуктов реакции перекисного окисления липидов в патологически измененных тканях, тем самым защищает структурно-функциональную целостность мембран кардиомиоцитов. Препарат снижает чувствительность мио-карда к адренергическим кардиостимулирующим воздействиям катехоламинов и препятствует прогрессивному угнетению сократительной функции миокарда, повышает устойчивость кардиомиоцитов к гипоксии [21–24].
Клинические эффекты тиотриазолина подтверждены большим количеством исследований, посвященных изучению влияния препарата на функциональное состояние сердечно-сосудистой системы [25], течение ИБС [26], качество жизни пациентов, получающих препарат, а также сравнительной эффективности тиотриазолина и других лекарственных средств с метаболическим действием [27].
Многими исследователями подчеркивается важный эффект тиотриазолина, связанный с его действием на уровне клеток не только миокарда, но и печени, ЦНС, что оказывает множественные положительные эффекты у пациентов с полиорганной патологией, которым требуется длительная терапия сочетанием различных лекарственных средств, включая гепатотоксичные [28, 29].
Для врача, проводящего лечение в амбулаторных условиях, немаловажное значение имеют не только клинические эффекты препарата, но и личная оценка пациентом эффективности и переносимости лекарства. В рамках большого исследования, проведенного в Республике Беларусь [30], было продемонстрировано существенное положительное влияние на различные показатели качества жизни пациентов с кардиологической патологией, хорошая переносимость и приверженность к лечению при включении тиотриазолина в схему амбулаторной терапии.
Цель исследования – изучение влияния включения в терапию пациентов кардиологического профиля тиотриазолина в эффективной терапевтической дозе (600 мг/сут) в течение не менее чем 30 дней.
Материалы и методы
Исследование проводилось в 2013 г. на базе ЛПУ всех областей Республики Беларусь. В исследование включены 4423 пациента (1529 мужчин, 2894 женщины) в возрасте от 18 до 96 лет. Наибольшее число участников исследования относились к возрастной группе старше 65 лет (40,3% женщин и 35% мужчин). Основные диагнозы, с которыми наблюдались пациенты, представлены в табл. 1.
Таблица 1. Основные нозологии пациентов, включенных в исследование
|
Ведущий клинический диагноз
|
Количество
пациентов
|
% от общего числа включенных
в исследование
|
|
ИБС
|
3418
|
77,3
|
|
Стенокардия напряжения
|
2330
|
52,7
|
|
Постинфарктный кардиосклероз
|
1022
|
23,1
|
|
Нарушения ритма и проводимости
|
1566
|
35,4
|
|
Хроническая сердечная недостаточность
|
730
|
16,5
|
|
Артериальная гипертензия
|
104
|
2,4
|
|
Миокардиодистрофии различного генеза
|
266
|
6,0
|
При включении в исследование все пациенты осматривались врачом, проводилась оценка жалоб, данных анамнеза, объективное исследование, запись ЭКГ, лабораторные исследования, части пациентов выполнено эхокардиографическое исследование (ЭхоКГ), велоэргометрическая проба (ВЭП). Данные вносились в анкету и повторно изучались после как минимум 30-дневного лечения тиотриазолином. Оценка эффективности терапии проводилась по динамике изученных показателей и жалоб пациентов, отмеченных в конце исследования. Все участники исследования принимали тиотриазолин параллельно с препаратами основных фармакологических групп согласно своему заболеванию, и на фоне исследования у 97% пациентов корректировка этих назначений не проводилась.
Основные жалобы, которые учитывались для оценки эффективности присоединения к терапии тиотриазолина, касались возможных клинических проявлений ИБС. В начале терапии боль в области сердца отметили 2087 человек (47,2%), дискомфорт в области сердца, связанный с физическим и психологическим напряжением, – 2924 (66,1%), одышку – 2264 (51,2%), ощущение перебоев в работе сердца различной степени выраженности – 2149 (48,6%), низкую толерантность к физическим нагрузкам – 2144 пациента (48,5%).
Кроме клинических проявлений и данных лабораторных и инструментальных исследований, оценивалась также потребность пациентов с ИБС в приеме препаратов нитроглицерина (короткого действия и пролонгированных), среднесуточная доза ?-адреноблокаторов в случае их применения по поводу нарушений ритма, а также блокаторов кальциевых каналов.
Результаты и обсуждение
Курс лечения тиотриазолином продолжительностью не менее 30 дней закончили 4077 пациентов (92,2%). Среди выбывших из исследования один человек умер, 39 отказалось от приема препарата по причине финансовых затруднений в его приобретении, остальные не явились на контрольное обследование.
По итогам курса терапии 4034 пациента (98,9%) отметили улучшение состояния, которое выразилось в увеличении толерантности к физической нагрузке (3504 человека, 85,9%), уменьшении интенсивности болей и эпизодов дискомфорта в области сердца (2666 пациентов, 65,4%), снижении потребности в приеме нитроглицерина и пролонгированных нитратов (1505 человек, 36,9%), причем у 422 пациентов (11%) полностью исчезла потребность в приеме нитроглицерина для купирования приступов стенокардии, у остальных уменьшилась среднесуточная доза препаратов.
При оценке изменений в результатах инструментальных исследований (ЭКГ, ЭхоКГ, ВЭП), после курса терапии тиотриазолином отмечена положительная динамика. Из общего числа пациентов, включенных в исследование, ЭхоКГ в динамике выполнена в 375 случаях. Положительные изменения, выразившиеся в увеличении фракции выброса (ФВ), снижении конечно-систолического (КСО) и конечно-диастолического (КДО) объемов приведены в табл. 2.
Таблица 2. Изменение гемодинамических показателей по данным ЭхоКГ
|
Показатель
|
До начала терапии
|
После курса терапии
|
|
ФВ, %
|
44 ± 1,7
|
50 ± 1,5*
|
|
КСО ЛЖ, мл
|
43 ± 2,8
|
39 ± 1,4
|
|
КДО ЛЖ, мл
|
55 ± 2,6
|
47 ± 2,2*
|
*Изменения достоверны в пределах подгруппы (р < 0,05).
Также существенной оказалась положительная динамика ЭКГ на фоне терапии тиотриазолином. Особый интерес, по нашему мнению, представляет подгруппа пациентов, у которых на момент включения в исследования изменения ЭКГ трактовались как наличие безболевой ишемии миокарда (БИМ, 333 человека, 7,5% от общего количества включенных в исследование). Известно, что данная категория пациентов является угрожаемой по развитию неблагоприятных исходов, в связи с отсутствием явных клинических проявлений кардиальной патологии и, соответственно, отсутствием превентивной терапии. После курса лечения с использованием тиотриазолина, достигнуто уменьшение количества эпизодов депрессии сегмента ST (p < 0,05), что расценено как исчезновение признаков БИМ, у 115 пациентов (34,5%).
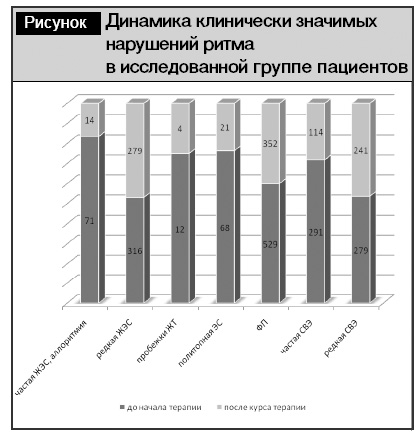
Нельзя не отметить положительное воздействие проведенной терапии на наличие и выраженность различных нарушений ритма у исследованных пациентов. Выявленные изменения представлены на рисунке.
Полученные данные свидетельствуют о достигнутом уменьшении на фоне терапии тиотриазолином как общего числа нарушений ритма, так и потенциально опасных аритмий. Обращает на себя внимание уменьшение числа экстрасистолий «высоких градаций» (частая желудочковая экстрасистолия (ЖЭС), аллоритмия – с 71 до 14, пробежки желудочковой тахикардии (ЖТ) – с 12 до 4, политопная экстрасистолия – с 68 до 21 эпизода), суммарно со 151 до 39 случаев (–75%), что имеет положительное прогностическое значение у пациентов с ИБС. Аналогичная динамика отмечена у пациентов с суправентрикулярными экстрасистолиями (СВЭ), в частности, выявлено уменьшение частой СВЭ с 291 до 114 случаев (–60%). Отсутствие динамики количества редких ЖЭС и СВЭ свидетельствует о «перераспределении» пациентов в подгруппы с более благоприятными вариантами нарушений ритма.
По окончании курса терапии тиотриазолином выявлено также уменьшение количества пациентов с фибрилляцией предсердий (ФП). Однако учитывая то, что около 50% всех случаев ФП относились к пароксизмальной форме данного нарушения ритма, мы не посчитали возможной интерпретацию данных изменений как результат применения тиотриазолина без длительного динамического наблюдения за пациентами, что в рамках проведенного исследования не представлялось возможным.
Полученные данные согласуются с результатами большого количества исследований, в рамках которых также оценивалось влияние препарата на нарушения ритма и проводимости [31].
Поскольку в последние годы пристальное внимание уделяется исследованию влияния тиотриазолина на течение стенокардии, в рамках проведенного исследования выполнялась клиническая оценка изменения функционального класса (ФК) стенокардии напряжения, а также у 98 пациентов выполнена ВЭП до и после курса терапии. Получены следующие результаты (табл. 3).
Таблица 3. Клиническая динамика степени тяжести стенокардии
|
Стенокардия
|
До начала терапии
|
После курса лечения
|
Динамика
|
|
ФК I
|
230
|
573
|
+149,1%
|
|
ФК II
|
1487
|
1331
|
–10,5%
|
|
ФК III
|
616
|
220
|
–64,3%
|
|
ФК IV
|
33
|
17
|
–48,5%
|
|
Спонтанная
|
1
|
1
|
0
|
Полученные результаты свидетельствуют о положительном влиянии включения в схему терапии пациентов с различными ФК стенокардии тиотриазолина, поскольку это приводит к достоверному сдвигу в сторону более легкого течения стенокардии. Некоторые численные отличия подгрупп до и после лечения связаны с тем, что 225 пациентов с исходным диагнозом стенокардии напряжения не закончили исследование.
По данным ВЭП выявлена сходная динамика. До начала терапии ФК стенокардии по данным ВЭП составил 2,03 ± 0,1, после проведенного лечения – 1,6 ± 0,11 (p < 0,05). Отмечено достоверное увеличение пороговой мощности (84,1 ± 6,1 Вт против 108,6 ± 6,9 Вт, p < 0,05).
О влиянии тиотриазолина на течение хронической сердечной недостаточности (ХСН) судили по динамике определяемого лечащим врачом ФК сердечной недостаточности. Так, на момент начала исследования из 730 пациентов, у которых основной клинической проблемой являлась ХСН, ФК III был установлен в 311 случаях (42,6%). По окончании курса терапии число пациентов в данной подгруппе снизилось до 198 (–36,3%). Одновременно произошло увеличение количества пациентов с установленным ФК I ХСН с 22 до 67, что явилось результатом улучшения состояния пациентов с ХСН и, соответственно, «перехода» в более низкий ФК ХСН.
В рамках проведенного исследования уделялось внимание мнению лечащего врача по оценке эффективности терапии с включением тиотриазолина. В более чем 97% случаев врачи оценили результаты лечения как хорошие и удовлетворительные, отметив, что кроме воздействия на тяжесть и характер течения основного заболевания во многих случаях достигнуто улучшение лабораторных показателей печеночной функции, а также уменьшение головных болей, эпизодов головокружения у исследованных пациентов. Отмеченные проявления согласуются с результатами проведенных исследований эффектов тиотриазолина при патологии печени и ЦНС [32–34].
Выводы:
1. Включение в схему амбулаторного лечения пациентов с различными вариантами ИБС тиотриазолина в адекватной терапевтической дозе позволяет достоверно уменьшить клинические проявления стенокардии напряжения, ХСН, снизить потребность в приеме препаратов нитроглицерина и увеличить толерантность к физической нагрузке.
2. Применение тиотриазолина у пациентов с БИМ способствует уменьшению числа выявляемых эпизодов ишемии.
3. Терапия с использованием тиотриа-золина позволяет снизить количество нарушений ритма, в том числе и потенциально опасных.
4. Присоединение тиотриазолина к стандартной терапии хорошо переносится пациентами и положительно оценивается врачами амбулаторной сети, позволяя достигнуть более выраженных положительных результатов лечения пациентов с сочетанной патологией.
Л И Т Е Р А Т У Р А
1. Беловол А.Н., Князькова И.И. // Лiки Украпни. – 2012. – № 5. – С. 51–55.
2. Гасилин В.С. // Рус. мед. журн. – 2001. – № 9. – С. 44–47.
3. Лазебник Л.Б., Конев Ю.В. // Клин. геронтология. – 2008. – № 12. – С. 3–5.
4. Методика применения тиотриазолина в комплексной терапии пациентов пожилого возраста со стабильной стенокардией и стенозирующим поражением коронарных артерий: инструкция по применению / С.А. Мацкевич, Н.А. Манак, И.С. Карпова и др. – Минск, 2011. – 19 с.
5. Ярохно Н.Н., Рифель А.А., Бураков А.А. и др. // Бюл. СО РАМН. – 2006. – № 3. – С.107–111.
6. Лоллини В.А., Лысенко Т.Ф., Андаралова Л.Г., Соловьёва Т.Я. // Мед. новости. – 2008. – № 11. – С. 11–13.
7. Лоллини В.А., Лысенко Т.Ф. // Запорож. мед. журн. – 2010. – № 5. – С. 54–55.
8. Ковш Е.В., Булгак А.Г., Жизневская Э.Э. и др. // Здравоохранение. – 2010. – № 3. – С. 11–13.
9. The EMIP-FR Group. Effect of 48-h trimetazidine on short- and long-term outcomes of patients with acute myocardial infarction with and without thrombolytic therapy. A double-blind, placebo-controlled, randomized trial // Eur. Heart J. – 2000. – Vol. 21. – P. 1537–1546.
10. Савустьяненко А.В. // Новости медицины и фармации. – 2008. – № 15. – С. 19–21.
11. Амосова Е.Н. // Украин. кардиол. журн. – 2000. – № 4. – С. 86–92.
12. Бобров В.О., Кулішов С.К. Адаптаційні ішемічні та реперфузійні синдроми у хворих ішемічною хворобою серця: механізми, діагностика, обґрунтування терапії. – Полтава, 2004. – 240 с.
13. Кальвиньш И.Я. Милдронат – механизм действия и перспективы его применения. – Рига, 2002. – 39 с.
14. Лишневская В.Ю. // Consilium medicum (Украина). – 2008. – № 1. – С. 34–39.
15. Diaz R., Paolasso E., Piegas L. et al. // Circulation. – 1998. – Vol. 98, N 21. – P. 2227–2234.
16. Hess M.L., Okabe E., Poland J. et al. // J. Cardiovasc. Pharmacol. – 1983. – Vol. 5, N 1. – P. 35–43.
17. Coetzee W.A., Enous R., Opie L.H. // Cardiovasc. Drugs Ther. – 1990. – Vol. 4. – P. 806–807.
18. Lopaschuk G., Wambolt R., Barr L. // J. Pharm. Exp. Therap. – 1993. – Vol. 264. – P. 135–144.
19. Hulsmann W.C. // Cardiovasc. Drugs Ther. – 1991. – Vol. 5 (Suppl. 1). – P. 7–10.
20. Cole P.L., Beamer A.D., McGowan N. et al. // Circulation. – 1990. – Vol. 81, N 4. – P. 1260–1270.
21. Визир А.Д., Березин А.Е., Крайдашенко О.В. // Украин. кардиол. журн. – 1996. – № 4. – С. 15–17.
22. Геруш О.В., Косуба Р.Б., Піняжко О.Р. Реальні ефекти тіотриазоліну: метод. рекоменд. – Кипв, 2003. – 21 с.
23. Дунаев В.В., Белай И.М., Мазур А.И., Тишкин В.С. Оценка фармакодинамических эффектов тиотриазолина при гиперлипидемии // Актуальні питання фармацевтичної та медичної науки і практики: зб. наук. статей. – Запоріжжя, 2002. – Вип. 8. – С. 70–73.
24. Мазур И.А., Волошин Н.А., Чекман И.С. и др. Тиотриазолин: фармакологические аспекты и клиническое применение. – Запорожье, 2005. – 160 с.
25. Кошля В.I., Дмитрiева С.М., Зеленська Л.М. и др. // Медицина Світу. – 2004. – Додаток. – С. 5–10.
26. Нетяженко В.З., Мальчевская Т.И. и др. // Здоров’я Украпни. – 2010. – № 22. – С. 3–5.
27. Стренко Ю.Н., Радченко А.Д., Михеева К.В. и др. // Здоров’я Украпни. – 2012. – № 9. – С. 8–10.
28. Клячин А.И., Румянцева О.И. // Вопросы наркологии. – 2011. – № 3. – С. 63–68.
29. Трофимова Т.С. Экспериментальные исследования эффективности тиотриазолина в условиях доксорубициновой кардиомиопатии: автореф. дис. … канд. мед. наук. – Одесса, 2008. – 29 с.
30. Савченко М.А., Тетерюков А.А., Савченко А.А. и др. // Мед. новости. – 2011. – № 4. – С. 42–47.
31. Метаболические кардиопротекторы: фармакологические свойства и применение в кардиологической практике: метод. рекоменд. / В.А. Визир, И.Н. Волошина, Н.А. Волошин и др. – Запорожье, 2006. – 35 с.
32. Коваленко С.И., Беленичев И.Ф., Бухтиярова Н.В. // Запорож. мед. журн. – 2004. – № 1. – С. 1–7.
33. Дунаев В.В., Коваленко С.И. // Biomedical and Biosocial Anthropology. – 2004. – № 3. – С. 113–115.
34. Мазур И.А., Волошин Н.А., Чекман И.С. и др. // Сучасна гастроентерологiя. – 2006. – № 1. – С. 71–74.
Статья размещена на сайте www.mednovosti.by (Архив МН) и может быть скопирована в формате Word.
Медицинские новости. – 2013. – №9. – С. 69-74.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.