Divakova T.S., Famina M.P.
Vitebsk State Order of Peoples’ Friendship Medical University, Belarus
Effects of dydrogesterone and acetylsalicylic acid on placental angiogenesis in complicated pregnancies
Резюме. Обследовано 96 женщин с осложненной одноплодной маточной беременностью, из них 55 беременных получали дидрогестерон (20 мг в сутки с 7-й по 20-ю неделю гестации) и ацетилсалициловую кислоту (75 мг в сутки с 12-й по 26-ю неделю), 42 обследованные не получали данных препаратов. Эффект терапии оценивали по данным 3D-допплерометрии плаценты в 8–15 недель гестации, ангиогенному статусу материнской крови (васкулярный эндотелиальный и плацентарный фактор роста, растворимые рецепторы-1 и -2 к васкулярному эндотелиальному фактору роста) в 18–22 недели гестации и исходам беременности. Терапия дидрогестероном и ацетилсалициловой кислотой при осложненном течении беременности в I–II триместрах способствовала росту плацентарной васкуляризации (р<0,01), снижению перфузии плаценты (р<0,01), нормализации баланса ангиогенных факторов в крови беременных, снижению риска развития гестоза (р=0,01), синдрома задержки роста плода (р=0,04), перинатальной гипоксически-ишемической энцефалопатии (р=0,006) и асфиксии новорожденных (р=0,003).
Ключевые слова: осложненная беременность, плацентарный ангиогенез, дидрогестерон, ацетилсалициловая кислота.
Медицинские новости. – 2014. – № 2. – С. 67–72.
Summary. The study involved 96 women with complicated singleton pregnancies, of these, 55 pregnant women received dydrogesterone (20 mg per day from the 7th to the 20th weeks’ gestation), and acetylsalicylic acid (75 mg per day from the 12th to the 26th weeks’ gestation), 42 pregnant women have no such treatment. Effect of the therapy was evaluated using 3D-power Doppler of placenta at 8–15 weeks’ gestation, the angiogenic status of maternal blood (vascular endothelial growth factor, placental growth factor, soluble receptors 1 and 2 for vascular endothelial growth factor) at 18–22 weeks’ gestation and pregnancy outcomes. Dydrogesterone and acetylsalicylic acid treatment in complicated pregnancies at the first and the second trimesters increased placental vasculature (p<0.01), decreased placental perfusion (p<0.01), balanced angiogenic factors in maternal blood, reduced the risk of preeclampsia (p=0.01), fetal growth restriction (p=0.04), perinatal hypoxic-ischemic encephalopathy (p=0.006) and neonatal asphyxia (p=0.003).
Keywords: complicated pregnancy, placental angiogenesis, dydrogesterone, acetylsalicylic acid.
Meditsinskie novosti. – 2014. – N 2. – P. 67–72.
Плацентарная недостаточность представляет собой мультифакториальный синдром, сопровождающий практически все гестационные осложнения (невынашивание, гестоз, синдром задержки роста плода и др.), поскольку в их основе лежит общий патогенетический механизм – анатомические нарушения плацентации и аномальный плацентарный ангиогенез [6, 9, 10, 14].
В основе физиологически протекающей плацентации в I–II триместре гестации лежит трансформация спиральных артерий плацентарного ложа, заключающаяся в их дилатации и формировании трофобластических «пробок», которые закрывают просветы этих сосудов, но постепенно рассеиваясь к 12-й неделе беременности, обусловливают начало материнского кровотока в межворсинчатом пространстве плаценты [3, 14, 37]. Нормальное развитие плаценты зависит не только от полноценной инвазии трофобласта, но и от активности плацентарного ангиогенеза [10]. Цитотрофобласт плаценты является источником проангио-генных факторов роста – васкулярного эндотелиального фактора роста (VEGF) и плацентарного фактора роста (PlGF). В I триместре физиологической беременности преобладает экспрессия VEGF, тогда как в III триместре наблюдается преобладание секреции PlGF. Смена баланса между VEGF и PlGF на протяжении беременности объясняет смену ангиогенеза в ворсинах от преимущественно разветвляющего типа к неразветвляющему. Разветвляющий ангиогенез – необходимое условие быстрого роста плаценты в I–II триместре, а неразветвляющий ангиогенез, сопровождающийся увеличением длины капилляров, необходим для образования терминальных ворсин в III триместре [2].
Патологическая плацентация обусловлена отсутствием трофобластических «пробок» в узких просветах большинства спиральных артерий в результате снижения инвазии трофобласта. Это определяет преждевременный материнский кровоток и повышение концентрации кислорода в межворсинчатом пространстве плаценты, которые на ранних этапах беременности повреждают уязвимое хориальное дерево, вызывая развитие ретроплацентарных и/или субхориальных гематом, спонтанные выкидыши [4, 28]. Локальные кровоизлияния в маточно-плацентарной зоне развивающейся плаценты обусловливают накопление тромбина, увеличивающего экспрессию в децидуальных клетках трофобласта рецептора-1 VEGF (VEGFR-1), который является рецептором-«ловушкой» для VEGF и PlGF, вызывая их блокаду [27, 30, 31, 48]. Узкий просвет неподвергшихся гестационной трансформации спиральных артерий и антиангиогенный эффект тромбина обусловливают плацентарную ишемию, которая на ранних этапах беременности замедляет ангиогенез и ремоделирование спиральных артерий, а на поздних сроках увеличивает активность VEGF и VEGFR-1, способствуя снижению экспрессии PlGF [1, 15, 29, 35, 43, 46]. Такое нарушение баланса факторов роста в III триместре беременности определяет преобладание разветвляющего ангиогенеза и дефектный неразветвляющий ангиогенез с дефицитом терминальных ворсин в плаценте [19, 20]. Дисбаланс про- и антиангиогенных факторов приводит к дисфункции эндотелия и клинически проявляется гестационными осложнениями (гестоз, синдром задержки роста плода, преждевременные роды и др.) [2, 11, 15, 44, 45]. Проблему для акушеров-гинекологов составляет тот факт, что плацентарные нарушения формируются в I–II триместре гестации, протекая обычно бессимптомно либо с проявлениями угрожающего или начавшегося выкидыша [14, 23]. Клиническая манифестация плацентарной недостаточности в III триместре гестации заставляет применять малоэффективную многокомпонентную терапию, обусловливая полипрагмазию и реперфузионные повреждения плаценты, требуя досрочного родоразрешения [24, 36, 47].
Современный подход к терапии плацентарной недостаточности основывается на применении низких доз ацетилсалициловой кислоты, прогестерона и его аналогов в I–II триместре гестации [16–18, 38]. По данным ряда исследователей, применение низких доз ацетилсалициловой кислоты, начиная с ранних сроков беременности, может способствовать снижению риска развития гестоза, синдрома задержки роста плода и перинатальной смертности [7, 21, 38, 40]. Ацетилсалициловая кислота уменьшает сократительную активность миометрия и вызывает вазодилатацию в области плацентарного ложа, подавляя пролиферацию гладкомышечных клеток сосудов, блокируя циклооксигеназу (ЦОГ), снижающую синтез простагландинов (PGЕ1, PGЕ2) и тромбоксана А2 [33, 38, 41, 42]. Ацетилсалициловая кислота в низкой дозе (75–100 мг/сутки) снижает экспрессию VEGF через подавление гиперагрегационной активности тромбоцитов и блокаду синтеза PGE2, обладающего проангиогенным эффектом. Снижение экспрессии VEGF к концу II триместра беременности усиливает активность неразветвляющего ангиогенеза и формирование терминальных ворсин в плаценте в III триместре [22, 34, 41, 42].
Прогестерон улучшает условия миграции трофобласта в I–II триместре гестации путем стимуляции роста и ремоделирования спиральных артерий матки, увеличивая экспрессию VEGF и его рецептора-2 (VEGFR-2) [26]. В децидуальной оболочке прогестерон снижает содержание интерлейкина-8 (медиатор нейтрофильной инфильтрации и некроза при отслойке хориона) и ЦОГ, способствующей экспрессии PGE2, подавляя сократительную активность миометрия [30, 32]. По данным ряда авторов, применение перорального дидрогестерона (ретропрогестерон) или вагинального микронизированного прогестерона может значительно снизить частоту самопроизвольных абортов и преждевременных родов, респираторного дистресс-синдрома у новорожденных, неонатальной заболеваемости и смертности [17, 25, 39]. Однако следует учитывать, что наличие антител к прогестерону почти у 42% женщин с привычным невынашиванием усилит сенсибилизацию от применения прогестерона, обусловливая отсутствие эффекта от лечения. В таких ситуациях преимущество будет иметь дидрогестерон [8]. Польские исследователи сравнили эффективность применения перорального дидрогестерона и вагинального микронизированного прогестерона у беременных с угрожающим выкидышем в I триместре гестации [18]. Данное исследование выявило статистически значимое снижение 2D-допплеровских индексов кровотока (систоло-диастолическое отношение, индекс резистентности, пульсационный индекс) в спиральных артериях плацентарного ложа в группе, принимавшей микронизированный прогестерон вагинально. Напротив, в группе беременных с назначением дидрогестерона внутрь происходило лишь снижение систоло-диастолического отношения кровотока в маточных артериях, интерпретируемое авторами как показатель с низкой диагностической ценностью. В данном исследовании спорной является оценка 2D-допплеровских индексов в спиральных артериях матки, поскольку количество этих сосудов варьирует от 100 до 170, определяя сложность оценки 2D-допплеровских показателей кровотока в каждой из артерий. В результате неясно, в какой из зон плацентарного ложа (центральная, парацентральные, краевые) исследователи определяли кровоток в спиральных артериях, в скольких спиральных артериях проводили оценку кровотока. Отсутствие стандартизации 2D-допплерометрии спиральных артерий заставляет с осторожностью интерпретировать полученные данные.
Применение 3D-допплерометрии для оценки кровотока во всем объеме плаценты и ее ложа в I–II триместре гестации, определение ангиогенных факторов роста в сыворотке крови беременных обусловливают необходимость дальнейшего изучения влияния лекарственных средств на плацентарный ангиогенез, что позволит перевести эмпирическую профилактику плацентарных нарушений в диагностически обоснованную терапию [5, 12, 13].
Цель исследования – изучение влия-ния дидрогестерона и ацетилсалициловой кислоты на плацентарный ангиогенез при осложненном течении беременности.
Материалы и методы
Обследовано 96 женщин с осложненным течением одноплодной маточной беременности в возрасте 28,1±5,3 года (основная группа) и 22 пациентки в возрасте 25,7±4,8 года с физиологической беременностью, родами и послеродовым периодом, родившие живых доношенных здоровых детей (контрольная группа). В основную группу включены беременные с отягощенным акушерско-гинекологическим анамнезом (гестоз с преждевременной отслойкой нормально расположенной плаценты, синдромом задержки роста или внутриутробной гибелью плода во время предыдущей беременности, привычное невынашивание, прогестерон-дефицитные состояния и хронический эндометрит), осложненным течением беременности в I–II триместре (угрожающий и начавшийся выкидыш, предлежание плаценты, аномалии и опухоли матки, операции на яичниках и матке во время беременности), плацентарными нарушениями в I–II триместре по данным ультразвукового исследования (УЗИ) в режимах 2D и 3D. Критериями исключения были: 1) неразвивающаяся маточная беременность; 2) эхографические маркеры хромосомных аномалий у плода (толщина воротникового пространства в 11–14 недель гестации более 95‰, отсутствие визуализации носовых костей); 3) аномальный кариотип и врожденные пороки развития у плода; 4) многоплодная беременность.
С учетом применяемой терапии в I–II триместре гестации беременные основной группы были разделены на 2 подгруппы. В подгруппу I (n=55) вошли женщины, которые принимали дидрогестерон по 10 мг 2 раза в день с 7 недель гестации в течение 6,3±3,2 недели и ацетилсалициловую кислоту по 75 мг в день с 14,5±1,8 недели до 26-й недели беременности. В подгруппе II (n=41) наблюдались беременные, отказавшиеся от приема дидрогестерона и ацетилсалициловой кислоты.
Всем беременным выполнено УЗИ в режиме 2D матки, яичников, плода и экстраэмбриональных структур в 8–15 и 18–22 недели гестации на аппарате Voluson 730 Expert (GE Medical Systems, Австрия) трансвагинальным датчиком (5–9 МГц) с определением размеров плода, места прикрепления пуповины к плаценте, локализации плаценты, параметров кровотока в желтом теле (в 8–10 недель гестации), в маточных артериях и артерии пуповины (с 18 недель гестации). Всем беременным выполнена энергетическая допплерометрия плацентарного кровотока в режиме 3D с оценкой индекса васкуляризации (VI – отражает функциональную плотность кровеносных сосудов в объеме ткани) и индекса кровотока (FI – отражает перфузию ткани кровью) дважды с интервалом в 4 недели в 7–15 недель гестации в программе VOCAL во всем забранном объеме плаценты [5]. С помощью 2D-допплерометрии овариального кровотока при регистрации единичных цветовых локусов с высоким индексом резистентности (ИР>0,5) диагностировали гиповаскуляризацию желтого тела яичников, что косвенно свидетельствовало о дефиците прогестерона. ИР более 95‰ и наличие персистирующей раннедиастолической дикротической выемки в кривой скорости кровотока в обеих маточных артериях или на стороне плацентации при 2D-допплерометрии с 18 недель гестации интерпретировали как патологический маточно-плацентарный кровоток. По данным 3D-допплерометрии плаценты, значения VI менее 10‰ определяли как гиповаскуляризацию плаценты, FI более 95‰ – как гиперперфузию [13]. Иммуноферментным анализом в сыворотке крови беременных в 18–22 недели гестации определяли концентрации VEGF (Вектор-Бест, Россия), PlGF и растворимого рецептора-1 (sVEGFR-1) к васкулярному эндотелиальному фактору роста (Quantikine, R&D Systems, США), растворимого рецептора-2 (sVEGFR-2) к васкулярному эндотелиальному фактору роста (Sigma, США) в соответствии с рекомендациями производителей.
Для статистической обработки применяли компьютерные программы Microsoft Excel 2007 и STATISTICA 6.0. При распределении значений признака, отличного от нормального, использовали непарамет-рический анализ. Для его описания применяли медиану, 25-й и 75-й процентили. Для оценки различий клинических параметров применяли t-критерий Стьюдента и U-критерий Манна – Уитни для независимых выборок. При анализе таблиц сопряженности двух качественных признаков использовали критерий хи2. Отношение шансов (OR) возникновения события представляли с описанием 95% доверительного интервала (ДИ). Статистически достоверными считали значения при р<0,05.
Результаты и обсуждение
Подгруппы I и II были схожи по частоте патологических состояний в анамнезе и во время настоящей беременности (табл. 1).
Таблица 1. Частота патологических состояний в анамнезе и в I–II триместре беременности в основной группе
|
Показатель
|
Основная группа
|
р
|
|
Подгруппа I (n=55)
|
Подгруппа II
(n=41)
|
|
Операции на матке и яичниках в анамнезе
|
5 (9,1%)
|
4 (9,8%)
|
0,91
|
|
Привычное невынашивание
|
11 (20,0%)
|
7 (17,1%)
|
0,72
|
|
Гестоз с антенатальной гибелью плода
в анамнезе
|
1 (1,8%)
|
0
|
0,39
|
|
Аномалии развития матки
|
3 (5,5%)
|
2 (4,9%)
|
0,89
|
|
Операции на матке и яичниках во время беременности
|
3 (5,5%)
|
3 (7,3%)
|
0,72
|
|
Угроза прерывания беременности
|
31 (56,4%)
|
20 (48,8%)
|
0,46
|
|
Артериальная гипертензия
|
8 (14,6%)
|
7 (17,1%)
|
0,74
|
|
Тромбофлебит вен нижних конечностей
|
5 (9,1%)
|
8 (19,5%)
|
0,14
|
|
Хронический пиелонефрит
|
3 (5,5%)
|
6 (14,6%)
|
0,13
|
|
Субклинический гипотиреоз
|
7 (12,7%)
|
9 (21,9%)
|
0,23
|
|
Ожирение I–II степени
|
13 (23,6%)
|
16 (39,0%)
|
0,11
|
П р и м е ч а н и е: достоверность различий значения р между подгруппами I и II по критерию хи2
Плацентарные нарушения в I–II триместре гестации в обеих подгруппах выявлены на основе результатов УЗИ и допплерометрии в режиме 2D (табл. 2). Патологические кривые скоростей кровотока в маточных артериях с обеих сторон или на стороне плацентации при 2D-допплерометрии теоретически позволяют выделить беременных с патологичес-кой плацентацией, которые подвержены высокому риску развития гестоза и синдрома задержки роста плода. Обнаружение патологических кривых скоростей кровотока в маточных артериях после 18 недель гестации в подгруппе II увеличивало риск возникновения гестоза (OR: 6,71 [95% ДИ: 1,23–36,69], р=0,02), синдрома задержки роста плода (OR: 4,09 [95% ДИ: 1,11–15,15], р=0,03).
Таблица 2. Плацентарные нарушения в I–II триместре гестации по данным ультразвукового исследования и допплерометрии маточных и овариальных артерий в режиме 2D в исследуемых группах
|
Показатель
|
Основная группа
|
Контрольная группа
|
|
Подгруппа I
|
Подгруппа II
|
|
Ретроплацентарные и субхориальные гематомы
|
8 (16,4%)*
|
6 (14,6%)
|
0
|
|
Предлежание плаценты
|
10 (18,2%)
|
5 (12,2%)
|
1 (4,5%)
|
|
Аномалии прикрепления пуповины
к плаценте (краевое, оболочечное)
|
15 (27,3%)*
|
8 (19,5%)
|
1 (4,5%)
|
|
Отсутствие визуализации или
гиповаскуляризация желтого тела яичников
|
7 (12,7%)
|
7 (17,1%)*
|
0
|
|
Патологические кривые скоростей
кровотока в маточных артериях
|
8 (16,4%)
|
20 (48,8%)*
|
5 (22,7%)
|
П р и м е ч а н и е: * – достоверность различий показателей в подгруппах I и II в сравнении с таковыми в группе контроля по критерию хи2, р<0,05
Изучение информативности допплерометрии маточных артерий во II–III триместре выявило невысокую чувствительность метода (26,1–59,2%) для прогнозирования плацентарной дисфункции и гестационных осложнений. Это связано со следующими причинами:
1) плацентация продолжается до конца II триместра беременности, что не позволяет окончательно интерпретировать параметры кровотока в маточных артериях, полученные в 18–22 недели гестации;
2) плацентарная недостаточность может быть обусловлена не только неполноценной инвазией трофобласта в спиральные артерии матки, но и облитерацией плацентарных сосудов. Поэтому метод визуализации маточно-плацентарного кровотока in vivo на основе 3D-допплерометрии может быть перспективным для прогнозирования гестационных осложнений и их ранней терапии.
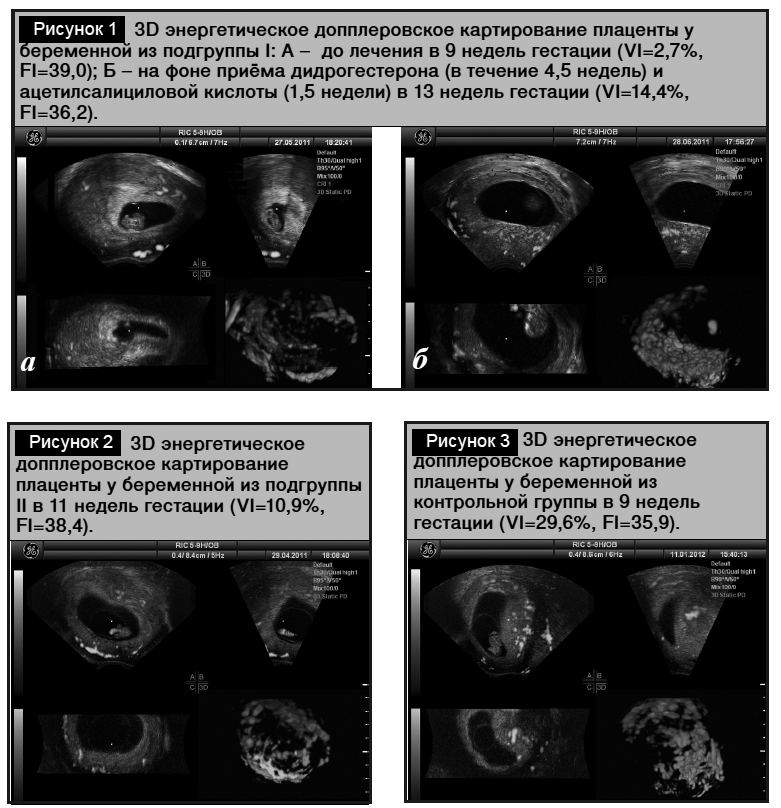
Исследования плацентарного кровотока методом 3D-допплерометрии в подгруппе I до начала приема дидрогес-терона и ацетилсалициловой кислоты, и изначально в подгруппе II выявили низкие значения VI плаценты в отличие от таковых в группе контроля (р=0,006) (табл. 3). Скорость роста VI плаценты с 8-й по 15-ю неделю гестации в подгруппе I после начала терапии дидрогестероном и ацетилсалициловой кислотой была в 1,6 раза выше, чем в подгруппе II (р=0,07) (рис. 1а, 1б, 2). На фоне терапии дидрогестероном с 8-й по 15-ю неделю с включением ацетилсалициловой кислоты с 13-й недели гестации VI плаценты в подгруппе I имел тенденцию к снижению в 1,3 раза в сравнении с таковым в группе контроля (р=0,07), тогда как в подгруппе II продолжали наблюдать гиповаскуляризацию с уменьшением VI плаценты в 1,9 раза (р=0,01) в сравнении с таковым в группе контроля (рис. 3). В подгруппе I на фоне терапии дидрогестероном и ацетилсалициловой кислотой обнаружено снижение FI, соответствующее уменьшению перфузии плацентарного ложа матки в 1,4 раза (p=0,002). В подгруппе II значения FI не отличались от таковых в группе контроля (p=0,24).
Таблица 3. Результаты 3D-допплерометрии плаценты в исследуемых группах в 8–15 недель гестации
|
Индексы плацен-тарного кровотока
|
Основная группа
|
Контрольная группа
|
|
Подгруппа I
|
Подгруппа II
|
|
До лечения
(в 8–12 недель гестации)
|
Контроль через
4 недели
(12–15 недель)
|
УЗИ
в 8–12 недель гестации
|
Контроль через
4 недели
(12–15 недель)
|
УЗИ
в 8–12 недель гестации
|
Контроль через 4 недели
(12–15 недель)
|
|
VI, %
|
9,3 (7,3; 19,6)*
|
20,9 (14,0; 25,7)
|
9,7 (7,9; 18,8)*
|
13,6 (10,9; 18,9)*
|
25,8 (18,1; 29,8)
|
26,1 (22,4; 30,5)
|
|
FI
|
37,9 (33,3; 47,1)
|
31,1 (28,4; 32,8)*
|
36,8 (34,2; 49,0)
|
37,6 (33,8; 46,7)
|
42,2 (37,0; 45,1)
|
42,9 (41,3; 51,4)
|
П р и м е ч а н и е: * – достоверность различий показателя в сравнении с таковым в контрольной группе по U-критерию, p<0,01
Терапия дидрогестероном и ацетилсалициловой кислотой в I–II триместре гестации увеличивала плацентарную васкуляризацию, но снижала перфузию плаценты, определяя непрерывный кровоток в области плацентарного ложа, препятствующий ишемии и реперфузии. Снижение плацентарной перфузии на фоне приема дидрогестерона и ацетилсалициловой кислоты определяет низкое содержание кислорода в матке, защищает трофобласт от разрушения свободными радикалами кислорода, блокируя оксидативный стресс в плаценте [28].
Были выявлены достоверные различия показателей содержания факторов ангиогенеза (VEGF, PlGF, sVEGFR-1) в материнской сыворотке крови в 18–22 недели гестации женщин в подгруппе II в сравнении с таковыми в группе контроля (р<0,03), в то время как в подгруппе I на фоне приема дидрогестерона и ацетилсалициловой кислоты уровни факторов ангиогенеза не отличались от таковых в группе контроля (табл. 4). Результаты исследований показали, что дидрогестерон и ацетилсалициловая кислота нормализуют баланс про- и антиангиогенных факторов при осложненном течении беременности, что согласуется с данными литературы [26, 33, 38]. Ангиогенный статус сыворотки крови беременных к началу III триместра гестации в подгруппе II отражал высокую активность разветвляющего ангиогенеза и глубокое угнетение неразветвляющего ангиогенеза в плаценте, свидетельствуя о плацентарной дисфункции.
Таблица 4. Содержание факторов ангиогенеза в сыворотке крови матери в 18–22 недели беременности в исследуемых группах
|
Уровень факторов ангиогенеза
|
Основная группа
|
Контрольная группа
|
|
Подгруппа I
|
Подгруппа II
|
|
VEGF, пг/мл
|
13,3 (6,2; 25,3)
|
54,9 (28,0; 69,9)**
|
20,0 (7,1; 39,9)
|
|
sVEGFR-1, пг/мл
|
1585,7 (854,4; 2454,7)
|
2478,6 (2243,0; 2587,4)*
|
919,6 (654,4; 1421,3)
|
|
sVEGFR-2, пг/мл
|
12409,6 (8631,7; 17124,2)
|
19221,2 (7952,1; 26296,6)
|
11512,3 (8472,8; 18327,6)
|
|
PlGF, пг/мл
|
186,8 (118,2; 333,8)
|
63,9 (59,3; 78,5)*
|
242,3 (225,3; 252,3)
|
П р и м е ч а н и е: *– достоверность различий показателей в сравнении с таковыми в группе контроля по U-критерию, p<0,05, ** – p<0,01
Анализ акушерских осложнений и перинатальных исходов в обеих подгруппах показал, что прием дидрогестерона (с 7-й по 20-ю недели гестации) и низких доз ацетилсалициловой кислоты (с 13-й по 26-ю неделю) у беременных достоверно снижал риск развития гестоза (OR: 0,16 [95% ДИ: 0,03–0,78], р=0,01), синдрома задержки роста плода (OR: 0,35 [95% ДИ: 0,13–0,99], р=0,04), перинатальной гипоксически-ишемической энцефалопатии (OR: 0,29 [95% ДИ: 0,12–0,71], р=0,006), асфиксии новорожденных (OR: 0,16 [95% ДИ: 0,04–0,61], р=0,003) (табл. 5).
Таблица 5. Акушерские осложнения и перинатальные исходы в основной группе
|
Показатель
|
Основная группа
|
р
|
|
Подгруппа I
|
Подгруппа II
|
|
Гестоз
|
2 (3,6%)
|
8 (19,5%)
|
0,01
|
|
Гестоз средней и тяжелой степени
|
0
|
4 (9,6%)
|
0,04
|
|
Синдром задержки роста плода
|
7 (12,7%)
|
12 (29,3%)
|
0,04
|
|
Преждевременные роды самопроизвольные
|
1 (1,8%)
|
3 (7,3%)
|
0,19
|
|
Преждевременное оперативное родоразрешение
|
4 (7,3%)
|
8 (19,5%)
|
0,08
|
|
Предлежание плаценты
|
2 (3,6%)
|
2 (4,9%)
|
0,75
|
|
Плотное прикрепление плаценты
|
0
|
4 (9,8%)
|
0,02
|
|
Преждевременная отслойка нормально
расположенной плаценты
|
1 (1,8%)
|
1 (2,4%)
|
0,84
|
|
Перинатальная гипоксически-ишемическая
энцефалопатия
|
11 (20,0%)
|
19 (46,3%)
|
0,007
|
|
Асфиксия новорожденного
|
3 (5,5%)
|
11 (26,8%)
|
0,004
|
|
Врожденные пороки сердца
|
0
|
1 (2,4%)
|
0,25
|
|
Гидронефроз у плода
|
0
|
2 (4,9%)
|
0,10
|
П р и м е ч а н и е: достоверность различий значения р между подгруппами I и II по критерию хи2
Терапия дидрогестероном (с 7-й по 20-ю недели гестации) и низкими дозами ацетилсалициловой кислоты (с 13-й по 26-ю неделю) безопасна для матери и плода и не оказывает нежелательных эффектов на исход беременности. В основной группе женщин, принимавших дидрогестерон и низкие дозы ацетилсалициловой кислоты, врожденных аномалий развития у плодов не наблюдалось.
Выводы:
1. Терапия дидрогестероном и низкими дозами ацетилсалициловой кислоты в I–II триместре гестации при плацентарных нарушениях способствует росту плацентарной васкуляризации в 2,3 раза (р<0,01), снижению перфузии плаценты – в 1,4 раза (р<0,01), что поддерживает низкое содержание кислорода в матке на ранних сроках беременности, защищая трофобласт и плод от разрушения активными свободными радикалами кислорода.
2. Дидрогестерон и низкие дозы ацетилсалициловой кислоты в I–II триместре гестации при плацентарных нарушениях нормализуют баланс ангиогенных факторов (VEGF, sVEGFR-1, PlGF) в сыворотке крови беременных, потенцируя смену активности разветвляющего типа ангиогенеза на неразветвляющий к концу II триместра, что определяет физиологическое формирование терминальных ворсин и адекватное созревание плаценты.
Терапия дидрогестероном и низкими дозами ацетилсалициловой кислоты в I–II триместре гестации при плацентарных нарушениях позволяет снизить риск развития гестоза (р=0,01), синдрома задержки роста плода (р=0,04), перинатальной гипоксически-ишемической энцефалопатии (р=0,006) и асфиксии новорожденных (р=0,003).
Л И Т Е Р А Т У Р А
1. Глуховец Б.И., Глуховец Н.Г. Патология последа. – СПб: Грааль, 2002. – С. 248–262.
2. Лукьянова Е.В., Волощук И.Н., Липман А.Д. и др. // Акуш. и гин. – 2009. – № 2. – С. 5–8.
3. Макаров И.О., Юдина Е.В., Боровкова Е.И. Задержка роста плода. Врачебная тактика: учебн. пособие. – М.: МЕДпресс-информ. – 2012. – 56 с.
4. Мерц Э. Ультразвуковая диагнстика в акушерстве и гинекологии / Э. Мерц; пер. с англ.; под ред. А.И. Гуса. – М.: МЕДпресс-информ, 2011. – Т 1: Акушерство. – С. 524–525.
5. Метод диагностики плацентарных нарушений в первом и втором триместре беременности по данным 3D-допплерометрии: инструкция по применению № 010–0213 / М.П. Фомина, Т.С. Дивакова. – Витебск, 2013. – 8 с.
6. Оразмурадов, А.А., Апресян С.В., Радзинский В.Е. Плацентарная недостаточность: реалии и перспективы. – М.: StatusPraesens, 2009. – 32 с.
7. Савоневич Е.Л. Клиническое значение раннего выявления антифосфолипидных антител при невынашивании беременности: автореф. дис. … канд. мед. наук. – Гродно, 2004. – 21 с.
8. Сидельникова В.М. // Гинекология. – 2008. – Т. 10, № 6. – C. 23–26.
9. Сидельникова В.М. Привычная потеря беременности. – М.: «Триада-Х», 2005. – 304 с.
10. Соколов Д.И. // Журн. акуш. жен. болезней. – 2007. – Т. 56, вып. 3. – С. 129–133.
11. Стрижаков А.Н., Игнатко И.В., Тимохина Е.В. и др. // Вестник Росс. АМН. – 2008. – № 11. – С. 50–59.
12. Фомина М.П. // Журн. акуш. жен. болезней. – 2013. – Т. LXII, вып. 2. – С. 160–165.
13. Фомина М.П., Дивакова Т.С. // Здравоохранение. – 2013. – № 3. – С. 4–9.
14. Экстраэмбриональные и околоплодные структуры при нормальной и осложненной беременности: монография / Под ред. В.Е. Радзинского и А.П. Милованова. – М.: МИА, 2004. – 393 с.
15. Banek C.T., Bauer A.J., Gingery A., Gilbert J.S. // Am. J. Physiol. Regul. Integr. Comp. Physiol. – 2012. – Vol. 303, N 6. – P. 658–664.
16. Bujold E., Morency A.M., Roberge S. et al. // J. Obstet. Gynaecol. Can. – 2009. – Vol. 31, N 9. – P. 818–826.
17. Carp H. // Gynecol. Endocrinol. – 2012. – Vol. 28, N 12. – P. 983–990.
18. Czajkowski K., Sienko J., Mogilinski M. et al. // Fertility and Sterility. – 2007. – Vol. 87, N 3. – P. 613–618.
19. Dubova E.A., Alieva L.B., Baibarina E.N. et al. // Bull. Exp. Biol. Med. – 2012. – Vol. 153, N 3. – P. 389–392.
20. Dubova E.A., Pavlov K.A., Lyapin V.M. et al. // Bull. Exp. Biol. Med. – 2013. – Vol. 154, N 6. – P. 792–795.
21. Gauer R., Atlas M. // The Journal of Family Practice. – 2008. – Vol. 57, N 1. – P. 54–56.
22. Goertz O., Ring A., Buschhaus B. et al. // Burns. – 2011. – Vol. 37, N 4. – P. 656–664.
23. Harada A., Sekido N., Akahoshi T. et al. // J. Leukoc. Biol. – 1994. – Vol. 56. – P. 559–564.
24. Harris R.D., Couto C., Karpovsky C. et al. // J. Ultrasound Med. – 2006. – Vol. 25. – P. 757–763.
25. Hassan S.S., Romero R., Vidyadhari D. et al. // Ultrasound Obstet. Gynecol. – 2011. – Vol. 38, N 1. – P. 18–31.
26. Hernandez O.T., Gonzalez-Garcia T.K., Camacho-Arroyo I. // J. Steroid Biochem. Mol. Biol. – 2012. – Vol. 132, N 1–2. – P. 127–134.
27. Jacobs M., Nassar N., Roberts C.L. et al. // Reproductive Biology and Endocrinology. – 2011. – Vol. 9, N 77. – P. 1–8.
28. Jauniaux E., Johns J., Burton G.J. // Ultrasound Obstet. Gynecol. – 2005. – Vol. 25. – P. 613–624.
29. Lamarca B. // Minerva Ginecol. – 2012. – Vol. 64, N 4. – P. 309–320.
30. Lockwood C.J., Paidas M., Murk W.K. et al. // Thromb. Res. – 2009. – Vol. 124, N 5. – P. 516–520.
31. Lockwood C.J., Toti P., Arcuri F. et al. // Am. J. Pathol. – 2007. – Vol. 170, N 4. – P. 1398–1405.
32. Marx S.G., Wentz M.J., Mackay L.B. et al. // J. Histochem. Cytochem. – 2006. – Vol. 54, N 6. – P. 623–639.
33. Meher S., Alfirevic Z. // JUOG. – 2013. – Vol. 41, N 5. – P. 479–485.
34. Nadar S., Blann A.D., Lip G.Y. // Am. J. Hypertens. – 2006. – Vol. 19, N 9. – P. 970–977.
35. Nagi A.H. // Biomedica. – 2011. – Vol. 27. – P. 81–99.
36. Nagy S., Bush M., Stone J. et al. // Orv. Hertil. – 2005. – Vol. 146, N 42. – P. 2157–2161.
37. Pijnenborg R., Brosens I., Romero R. Placental bed disorders: basic science and its translation to obstetrics. – Cambridge University Press, 2010. – 320 p.
38. Roberge S., Nicolaides K.H., Demers S. et al. // JUOG. – 2013. – Vol. 41, N 5. – P. 491–499.
39. Romero R., Yeo L., Miranda J. et al. // J. Perinat. Med. – 2013. – Vol. 41, N 1. – P. 27–44.
40.Ruano R., Fontes R.S., Zugaib M. // Clinics. – 2005. – Vol. 60, N 5. – P. 407–414.
41. Salcedo R., Zhang X., Young H.A. et al. // Blood. – 2003. – Vol. 102, N 6. – P. 1966–1977.
42. Schror K. // Best Pract. Res. Clin. Gastroenterol. – 2011. – Vol. 25, N 4–5. – P. 473–484.
43. Sebire N.J., Sepulveda W. // J. Clin. Pathol. – 2008. – Vol. 61. – P. 1276–1284.
44. Soto E., Romero R., Kusanovic J.P. et al. // J. Matern. Fetal. Neonatal. Med. – 2012. – Vol. 25, N 5. – P. 498–507.
45. Straughen J.K., Kumar P., Misra V.K. // J. Matern. Fetal Neonatal Med. – 2012. – Vol. 25, N 10. – P. 1879–1883.
46. Veas C.J., Aguilera V.C., Munoz I.J. et al. // J. Matern. Fetal Neonatal Med. – 2011. – Vol. 24, N 11. – P. 1371–1377.
47. Yamada T., Atsuki A., Wakasaya M. et al. // J. Obstet. Gynaecol. Res. – 2012. – Vol. 38, N 1. – P. 180–184.
48. Zhao Y., Koga K., Osuga Y. et al. // Fertil. Steril. – 2012. – Vol. 98, N 4. – P. 917–921.
Медицинские новости. – 2014. – №2. – С. 67-81.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.