Trisvetova E.L.
Belarusian State Medical University, Minsk
New anti-ischemic agents in the treatment
of stable angina
Резюме. Стабильная стенокардия – первый симптом ишемической болезни сердца у многих мужчин и женщин, распространенность ее возрастает. За последние годы зарегистрированы новые антиишемические лекарственные препараты: ивабрадин, никорандил, ранолазин, триметазидин, – эффективные для контроля приступов стенокардии, повышения толерантности к нагрузке в монотерапии или в комбинации с ß-адреноблокаторами. Описаны механизмы действия и способы применения названных препаратов.
Ключевые слова: стабильная стенокардия, лечение, антиишемические средства, ивабрадин, никорандил, ранолазин, триметазидин.
Медицинские новости. – 2014. – №6. – С. 11–14.
Summary. Stable angina is the first symptom of coronary artery disease in many men and women, its incidence and prevalence increases. Over the past years new anti-ischemic drugs have appeared. They are ivabradine, nicorandil, ranolazine, trimetazidine, which are effective in control of angina attacks, improvement of tolerance to physical exercise in monotherapy or in combination with ß-blockers. The mechanisms of action and methods of using these drugs are described.
Keywords: stable angina, treatment, anti-ischemic agents, ivabradine, nicorandil, ranolazine, trimetazidine.
Meditsinskie novosti. – 2014. – N6. – P. 11–14.
Стабильная стенокардия является ведущей причиной смерти от сердечно-сосудистых заболеваний населения многих стран мира, первичная заболеваемость увеличивается в связи со старением населения [1]. Распространенность стенокардии в популяции составляет в среднем 3,2%; увеличивается с возрастом: у женщин с 0,1% до 15%, у мужчин с 2% до 20% [2]. В большинстве европейских стран распространенность стабильной стенокардии составляет 20–40 тыс. на 1 млн населения. Регистрируются новые эпизоды заболевания: от 14,1 до 39,3 случая в течение года на 1000 населения в зависимости от возраста, пола, этнической принадлежности [3]. Стабильная стенокардия является первым симптомом ишемической болезни сердца в 40,7% случаев у мужчин и в 56,5% случаев у женщин [2]. Смертность среди пациентов со стабильной стенокардией составляет в среднем 3–5% в год, среди смертей от сердечно-сосудистых заболеваний – 22% у женщин и 20% у мужчин [4].
Клинические проявления типичного приступа стабильной стенокардии: дискомфорт за грудиной (давящая, сжимающая боль, тяжесть, жжение), возникающий при физическом или эмоциональном напряжении, исчезающий после прекращения нагрузки или приема нитратов. Приступ стенокардии возникает вследствие сужения ≥ 70% одного или нескольких основных коронарных артерий и/или ≥ 50% ствола левой коронарной артерии. Коронарный вазоспазм или микрососудистая дисфункция в значительной степени усугубляет кровоток в венечных артериях.
Лечение стабильной стенокардии, включающее изменение образа жизни, контроль факторов риска, медикаментозные и немедикаментозные методы, направлено на улучшение прогноза жизни, предупреждение возникновения внезапной смерти, инфаркта миокарда, уменьшение частоты и интенсивности симптомов, улучшение качества жизни пациента [5]. Назначение медикаментозных средств (дезагрегантов, ?-адреноблокаторов, ингибиторов АПФ, блокаторов рецепторов ангиотензина II, блокаторов кальциевых каналов и нитратов) варьирует в странах Европы. Результаты исследований EUROASPIRE I, II, III, проведенных в 1995–2007 гг., показали в течение 12 лет наблюдения рост применения препаратов, улучшающих прогноз стабильной стенокардии [6] (рис. 1).
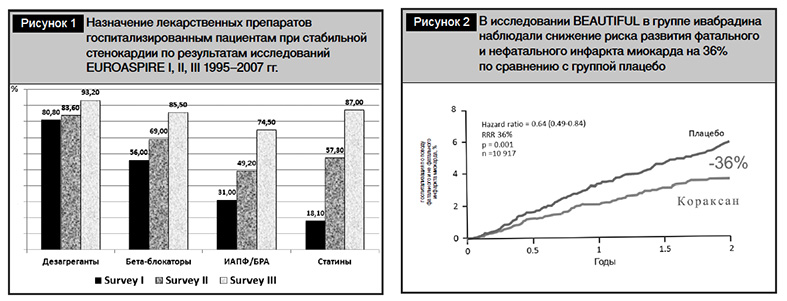
Анализ результатов статистических исследований в европейских странах в последующие годы показал, что дезагреганты применяют 88–99%, статины – 38–90%, ингибиторы АПФ – 46–90% пациентов [7]. Препараты эффективны в виде монотерапии или в комбинации, вместе с тем нежелательные эффекты и противопоказания ограничивают их назначение, снижают приверженность к лечению. С целью контроля симптомов заболевания в Рекомендациях по диагностике и лечению стабильной стенокардии, ESC 2013 г., предложено добавить как препараты второй линии нитраты длительного действия и новые лекарственные средства: ивабрадин, никорандил, ранолазин и триметазидин [2].
Ивабрадин одобрен Европейским агентством по лекарственным средствам (EMEA) в 2005 г. как препарат, связывающийся с f-каналами клеток синусового узла и обладающий ингибирующим действием на пейсмекерный ток If. К свойствам f-каналов относится способность к активации в период гиперполяризации клеточной мембраны под воздействием циклических нуклеотидов вследствие прямого связывания с цАМФ и наличие проницаемости для ионов Na+ и K+ [8]. Под влиянием ивабрадина удлиняется ранняя фаза спонтанной диастолической деполяризации в клетках водителя ритма, увеличивается время наполнения желудочков с сохранением сократительной способности миокарда, обусловливающее повышение ударного объема сердца и поддержание на должном уровне сердечного выброса, происходит дозозависимое уменьшение потребления миокардом кислорода, улучшение регионарной сократимости миокарда в зоне сниженного коронарного кровотока при сохранении дилатации коронарных сосудов при нагрузке. Избирательная блокада If-токов ивабрадином, уменьшая частоту сердечных сокращений, снижает потребность миокарда в кислороде, не влияя на уровень артериального давления, приводит к уменьшению симптомов стенокардии и снижению потребности в применении нитратов [9].
Антиишемическое и антиангинальное действие ивабрадина доказано в международном рандомизированном двойном слепом плацебо-контролируемом исследовании BEAUTIFUL (Morbidity-mortality evaluation of the If inhibitor ivabradine in patients with CAD and left ventricular dysfunction), в котором изучали влияние препарата в сравнении с плацебо на смертность и частоту сердечно-сосудистых событий у пациентов со стабильной ишемической болезнью сердца и систолической дисфункцией левого желудочка на фоне оптимальной медикаментозной терапии [10]. В подгруппах пациентов с исходной частотой сердечных сокращений ≥70 уд/мин, принимавших ивабрадин, отметили снижение частоты госпитализаций по поводу фатального и нефатального инфаркта миокарда на 36% (p=0,001) (рис. 2), частоты госпитализаций в связи с нестабильной стенокардией на 22% (p=0,023), уменьшение частоты возникновения необходимости в проведении коронарной реваскуляризации на 30% (p=0,016). В субисследовании SHIFT у пациентов со стенокардией и ЧСС ≥ 70 уд/мин ивабрадин снизил риск развития инфаркта миокарда на 73% (p=0,002), потребность в реваскуляризации миокарда – на 59% (p=0,04).
В рандомизированном клиническом исследовании получены результаты, доказывающие улучшение показателей теста толерантности к физической нагрузке в случае использования ивабрадина дополнительно к атенололу [11]. Пациентам со стабильной стенокардией, которые не могли по объективным причинам получать ?-адреноблокатор или увеличивать его до рекомендованной дозы для получения клинического эффекта, назначали ивабрадин. Через 2 месяца от начала лечения ивабрадином в дозе 5 мг 2 раза в сутки отмечено улучшение всех оцениваемых показателей пробы с физической нагрузкой, а при увеличении дозы препарата до 7,5 мг 2 раза в сутки наблюдался более выраженный положительный эффект: увеличилось время до появления депрессии сегмента ST, в три раза возросла продолжительность физической нагрузки. Результаты исследования показали, что сочетание ивабрадина и ß-блокатора обеспечивает дополнительный антиишемический эффект и не влияет на безопасность лечения и переносимость препарата.
В исследовании INITIATIVE (The randomized, double-blind International TrIAl on the Treatment of angina with IVabradinE versus atenolol) применение ивабрадина в дозе 7,5 мг на протяжении 4 месяцев позволило снизить на 70% прием нитратов короткого действия, на 72% – частоту приступов стенокардии [12]. Исследователи отметили, что ивабрадин обладает высокой антиишемической и антиангинальной эффективностью и хорошей переносимостью; терапия ивабрадином не приводит к развитию толерантности; прекращение терапии не сопровождается развитием синдрома отмены.
Таким образом, для достижения антиишемического и антиангинального эффекта используют ивабрадин (Кораксан) в виде монотерапии при непереносимости ß-адреноблокаторов или в сочетании с последними [13]. Ивабрадин включен в Рекомендации ESC (2013), Российские рекомендации (2008) и Национальные рекомендации (2010) по диагностике и лечению стабильной стенокардии как антиангинальный препарат, являющийся альтернативой ß-блокаторам и блокаторам кальциевых каналов у пациентов с синусовым ритмом при наличии у них противопоказаний или появлении нежелательных реакций либо для совместного применения с ß-блокаторами.
Никорандил как антиишемический препарат известен несколько десятков лет, более 10 лет назад одобрен для лечения стабильной стенокардии. Обладает двойным действием: во-первых, как донатор оксида азота, оказывает коронаролитическое нитратоподобное действие; во-вторых, активируя АТФ-зависимые калиевые каналы, снижает периферическое сосудистое сопротивление, тонус коронарных резистивных артерий, конечное диастолическое давление в левом желудочке. Никорандил оказывает защитный эффект ишемического прекондиционирования, уменьшает агрегацию тромбоцитов [14]. Не вызывает развития толерантности, не влияет на АД, частоту сердечных сокращений, проводимость и сократимость миокарда. Никорандил используется как для купирования, так и для предотвращения приступов стенокардии.
Антиангинальную эффективность применения никорандила 20 мг 2 раза в сутки сравнивали с действием изосорбида мононитрата в течение 2 недель. Препараты одинаково повышали толерантность к физической нагрузке: удлиняли время до появления депрессии сегмента ST и стенокардитической боли, увеличивали общую продолжительность нагрузки. В группе никорандила на 50% снизилась частота приступов стенокардии у 20,3% пациентов [15].
В исследовании IONA (Impact of Nicorandil in Angina) сравнивали влияние никорандила в дозе 20 мг 2 раза в день и плацебо у пациентов со стабильной стенокардией на первичные конечные точки: смерть от ишемической болезни сердца, нефатальный инфаркт миокарда, внеплановая госпитализация по поводу нестабильной стенокардии [16]. В группе никорандила отметили достоверное снижение риска сердечно-сосудистой смертности и возникновения нефатального инфаркта миокарда на 21%. Снизился риск возникновения острого коронарного синдрома – на 21% и риск любых коронарных событий – на 24%.
В исследовании JCAD (Japanese Coronary Artery Disease) у пациентов с ангиографически подтвержденными стенозами крупных коронарных артерий, получавших никорандил, риск смерти от всех причин снизился на 35%, смерти от сердечно-сосудистых событий и инфаркта миокарда – на 56%, внезапной остановки сердца – на 56% [17].
Результаты проспективных контролируемых исследований показали, что действие никорандила сопоставимо с ß-адреноблокаторами, блокаторами кальциевых каналов, нитратами [18, 19]. Согласно Рекомендациям ESC 2013 г., никорандил применяют при недостаточной эффективности ß-адреноблокаторов в сочетании с ними или в виде монотерапии при непереносимости ß-адреноблокаторов и блокаторов кальциевых каналов [2].
Ранолазин в 2006 г. одобрен FDA, в 2009 г. – EMEA к применению для лечения стабильной стенокардии у пациентов, не отвечающих на стандартную терапию или с непереносимостью ß-адреноблокаторов и блокаторов кальциевых каналов [20]. Ранолазин, селективно ингибируя поздние натриевые каналы, предотвращает перегрузку внутриклеточными ионами кальция, тем самым снижает сократимость, жесткость стенки миокарда, уменьшает нарушения желудочковой реполяризации при ишемии и в результате повышает толерантность к физической нагрузке, уменьшает частоту приступов стенокардии [21].
В трех клинических плацебо-контролируемых исследованиях (МАRISA – Monotherapy Assessmеnt of Ranolazine in Stable Angina, CARISA – Combination Assessment of Ranolazine in Stable Angina, ERICA – Efficacy of Ranolazine in Chronic Angina) ранолазин в виде моно- или комбинированной терапии при добавлении к другим антиангинальным средствам по результатам тредмил-теста увеличивал время до приступа стенокардии, общее время физической нагрузки, время до появления ишемических изменений на ЭКГ, уменьшал количество приступов стенокардии и потребность в нитратах [22].
При сопоставлении с группой плацебо пациенты со стабильной стенокардией, перенесшие острый коронарный синдром, получавшие ранолазин 500–1000 мг 2 раза в день, отметили снижение частоты приступов стенокардии и повышение толерантности к физической нагрузке [23]. Исследователи отметили безопасность и эффективность ранолазина в применении у пациентов со стабильной стенокардией и сахарным диабетом с высоким уровнем HbA1c [24].
Триметазидин – единственный препарат c метаболическим механизмом действия для лечения стенокардии, разрешенный к применению в комбинации с любым классом антиангинальных средств [2]. Триметазидин оказывает антиишемическое действие, увеличивает коронарный резерв, улучшая метаболизм ишемизированного миокарда, повышая синтез аденозинтрифосфорной кислоты за счет частичного переключения метаболизма миокарда с окисления жирных кислот на менее кислородозатратный путь – окисление глюкозы [25]. Триметазидин относится к 3-КАТ-ингибиторам, механизм действия которых заключается в селективном угнетении длинноцепочечной 3-кетоацил-КоА-тиолазы – фермента, участвующего в окислении свободных жирных кислот. К дополнительным антиишемическим эффектам триметазидина, защищающим мембраны от повреждений, относят ускорение включения фосфолипидов в клеточную мембрану. Препарат принадлежит новому классу антиангинальных средств, оказывающих действие на клеточном уровне и влияющих непосредственно на кардиомиоциты.
Триметазидин улучшает эффективность образования АТФ, снижает дефицит кислорода и защищает клетки миокарда от отрицательных последствий ишемии. Под влиянием триметазидина уменьшается ишемия миокарда на ранних этапах, предотвращается появление стенокардитической боли, нарушений ритма сердца, снижения сократительной функции миокарда.
B метаанализе, проведенном Coсhrane Collaboration, изучены исследования триметазидина (Предуктала MR) в сравнении с плацебо или другими антиангинальными препаратами у пациентов со стабильной стенокардией [26]. Результаты свидетельствовали о значительном сокращении частоты еженедельных приступов стенокардии, уменьшении потребления нитратов и удлинении сроков появления депрессии сегмента ST при нагрузочных пробах у пациентов, получавших триметазидин, по сравнению с группой плацебо. Комбинация триметазидина и ß-блокатора превосходила по антиангинальному и антиишемическому эффекту сочетание пролонгированных нитратов и блокаторов кальциевых каналов.
Анализ двойных слепых плацебо-контролируемых клинических исследований с участием оригинальноего препарата Предуктала MR в лечении ишемической болезни сердца, выполненных с 1985 по 2001 г., показал, что препарат в дополнение к стандартной антиангинальной терапии достоверно снижал частоту приступов стенокардии и увеличивал толерантность к физической нагрузке. Исследователи отметили хорошую переносимость триметазидина и редкое появление нежелательных реакций [27].
Сравнительное влияние триметазидина, ß-блокаторов, блокаторов кальциевых каналов при стабильной стенокардии проведено в многоцентровом рандомизированном двойном слепом исследовании ТEMS (Trimetazidine European Multicenter Study) [28]. В течение 3 месяцев монотерапии триметазидином 60 мг в сутки отметили увеличение времени нагрузки на 33 секунды (р=0,01), времени нагрузки до появления ишемической депрессии сегмента ST на 51 секунду (р<0,001), времени нагрузки до приступа стенокардии на 67 секунд (р<0,001) и общей выполненной работы на 330 кГм (р=0,027) по сравнению с результатами пациентов, получавших пропранолол.
Установлено улучшение сократительной способности миокарда у пациентов с ишемической кардиомиопатией, лечение которых включало длительный прием триметазидина. Отмечено снижение функционального класса хронической сердечной недостаточности, улучшение контрактильности миокарда левого желудочка (прирост фракции выброса левого желудочка составил 7%; р<0,001), замедление процессов ремоделирования левого желудочка (уменьшился конечно-диастолический объем; р<0,001).
Препараты второй линии в лечении стабильной стенокардии не лишены побочных эффектов и противопоказаний к применению (таблица).
Таблица. Основные побочные эффекты, противопоказания, лекарственные взаимодействия и меры предосторожности для новых антиишемических препаратов [29]
|
Препарат
|
Побочные эффекты
|
Противопоказания
|
Лекарственное взаимодействие
|
Предосторожности
|
|
Ивабрадин
|
Фотопсии
Головная боль
Головокружение
Брадикардия
Фибрилляция предсердий
Нарушения проводимости
|
Низкая ЧСС
Аллергия
Тяжелое
поражение печени
|
Препараты,
удлиняющие интервал QT
Макролиды
Анти ВИЧ
Антигрибковые препараты
|
Возраст более 75 лет Тяжелая почечная
недостаточность
|
|
Никорандил
|
Головная боль
Головокружение
Слабость
Гипотония
Язвы ЖКТ
Тошнота
|
Кардиогенный шок
Сердечная
недостаточность
Гипотония
|
Силденафил
|
–
|
|
Ранолазин
|
Головокружение
Удлинение интервала QT
Запор
Тошнота
|
Цирроз печени
|
Препараты,
удлиняющие интервал QT
Дигоксин
Симвастатин
Циклоспорин
|
–
|
|
Триметазидин
|
Тошнота
Желудочная
диспепсия
Головная боль
Двигательные нарушения
|
Аллергия,
Болезнь Паркинсона
Тремор
Двигательные нарушения Тяжелая почечная
недостаточность
|
Не сообщалось
|
Нетяжелая почечная
недостаточность
Пожилые люди
|
Новые антиишемические препараты рекомендуют назначать при стабильной стенокардии в случае недостаточного эффекта при приеме лекарственных средств первой линии (ß-адреноблокаторы, блокаторы кальциевых каналов) либо когда отмечают выраженные побочные действия. Критериями эффективности лечения считаются устранение симптомов стенокардии или перевод из более высокого класса в низкий. С целью достижения более полного антиангинального эффекта используют комбинации антиангинальных препаратов разных классов.
Для выбора наиболее эффективного антиангинального и антиишемического лечения пациентов со стабильной стенокардией следует использовать многокомпонентную схему лекарственной терапии, включающую ß-адреноблокаторы, ингибиторы АПФ или блокаторы рецепторов ангиотензина II, дезагреганты, статины, с высокой степенью доказанности в крупных клинических исследованиях. Антиишемические препараты ивабрадин, никорандил, ранолазин, триметазидин эффективны для контроля приступов стенокардии, повышения толерантности к нагрузке в виде монотерапии или в комбинации с ß-адреноблокаторами. Индивидуальный подход к выбору лекарственных средств основывается на оценке класса тяжести стенокардии, возраста, пола, сопутствующих заболеваний, переносимости, безопасности и эффективности лечения.
Л И Т Е Р А Т У Р А
1. Go A.S., Mozaffarian D., Roger V.L. et al. // Circulation. – 2014. – Vol.129 (3). – P.e28–e292.
2. Montalescot G., Sechtem U., Achenbach S. et al. // Eur Heart J. – 2013. – Vol.34 (38). – P.2949–3003.
3. Fihn S.D., Gardin J.M., Abrams J., Berra K. et al. // Circulation. – 2012. – Vol.126 (25). – P.3097–3137.
4. Yang Q., Cogswell M.E., Flanders W.D. et al. // JAMA. – 2012. – Vol.307. – P.1273–1283.
5. Pfisterer M.E., Zellweger M.J., Gersh B.J. // Lancet. – 2010. – Vol.375(9716). – P.763–772.
6. Kotseva K. // Heart Metab. – 2011. – Vol.50. – P.32–35.
7. Parker J.D., Parker J.O. // Canad. J. Cardiol. – 2012. – Vol.28 (2). – P.S70–S80.
8. Danchin N. // Eur. Heart. J. – 2003. – Vol.5 (Suppl. G). – P.G52–G56.
9. Tardif J.C., Ford I., Tendera M. et al. // Eur. Heart. J. – 2005. – Vol.26 (23). – P.2529–2536.
10. Fox K., Ford I., Steg P.G. et al. // Lancet. – 2008. – Vol. 372. – P.817–821.
11. Tardif J.C., Ponikowski P., Kahan T. // Eur. Heart. J. – 2009. – Vol.30. – P.540–548.
12. Tardif J-C., Ford I., Bourassa M.G., Fox K. // Eur. Heart. J. – 2005. – Vol.26. – P.2529–2536.
13. Tendera M., Borer J.S., Tardif J.C. // Cardiology. – 2009. – Vol.114. – P.116–125.
14. Frydman A.M., Chapelle P., Diekmann H. et al. // Am. J. Cardiol. – 1989. – Vol.63. – P.25J–33J.
15. Zhu W.L., Shan Y.D., Guo J.X. et al. // Circ. J. – 2007. – Vol.71. – P.826–833.
16. IONA Study Group. Effect of nicorandil on coronary events in patients with stable angina: the Impact Of Nicorandil in Angina (IONA) randomised trial // Lancet. – 2002. – Vol.359. – P.1269–1275.
17. Horinaka S., Yabe A., Yagi H. et al. // Circ. J. – 2010. – Vol.74. – P.503–509.
18. Horinaka S. // Drugs. – 2011. – Vol.71 (9). – P.1105–1119.
19. Hanai Y., Mita M., Hishinuma S., Shoji M. // Yakugaku Zasshi. – 2010. – Vol.130. – P.1549–1563.
20. Stone P.Y. // JACC. – 2010. – Vol.56(12). – P.934–942.
21. Nash D.N., Nash S.D. // Lancet. – 2008. – Vol.372. – P.1335–1341.
22. Di Monaco, Sestito A. // Eur. Rev. Med. Pharmacol Sci. – 2012. – Vol.16 (12). – P.1611–1636.
23. Wilson S.R., Scirica B.M., Braunwald E. еt al. // J. Am. Coll. Cardiol. – 2009. – Vol.53 (17). – P.1510–1516.
24. Kosiborod Mеt al. // J. Am. Coll. Cardiol. – 2013. – Vol.61 (20). – P.2038–2045. ., Arnold S.V., Spertus J.A.
25. Kantor P., Lucien A., Kozak R. et al. // Circulation. Res. – 2000. – Vol.17. – P.580–588.
26. Сiapponi A., Pizarro R., Harrison J. // Cochrane Database Syst. Rev. – 2005: CD003614.
27. Marzilli M., Klein W. // Coron. Artery. Dis. – 2003. – Vol.14 (2). – P.171–179.
28. Detry J.M., Leclerca P.J. // Am. J. Cardiol. – 1995. – Vol.76. – P.8B–11B.
29. Gayet J.-L., Paganelli F., Conen-Solal A.F. Update on the medical treatment of stable angina. Arch Cardiovasc Dis 2011. – Vol.104. – P.536–554.
Медицинские новости. – 2014. – №6. – С. 11-14.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.