Mokhort T.V., Mokhort E.G.
Belarusian State Medical University, Minsk
Cognitive impairment and diabetes mellitus: prevention and treatment
Резюме. В 21 веке при прогрессивном увеличении продолжительности жизни, росте заболеваемости сахарным диабетом (СД) 2 типа, необходимости сохранения полноценного качества жизни у лиц старшей возрастной группы актуальность изучения когнитивных нарушений приобретает особую значимость. Механизмы развития когнитивных нарушений при СД во многом остаются неясными, что затрудняет поиск эффективных стратегий предупреждения деменции. Не вызывает сомнений необходимость адекватной комплексной терапии СД с учетом потенциального церебропротективного действия лекарственных средств. Рассматриваются различные профилактические и лечебные подходы, позволяющие оказывать влияние на когнитивные функции. Статистические расчеты показывают, что если какой-либо метод профилактики сможет привести к задержке наступления деменции на 2 года, то через 50 лет будет почти на 2 миллиона меньше случаев, чем прогнозировалось; если начало сможет быть отсрочено на 1 год, будет почти на 800 тысяч меньше случаев болезни, что подчеркивает актуальность профилактики и лечения когнитивных нарушений.
Ключевые слова: сахарный диабет, когнитивные нарушения, немедикаментозная коррекция, лечение.
Медицинские новости. – 2014. – №12. – С. 6–10.
Summary. In the 21st century life expectancy increases progressively, the incidence of diabetes mellitus (DM) type 2 increases. The study of cognitive impairment is particularly important for preserving the quality of life in elderly persons. Mechanisms for the development of cognitive impairment in diabetic patients remain unclear. It’s difficult to find effective strategies for the prevention of dementia. The adequate complex therapy of diabetes with potential cerebroprotective effects of medicines is necessary. The various preventive and therapeutic approaches to cognitive function influence discussed. Statistical models show that, if interventions could delay onset of the dementia by 2 years, after 50 years there would be nearly 2 million fewer cases than projected; if onset could be delayed by 1 year, there would be nearly 800 000 fewer prevalent cases. These data underline the importance of cognitive impairment prevention and treatment.
Keywords: diabetes mellitus, cognitive impairment, non-pharmacological correction, treatment.
Meditsinskie novosti. – 2014. – N12. – P. 6–10.
Поражения центральной нервной системы и, в частности, головного мозга при сахарном диабете (СД) изучены недостаточно. Распространены такие проявления поражения головного мозга, как когнитивные нарушения различной степени выраженности: от минимальной дисфункции до умеренных когнитивных нарушений, не достигающих степени деменции, с преобладанием субъективных нарушений (снижение памяти, умственной работоспособности) и, наконец, деменции.
В 21 веке при прогрессивном увеличении продолжительности жизни, росте заболеваемости СД 2 типа, необходимости сохранения полноценного качества жизни у населения старшей возрастной группы актуальность изучения когнитивных нарушений приобретает особую значимость. Эпидемиологические исследования свидетельствуют, что у лиц 60 лет и старше СД выявляется примерно в 18–20% случаев, а когнитивные нарушения имеют до 25% лиц из общей популяции включенных в исследования [1*]. Наличие СД 2 типа увеличивает риск развития когнитивных нарушений и деменции до 40%, причем их проявления манифестируют в более молодом возрасте [2].
Считается, что когнитивные нарушения при СД являются результатам взаимодействия различных патогенетических факторов: метаболических (хроническая гипергликемия и гипогликемические эпизоды с активацией оксидативного стресса, гликирование белков, дислипидемия); сосудистых (ишемия, лейкоареоз, лакунарные инфаркты, эндотелиальная дисфункция); эндокринных (гиперинсулинемия и инсулинорезистентность (ИР), гиперлептинемия, гиперкортизолемия, гиперинсулинемия и др.) и неврологических (генетическая предрасположенность, церебральная атрофия, в том числе атрофия корковых структур, отложения амилоида, нарушения гомеостаза кальция и катехоламинов в нейронах, депрессии) [3]. Наиболее распространены гипотезы, определяющие роль хронической гипергликемии, повторяющихся гипогликемических эпизодов, инсулинорезистентности, артериальной гипертензии, дислипидемии, микро- и макроангиопатий и отложения амилоида. Тем не менее механизмы развития когнитивных нарушений при СД во многом остаются неясными, что затрудняет поиск эффективных стратегий их предупреждения и лечения.
Модификация образа жизни – первая рекомендация при ведении СД 2 типа. Ее составляющие:
– поддержание нормальной массы тела (в пределах 18,5–24,9 кг/м2);
– соблюдение диеты с пониженным содержанием животных жиров, богатой овощами, фруктами, морепродуктами, нежирными молочными продуктами; витаминами группы В, омега-3 полиненасыщенными жирными кислотами;
– исключение курения, злоупотребления алкоголем;
– поддержание регулярной физической активности не менее 4–6 часов в неделю;
– повышение когнитивного резерва.
Нормализация массы тела. В последние годы появились публикации о влиянии на когнитивную функцию ожирения. Whitmer и соавт. доложили о росте первичной заболеваемости деменцией с нарастанием массы тела от нормальной до ожирения [4]. Также доказано снижение объема гиппокампа при увеличении окружности талии и определено негативное влияние именно висцерального ожирения на развитие когнитивных нарушений. Потенциальная модель взаимосвязи висцерального ожирения и когнитивных нарушений приведена на рисунке.
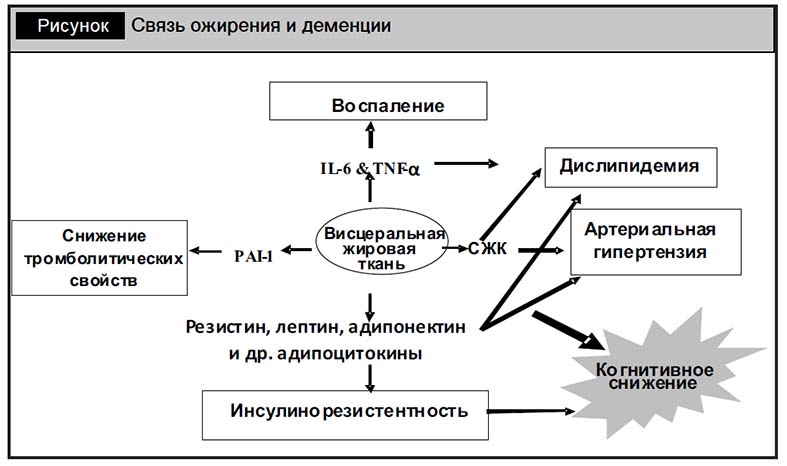
Очевидно, что профилактика когнитивного снижения должна включать поддержание нормальной массы тела.
Правильное питание включает соблюдение определенного типа питания, направленного на ограничение в рационе холестерина, животных жиров, избыточного количества углеводов, а также поваренной соли.
Считается, что средиземноморская диета, включающая овощи, орехи, фрукты и рыбу жирных сортов, оливковое масло, небольшое количество мясных продуктов и мяса, существенно снижает риск развития деменции [5].
Активное употребление с пищей полиненасыщенных жирных кислот (таких как линолевая кислота) или недостаточное употребление антиоксидантов может вызвать окислительный стресс и стать причиной предрасположенности к атеросклерозу. В ходе исследования пациентов старшей группы, проводившегося с 1990 по 1993 г. и охватившего 390 людей очень пожилого возраста, было доказано, что эти факторы повышают риск снижения умственных способностей [6].
Потребление соли более 5,8 грамма в сутки (2300 мг натрия) увеличивает риск артериальной гипертензии и инсульта – критического проявления сосудистого компонента в развитии когнитивных нарушений, что диктует необходимость ограничения потребления соли [7].
Курение и алкоголь. Курение – бесспорный фактор риска активации неиммунного воспаления и прогрессии атеросклероза, повышающих риск развития сосудистой деменции и когнитивных расстройств. Данные о связи курения и болезни Альцгеймера противоречивы. Есть исследования, указывающие на возможное снижение риска развития болезни Альцгеймера при курении в пожилом возрасте [6]. В ходе широкомасштабного исследования, известного под названием Гонолульской сердечной программы, была установлена положительная корреляция между курением в среднем возрасте и риском снижения когнитивной функции в пожилом возрасте [8]. В этой группе благотворное влияние на мыслительные процессы оказало длительное воздержание от курения. При сложностях в депривации курения могут быть рекомендованы бупропион или варениклин [9].
Когнитивные нарушения выявляются у 50–70% лиц, страдающих хроническим алкоголизмом (вне зависимости от наличия СД), в 10% случаев они носят выраженный характер, достигающий степени деменции [10]. Считается, что деменция, обусловленная алкоголизмом, составляет от 5 до 10% всех случаев деменции, особенно у лиц молодого возраста [10, 11, 12].
Физическая нагрузка. Считается, что регулярная физическая нагрузка, высокая физическая активность приводят к снижению риска когнитивных нарушений и деменции в пожилом возрасте [13]. В метаанализе, посвященном оценке влияния физической активности на когнитивную функцию и включающем результаты анализа 47 когорт наблюдения, подтверждено позитивное влияние физической активности на когнитивную сохранность [14].
Для повышения когнитивного резерва необходимо заботиться о сохранении когнитивных функций с молодых лет – тренировать память (при этом важны интенсивность умственных упражнений, их частота и регулярность), полезно играть в шахматы, разгадывать кроссворды, которые являются своеобразной «гимнастикой» для мозга, также для этой цели существуют различные интеллектуальные игры. В результате получения доказательств снижения когнитивный функций у лиц, занимающихся умственным трудом, в литературе появился термин «фитнесс для мозга». Упражнения по тренировке памяти малоэффективны на развернутых стадиях когнитивных нарушений и демеции, однако они могут использоваться у больных с начальными стадиями заболевания и задерживают развитие нарушений на 5–9 лет [15, 16]. Людям старшего возраста рекомендуется заниматься умственной деятельностью как минимум три раза в неделю. Каждый может выбрать занятие по душе: начиная от чтения или сбора пазлов, разгадывания кроссвордов, заучивания стихов и заканчивая рисованием, обучением музыке и даже получением новой специальности [17].
Общение положительно влияет на поддержание нормального уровня интеллекта в пожилом возрасте. Есть предположения, что широкий круг общения снижает у пожилых людей риск возникновения когнитивных расстройств. Существуют исследования, указывающие на более высокие когнитивные способности у пациентов с более высокой социальной активностью, однако это не может предотвратить последующее когнитивное снижение [18].
Гликемия. Механизмы поражения головного мозга при воздействии гипергликемии аналогичны доказанным при формировании других хронических диабетических осложнений, которые ведут к повреждению нейронов. Так, исследование ACCORD (Action to Control Cardiovascular Risk), включавшее субисследование по оценке памяти ACCORD-MIND (2977 пациентов с СД 2 типа), продемонстрировало наличие связи с повышенным уровнем НвА1с и снижением показателей когнитивного тестирования по четырем использованным оценочным шкалам [19].
С другой стороны, гипогликемии могут приводить к нейрогликопении и нарушениям функции мозга, нейрональному некрозу, особенно в наиболее уязвимых зонах мозга, таких как кора, гиппокамп, развитию ишемии и другим повреждениям. Наличие эпизодов тяжелой гипогликемии, потребовавших госпитализации или обращения за неотложной помощью, существенно повышает риск развития деменции [20]. Доказано, что негативное влияние гипогликемии преимущественно проявляется у пожилых пациентов, имеющих более низкий когнитивный резерв и не способных нивелировать последствия повреждения. Влияние легких эпизодов гипогликемии на риск развития деменции остается неясным [20].
Колебания уровней (вариабельность) гликемии у пациентов с плохо контролируемым диабетом приводят к ухудшению функции нейромедиаторов и когнитивным нарушениям [21].
Базисные стратегии ведения СД в состоянии компенсации без значительных колебаний гликемии и без гипогликемических эпизодов бесспорны при любых микро- и макрососудистых осложнениях и при когнитивном снижении. Важно знать, что в ряде исследований показано, что адекватное лечение СД с обеспечением целевых уровней компенсации связано с улучшением когнитивного статуса, особенно у лиц с большей длительностью СД [22, 23], а своевременная (начатая в средние годы жизни) адекватная антигипергликемическая терапия СД может снижать риск развития деменции в пожилом возрасте. Для поддержания целевого уровня НвА1с<7,0% целесообразно использование препаратов с низким потенциалом гипогликемических эпизодов (метформин, тиазолидиндионы, ингибиторы дипептидил-пептидазы-4, агонисты рецептора глюкагонподобного пептида-1, аналоги инсулина). Цели лечения СД могут быть индивидуализированы с учетом возраста пациента, ожидаемой продолжительности жизни, наличия тяжелых осложнений СД и риска гипогликемий (уровень НbА1с 6,5–8%).
Сосудистый фактор. При СД риск развития атеросклероза церебральных сосудов и риск ишемических инсультов повышается в 2–6 раз, что может быть основой для развития сосудистой деменции [24]. Артериальная гипертензия, утолщение базальных мембран капилляров, атеросклеротическое поражение более крупных артерий приводят к снижению церебрального кровотока, коррелирующему с длительностью заболевания. По данным метаанализа более 50 исследований по визуализации головного мозга, при СД отмечена большая выраженность сосудистых нарушений, гиперинтенсивности белого вещества, повышение частоты лакунарных инфарктов и церебральной атрофии [25]. Главенствующую роль в развитии когнитивных нарушений занимает артериальная гипертензия, окклюзионные атеросклеротические поражения магистральных сосудов и их сочетание, что впоследствии может приводить к острым нарушениям кровообращения (инсультам, транзиторным ишемическим атакам и т.д.).
Повышение риска инсультов при СД определяет необходимость оценки пост-инсультных когнитивных нарушений (ПКН), при которых наряду с традиционно оцениваемым очаговым неврологическим дефицитом, ограничивающим возможности физического функционирования, развиваются когнитивные расстройства. У пациентов, перенесших инсульт, уделяют внимание выраженным формам когнитивного дефицита (деменция или тяжелая афазия), хотя в клинической практике гораздо чаще встречаются более легкие формы когнитивного дефицита, развивающиеся в первые 3–12 месяцев после инсульта, раннее выявление которых может способствовать предупреждению дальнейшего нарастания когнитивного дефицита и улучшению прогноза восстановления [26].
Артериальная гипертензия. С учетом значимости сосудистого фактора в развитии когнитивных нарушений, постулатом является необходимость коррекции артериальной гипертензии и дислипидемии. Помимо влияния на развитие клинически манифестного инсульта, АГ также сопровождается риском бессимптомного поражения головного мозга, которое обнаруживается только при проведении МРТ головного мозга (очаги повышенной интенсивности в белом веществе, лакунарные инфаркты) при СД, особенно у лиц пожилого возраста [25]. Наличие МРТ-изменений в мозге сопровождается повышением риска инсульта, когнитивных нарушений и деменции, а важность АГ как предиктора сосудистой деменции было подтверждено в японском обсервационном исследовании [27].
Согласно рекомендациям ESC 2014, целевым уровнем артериального давления (АД) является показатель менее 140/90 мм рт. ст., что обусловлено доказанным повышением риска ишемических инсультов при достижении более низких значений АД [9]. Также доказательные данные против снижения систолического АД <130 мм рт. ст. были получены в различных исследованиях, например ACCORD и ONTARGET [28, 29]. Подтверждена и способность рамиприла предупреждать радиационно-индуцировааные повреждения мозга и когнитивные нарушения [30]. В то же время данные о том, как на развитие деменции влияет снижение АД, очень немногочисленны и противоречивы. Определено, что каждый год антигипертензивной терапии у гипертензивных пациентов снижает риск заболеваемости деменцией различной этиологии (болезнь Альцгеймера, сосудистая деменция) [31]. Позже в одном из разделов исследования HYVET, посвященном когнитивным функциям у больных АГ (HYVETCOG), было выявлено улучшение когнитивных функций, однако длительность динамического исследования была недостаточной [32].
Дислипидемия. Доказано, что при СД повышается риск развития атеросклероза церебральных сосудов [24]. Для достижения нормализации профиля липидов в качестве препаратов первой линии рекомендуются статины, что подкреплено крупными клиническими исследованиями [33]. Целевой уровень холестерина липопротеинов низкой плотности при СД в сочетании с другими факторами риска или поражением органов – менее 1,8 ммоль/л, или снижение на 50% от исходного уровня (неосложненный СД: целевой уровень менее 2,5 ммоль/л) [9]. Целевые уровни, утвержденные Aмериканской диабетологической ассоциацией в 2014 г., у большинства пациентов – поддержание уровня холестерина липопротеинов низкой плотности менее 2,6 ммоль/л, триглицеридов менее 1,7 ммоль/л, холестерина липопротеинов высокой плотности более 1,2 ммоль/л у женщин и более 1,0 ммоль/л у мужчин [34].
Однако у большой группы пациентов с СД 2 типа и метаболическим синдромом высокие уровни триглицеридов (ТГ), что является показанием для назначения фибратов. Так, лечение фенофибратом в плацебо-контролируемом исследовании FIELD (5 лет, 9795 пациентов с СД 2 типа) привело к снижению уровня ТГ на 20–50% от исходного уровня, повышению уровня холестерина липопротеинов высокой плотности на 10–20%, снижению риска развития и прогрессии микрососудистых осложнений (ретинопатии, ампутаций, нефропатии) [35].
У пациентов без исходного когнитивного снижения, по данным единичных краткосрочных исследований, возможно негативное влияние статинов на когнитивную функцию, однако многие долгосрочные исследования указывают на позитивный эффект статинов в предотвращении деменции [36]. Влияние терапии статинами на развитие деменции – горячая тема дискуссий последнего десятилетия. В различных экспериментальных исследованиях продемонстировано наличие связи гиперхолестеринемии на отложение амилоида в тканях мозга и позитивное влияние статинов на показатели памяти и уровни амилоидного бета-протеина [37]. В итоге в Кокрановском обзоре 2013 г., включающем результаты трех исследований по 748 пациентам с болезнью Альцгеймера, получавших ингибиторы холинэстеразы, сделано заключение о пользе статинов [38]. Аналогичные результаты по снижению скорости когнитивного снижения, вызванного различными причинами, при использовании статинов получены в рандомизированном клиническом исследовании Ginkgo Evaluation of Memory Study (GEMS), при этом определены позитивные изменения МРТ -статуса [39]. Однако данные последнего Кокрановского метаанализа не позволяют сделать заключение о протективном влиянии статинов на развитие когнитивного снижения различной этиологии [40]. Вклад в споры о потенциально негативном влиянии статинов на когнитивные функции внесла FDA, которая на основании публикаций ограниченных исследований сделала соответствующее предупреждение. Однако, чтобы сделать окончательные выводы, необходимо проведение рандомизированных клинических исследований в когортах лиц с верифицированной сосудистой деменцией и различной коморбидной патологией [41]. В доступной нам литературе не удалось найти результатов рандомизированных клинических исследований, подтверждающих влияние статинов (ни позитивное, ни негативное) на развитие сосудистой деменции при СД. Очевидно, общая польза от использования статинов, обусловливающая снижение сердечно-сосудистых рисков, включая инсульты и ПНК, не позволяет исключить их из необходимых при СД 2 типа лекарственных средств.
Установлено, что агонисты рецептора пролифератора пероксисом-? (PPAR-?) – фибраты в экспериментальных исследованиях на животных обеспечивают нейропротективные эффекты [42]. Это обусловлено прямым влиянием фенофибрата на нейрогенез в области гиппокампа и замедление активации микроглии.
Доказано улучшение координации, когнитивных функций у животных при использовании фенофибрата, отмечена минимизация проявлений воспаления, что позволяет продолжить исследования, направленные на оценку и получение клинических доказательств роли активации PPAR-? в нейропротекции и влиянии на когнитивные функции.
Включение в рацион жирной рыбы, содержащей большое количество омега-3 полиненасыщенных жирных кислот, не менее 5 раз в неделю способствует снижению риска инсульта, нефатального инфаркта миокарда и смертности от ИБС. Имеются данные о возможном благоприятном эффекте омега-3 полиненасыщенных жирных кислот на сохранение эффективной деятельности мозга [43], однако при назначении низких доз омега-3 полиненасыщенных жирных кислот в течение 6 месяцев не получено доказательств улучшения познания или профилактики когнитивного снижения у пожилых людей [44].
Изучалось антиоксидантное действие витаминов Е и С для профилактики болезни Альцгеймера, однако достоверных доказательств их эффективности не получено [45]. Результаты недавних исследований по данной теме противоречивы, хотя многие исследователи связывают достаточное потребление антиоксидантов с пищей с улучшением когнитивных функций и со снижением риска деменции [46].
Опубликованы научные работы, свидетельствующие о замедлении прогрессирования когнитивных нарушений на фоне приема фолиевой кислоты [47].
Как указывалось выше, получены доказательства наличия микроваскулярной патологии при развитии деменции: по данным магнитно-резонансной томографии выявляются характерные изменения (лейкоареоз, лакунарные инфаркты, микрогеморрагии, церебральная атрофия, в том числе атрофия корковых структур и т.д.), утолщение базальных мембран капилляров, что приводит к снижению церебрального кровотока. Учитывая многофакторный характер нарушений, определяющий возникновение и развитие когнитивного дефицита при СД, в лечении обоснованно использование таких средств, которые имеют наибольшее количество точек приложения.
Одним из таких препаратов является Актовегин, который представляет собой высокоочищенный гемодиализат, получаемый методом ультрафильтрации из крови телят, он обладает мощным антиоксидантным и антигипоксантным действием. Проведено большое число клинических исследований по оценке эффективности Актовегина при сосудистой деменции, постинсультных нарушениях, болезни Альцгеймера. В целом, по результатам исследований, можно отметить положительный эффект терапии в отношении когнитивных функций, прежде всего в сферах памяти, внимания, обработки информации при запоминании и психической активности [48–50]. Актовегин оказывает положительное влияние на когнитивные функции при СД с умеренными когнитивными нарушениями, улучшая психическую активность, интеллектуальную гибкость, устойчивость запоминания, регуляцию произвольной деятельности, что обеспечивает улучшение общей активности и социальной адаптации пациентов.
Эффективность Актовегина обусловлена антигипоксантным эффектом, который заключается в способности препарата улучшать перенос глюкозы внутрь клетки путем активации ее транспортеров посредством действия инозитолфосфоолигосахаридов, содержащихся в препарате, а не через инсулиновые рецепторы. Следует отметить, что наибольшая динамика показателей тестов отмечена в группе пациентов с осложненным СД, т.е. при наличии сосудистого фактора – ишемии и активизации оксидативного стресса. Это обусловлено тем, что Актовегин обеспечивает улучшение микроциркуляции, обусловленное увеличением кислородного метаболизма сосудистой стенки, нормализацией эндотелийзависимых реакций и снижением периферического сосудистого сопротивления, минимизирует проявления оксидативного стресса, мобилизует поступление кислорода в клетки головного мозга и церебральных сосудов, улучшает реологические свойства крови. Нейропротективные свойства Актовегина (поддержание жизнеспособности нейронов, уменьшение апоптоза, увеличение общего числа синаптических связей и снижение выраженности окислительного стресса) [51, 52] обосновывают его применение при ПКН. Завершается крупное рандомизированное двойное слепое плацебо-контролируемое исследование терапевтической эффективности Актовегина – ARTEMIDA (A Randomized Trial of Efficacy, 12 Months International Double-blind Actovegin) [53].
Альтернативный вариант – использование пентоксифиллина, которое вызывает достоверное увеличение общего церебрального кровотока и регионарного кровотока в зоне ишемии головного мозга на 20%. В последнее десятилетия были выявлены новые свойства препарата, расширяющие возможности его клинического применения при различных формах хронической ишемии мозга, которые в рутинной клинической практике зачастую объединяют термином «дисциркуляторная энцефалопатия». В обзоре 10 рандомизированных клинических исследований по оценке эффективности пентоксифиллина отмечено снижение скорости прогрессирования когнитивного дефицита, а также достоверное уменьшение риска развития повторных ишемических поражений головного мозга [54]. В систематизированном обзоре 20 сопоставимых по дизайну рандомизированных плацебо-контролируемых двойных слепых исследований по оценке эффективности препарата в лечении больных с cосудистой деменцией доказано положительное влияние пентоксифиллина на когнитивные функции [55]. Также подтверждена целесообразность использования петоксифиллина при необходимости влияния на когнитивный дефицит: отмечено замедление прогрессирования когнитивных нарушений, улучшение памяти, внимания, особенно у лиц пожилого возраста [56].
Доказанная способность пентоксифиллина к ингибированию периферических мононуклеаров, нейтрофилов и Т-лимфоцитов, угнетению синтеза провоспалительных цитокинов может обеспечивать дополнительные протективные эффекты при развитии ишемии мозга и когнитивных снижениях, что требует дополнительных доказательств в клинической практике.
В качестве сравнительно нового нейропротектора можно назвать цитиколин. Цитиколин (цитидин-5-дифосфохолин) является нуклеотидом, незаменимым предшественником фосфатидилхолина (лецитина) – основного структурного компонента клеточных мембран, включая нейрональные, поэтому используется как нейропротектор, применяющийся для лечения заболеваний, сопровождающихся повреждением нейронов ишемического, травматического или дегенеративного характера. Препарат способен нормализовать холинергическую передачу, работу других нейротрансмиттерных систем в мозге, снижать концентрацию нейротоксичного глутамата и воздействовать на депозиты бета-амилоида [57]. Эффективность цитиколина при деменции, развившейся после инсульта, подтверждена в Кокрановском обзоре 14 исследований (от 20 дней до 12 мес.) с участием пожилых лиц [58]. На фоне приема цитиколина отмечено значительное улучшение когнитивных функций в целом по сравнению с группой плацебо, особенно отчетливое на поведенческом уровне и в улучшении памяти, что легко оценить клинически, даже без специальных методик. В открытом многоцентровом исследовании IDEALE на когорте 349 пациентов с сосудистой деменцией (Mini-Mental State Examination score ? 21) было показано, что цитиколин эффективно уменьшает выраженность когнитивных нарушений и хорошо переносится, что позволяет авторам сделать вывод о целесообразности использования цитиколина при когнитивных нарушениях сосудистого генеза [59].
Потенциальными агентами для коррекции деменции и болезни Альцгеймера являются препараты гинкго билоба – мощные антиоксиданты. Так, опубликованы данные, подтверждающие улучшение когнитивных функций на фоне приема стандартизированного экстракта гинкго билоба-761 в лечении деменции [60]. Однако в многоцентровом плацебо-контролируемом исследовании, проведенном во Франции, показано, что долгосрочное использование стандартизированного экстракта гинкго билоба не снижает риск прогрессирования болезни Альцгеймера по сравнению с плацебо [61].
Общепринятых доказательных рекомендаций по профилактике и лечению когнитивного дефицита при СД пока не существует, хотя исследования в этом направлении проводятся. Многофакторность патогенеза деменции при СД позволяет предположить эффективность различных терапевтических подходов. В качестве потенциальных лекарственных препаратов, способных минимизировать сосудистый компонент в развитии деменции, изучаются антиоксиданты, производные пирролидона (рацетамы), винпоцетин, ницерголин, инстенон, препараты гинкго билоба и др.
Отдельное направление – лечение болезни Альцгеймера, в котором используются различные ингибиторы холинэстеразы, NMDA-антагонист мемантин и активно разрабатываются новые препараты.
В заключение отметим, что даже у относительно стабильных пациентов, но не получающих адекватной антигипергликемической и антигипертензивной терапии, наблюдаются множественные «немые» лакунарные инсульты и характерные изменения в белом веществе головного мозга, которые становятся морфологической основой для формирования когнитивного снижения. Данный факт определяет необходимость адекватной комплексной терапии СД с учетом потенциального церебропротективного действия лекарственных средств. Статистические расчеты показывают, что, если какой-либо метод профилактики сможет привести к задержке наступления деменции на 2 года, то через 50 лет будет почти на 2 миллиона меньше случаев, чем прогнозировалось; если начало сможет быть отсрочено на 1 год, будет почти на 800 000 меньше случаев болезни, что подчеркивает актуальность профилактики и лечения когнитивных нарушений [62].
Л И Т Е Р А Т У Р А
1. Strachan M.W.J., Reynolds R.M., Frier B.M. // British Medical Bulletin British Medical Bulletin. – 2008. – V.88. – P.131–146.
2. Mijnhout G.S. Scheltens P., Diamant M. et al. // Diabetologia. – 2006. – V.49. – P.1447–1448.
3. Мохорт Е.Г., Холодова Е.А., Мохорт Т.В. // Здравоохранение. 2014. – №7. – с.23–29
4. Whitmer R.A. // Curr. Alzheimer Res. – 2007. – V.4 (2). – P.117–122
5. Solfrizzi V., Panza F. // J. Alzheimers Dis. – 2014. – V.39 (2). – P.283–286.
6. Вэлли Л. Дж. // Лечащий врач. – 1999. – №1.
7. Lindsay P., Bayley M., Hellings C. et al. // CMAJ. – 2008. – P.179, E1–E93.
8. Galanis D. J., Petrovitch H., Launer L.J. et al. // Amer. J. Epidemiol. – 1997. – V.145 (6). – P.507–515.
9. Рекомендации по диабету, предиабету и сердечно-сосудистым заболеваниям. EASD/ESC // Рос. кардиол. журн. – 2014. – №3 (107).
10. Дамулин И.В., Шмидт Т.Е. // Неврол. журн. – 2004. – Т.9, №2. – С.4–10.
11. Sampson E.L., Warren J.D., Rossor M.N. // Med. J. 2004. – V.80. – P.125–139.
12. Renner J.A, Morris J.C. Alcohol-associated dementia. In: Handbook of Dementing Illnesses. Ed. by J.C.Morris. – New York etc.: Marcel Dekker, Inc., 1994. P.393–412
13. Behrman S., Ebmeier K. // The Practitioner. – 2014. –V.258 (1767). – P.2–21.
14. Blondell S.J., Hammersley-Mather R., Veerman J.L. // BMC Public Health. – 2014. – V.14. – P.510.
15. Wolf S.A., Kronenberg G., Lehmann K. et. al. // Biol. Psychiatry. – 2006. – V.60 (12). – P.1314–23.
16. Ball K., Berch D.B., Helmers K.F. et al. // JAMA. – 2002. – V.288 (18). – P.2271–2281.
17. Baumeister R.F, Twenge J.M., Nuss C.K.J. // Pers. Soc. Psychol. – 2002. – V.83 (4). – P.817–827.
18. Stoykova R., Matharan F., Dartigues J.F., Amieva H. // Int. Psychogeriatr. – 2011. – V.23 (9). – P.1405–1412.
19. Cukierman-Yaffe T., Gerstein H.C., Williamson J.D. et al. // Diabetes Care. – 2009. –V.32 (2). – P.221–226.
20. Whitmer R. A., Karter A. J., Yaffe K. et al. // JAMA. – 2009. – V.301(15). – P.1565–1572.
21. Munshi M., Grande L., Hayes M., et al. // Diabetes Care. – 2006. – V.29. – P.1794–1799.
22. Jacobson A.M., Musen G., Ryan C.M. et al. // N. Engl. J. Med. – 2007. – V.356. – P.1842–1852.
23. Ryan C.M., Freed M.I., Rood J.A. et al. // Diabetes Care. – 2006. – V.29. – P.345–351.
24. Arvanitakis Z. et al. // Neurology. – 2006. – V.67. – P.1960–1965.
25. Van Harten B., de Leeuw F., Weinstein H.C. et al. // Diabetes Care. – 2006. – V.29. – P.2539–2548
26. Snaphaan L, De Leeuv E. // Stroke. – 2007. – V.38. – P.192–203.
27. Ninomiya T., Ohara T., Hirakawa Y. et al. // Hypertension. – 2011. – V.58. – P.22–28.
28. The ACCORD study Group. Effects of intensive blood-pressure control in type 2 diabetes mellitus // N. Engl. J. Med. – 2010. – V.362. – P.1575–1585.
29. Redon J., Mancia G., Sleight P. et al. // J. Am. Coll. Cardiol. – 2012. – V.59. – P.74–83.
30. Lee T.C., Greene-Schloesser D., Payne V. et al. // Radiat Res. – 2012. –V.178(1). – P.46–56.
31. Peila R., White L.R., Masaki K. et al. // Stroke. – 2006. – V.37. – P.1165–1170.
32. Peters R., Beckett N., Forette F. et al. // Lancet Neurology. – 2008. – V.7. – P.683–689.
33. Baigent C., Keech A., Kearney P.M. et al. // Lancet. – 2005. – V.366 (9493). – P.1267–1278.
34. American Diabetes Association. Standards of medical care in diabetes-2014 // Diabetes Care. – 2014. – V.37(suppl 1). – P.S14–S80.
35. Keech A., Simes R.J., Barter P. et al. // Lancet. – 2005. – V.366 (9500). – P.1849–1861.
36. Swiger K.J., Manalac R.J., Blumenthal R.S. et al. // Mayo Clin. Proc. – 2013. – V.88 (11). – P.1213–21.
37. Li L., Cao D., Kim H. et al. // Ann Neurol. – 2006. –V.60. – P.729–739.
38. McGuinness B., O’Hare J., Craig D. et al. // Int. J. Geriatr. Psychiatry. – 2013. – V.28 (2). – P119–126.
39. Kerstin Bettermann, Alice M. Arnold, Gregory L. Burke // J. Stroke Cerebrovasc. Dis. – 2012. – V.21(8). – P.438–444.
40. McGuinness B., Craig D., Bullock R. et al. // Cochrane Database Syst. Rev. – 2014. – Jul 8. – P.7.
41. Giannopoulos S., Katsanos A.H., Kosmidou M., Tsivgoulis G. // J. Alzheimers Dis. – 2014/ – Mar 24.
42. Bhateja D.K., Dhull D.K. et al. // Eur. J. Pharmacol. – 2011. – V.674, Is.1. – P.33–43.
43. Cederholm T., Salem N. Jr., Palmblad J. // Adv. Nutr. – 2013. – V.6. – 4(6). – P.672–676.
44. Mahmoudi M.J., Hedayat M., Sharifi F. et al. // J. Diabetes Metab. Disord. – 2014. – V.13(1). – P.34.
45. Boothby L.A., Doering P.L. // Ann. Pharmacother. – 2005. –V.39. – P.2073–2080.
46. Crichton G.E, Bryan J., Murphy K. // J. Plant Foods Hum. Nutr. – 2013. – 68(3). – P.279–92.
47. Durga J., van Boxtel M.P., Schouten E.G. et al. // Lancet. – 2007. – V.369. – P.208–216.
48. Чугунов П.А., Семенова И.В. // Сахарный диабет. – 2008. – №1 (38). – С. 61–68.
49. Шмырев В.И., Остроумова О.Д., Боброва Т.А. // Рус. мед. журн. – 2003. – №4. – С.216–220.
50. Derev’yannykh E.A., Bel’skaya G.N., Knoll E.A. et al. // Neurosci. Behav. Physiol. – 2008. – V.38. – P.873–875.
51. Machicao F., Muresanu D.F., Hundsberger H. et al. // J. Neurol. Sci. – 2012. – V.322. – P.222–227.
52. Elmlinger M.W., Kriebel M., Ziegler D. // Neuromolecular Med. – 2011. – V.13. – P.266–274.
53. Guekht A., Skoog I., Korczyn A.D. et al. // Dement. Geriatr. Cogn. Disord. Extra. – 2013. –V.3. – P.459–467.
54. Frampton J.E., Brogden R.N. // Drugs Aging. – 1995. – V.7(6). – P.480–503.
55. Sha M.C., Callahan C.M. // Alzheimer. Dis. Assoc. Disord. – 2003. – V.17(1). – P.46–54.
56. Parnetti L., Ciuffetti G., Mercuri M et al. // Pharmatherapeutica. – 1986. – V.4(10). – P.617–627.
57. Hurtado O., Cárdenas A., Pradillo J.M. et al. // Neurobiol. Dis. – 2007. – V.26. – P.105–111.
58. Fioravanti M., Yanagi M. // Cochrane Database Syst Rev. –. – Apr 18. – (2):CD000269. 2005
59. Cotroneo A.M., Castagna A., Putignano S. et al. // Clin. Interv. Aging. – 2013. – V.8. – P.131–137.
60. Kasper S., Schubert H. // Fortschr. Neurol. Psychiatr. – 2009. – V.77(9). – P.494–506.
61. Vellas B., Coley N., Ousset P.J. et al. // Lancet Neurol. – 2012. – V.11(10). – P.851–859.
62. Brookmeyer R., Gray S., Kawas C. // Am. J. Public. Health. – 1998. – V.88. – P.1337–1342.
Медицинские новости. – 2014. – №12. – С. 6–10.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.