Zhernosek V.F.
Belarusian Medical Academy of Post-Graduate Education, Minsk
The actual practice of the basic treatment of severe asthma in children
and the prospects for improving its effectiveness
Резюме. Представлен анализ базисной терапии и уровня контроля у 103 детей 3–18 лет жизни с тяжелой персистирующей бронхиальной астмой. Несмотря на комбинированную терапию контролирующими препаратами, у 29,1% из них контроля болезни достичь не удается. С целью оптимизации терапии пациентов с тяжелой частично контролируемой и неконтролируемой астмой на стандартной базисной терапии необходимо внедрение современных лекарственных средств, в том числе ингаляционных глюкокортикостероидов (ИКС), отличающихся большей клинической эффективностью и безопасностью. Как вариант терапии рассматривается лечение циклесонидом.
Ключевые слова: дети, тяжелая бронхиальная астма, базисная терапия, степени контроля, циклесонид.
Медицинские новости. – 2014. – №12. – С. 29–32.
Summary. The analysis of the basic treatment and the level of control in 103 children 3–18 years of life with severe persistent asthma. It was shown that 29.1% of children, despite the combination therapy controlling drugs, disease control can not be achieved. In order to optimize the treatment of patients with severe partly controlled and uncontrolled asthma at baseline standard therapy requires the introduction of modern medicines, including inhalation glucocorticosteroids (ICS), with a higher level of clinical efficacy and safety. Treatment option may be considered the treatment of ciclesonide.
Keywords: children, severe bronchial asthma, basic therapy, the level of control, ciclesonide.
Meditsinskie novosti. – 2014. – N12. – P. 29–32.
Бронхиальная астма (БА) – хроническое воспалительное заболевание, ассоциированное с вариабельной обструкцией дыхательных путей и бронхиальной гиперреактивностью, проявляется повторяющимися эпизодами свистящего дыхания, кашля, одышки и чувством сдавления в груди [1].
Длительная поддерживающая (базисная) терапия пациентов с БА строится по ступенчатому принципу в зависимости от степени контроля заболевания [2, 3]:
– 0 ступень (полностью или хорошо контролируемая астма): базисная терапия не проводится.
– I ступень (начальная терапия большинства случаев частично контролируемой и неконтролируемой астмы): 1) ингаляционный глюкокортикостероид (ИКС) в низкой дозе (предпочтительный вариант в большинстве случаев); 2) антилейкотриеновый препарат (альтернативный вариант).
– II ступень терапии (частично контролируемая и неконтролируемая астма в отсутствие контроля болезни на терапии первой ступени в течение 1 месяца): 1) ИКС в средней дозе; 2) ИКС в низкой дозе в комбинации с ингаляционным ß2-агонистом длительного действия или антилейкотриеновым препаратом; 3) допустимо в порядке исключения назначение низких доз ИКС в комбинации с теофиллином длительного действия.
– III-IV ступень (частично контролируемая и неконтролируемая астма в отсутствие контроля болезни на терапии второй ступени в течение 1 месяца): 1) ИКС в высокой дозе; 2) ИКС в средних или высоких дозах в комбинации с ингаляционным ß2-агонистом длительного действия или антилейкотриеновым препаратом; 3) допустимо в порядке исключения назначение ИКС в средних или высоких дозах в комбинации с теофиллином; 4) при IgE -опосредованной астме, которая не контролируется медикаментами, – омализумаб.
– V ступень (контроля невозможно достичь при применении максимальной дозы ингаляционных кортикостероидов и дополнительных препаратов): 1) пероральные кортикостероиды коротким курсом; 2) при IgE -опосредованной астме, которая не контролируется медикаментами, – омализумаб.
Цель лечения БА – достижение полностью контролируемого и контролируемого течения болезни. Наиболее сложной остается задача контроля тяжелой персистирующей астмы [4].
Внедрение новых технологий позволит более успешно добиваться основной цели лечения БА – достижение и поддержание контроля болезни [5] .
В настоящем исследовании представлены анализ реальной практики базисной терапии и перспективные технологии в достижении контроля тяжелой БА у детей.
Выполнен анализ базисной терапии у 103 детей с БА тяжелого персистирующего течения, состоящих на диспансерном наблюдении в детских поликлиниках Республики Беларусь.
Степень тяжести астмы и уровень контроля болезни на момент сбора информации уточняли в соответствии с «Клиническими протоколами диагностики и лечения аллергических заболеваний у детей» (Приказ Министерства здравоохранения Республики Беларусь №829 от 08.08.2014), в основу которого положена классификация БА, утвержденная Международным консенсусом по детской астме [1]. Согласно указанным документам, выделяли полностью контролируемую, контролируемую, частично контролируемую и неконтролируемую БА (табл. 1)
Таблица 1. Уровень контроля астмы [1]
|
Параметр
|
Уровень контроля астмы
|
|
полностью контролируемая
|
хорошо контролируемая
|
частично контролируемая
|
неконтролируемая
|
|
Дневные симптомы
|
Нет
|
Меньше или равно 2 в неделю
|
>2 в неделю
|
Постоянные
|
|
Ночные симптомы/пробуждения от астмы
|
Нет
|
Меньше или равно 1 раза в месяц
|
>1 раза в месяц
|
Еженедельные
|
|
Потребность в средствах неотложной помощи
|
Нет
|
Меньше или равно 2 в неделю
|
>2 в неделю
|
Ежедневно
|
|
Ограничение активности
|
Нет
|
Нет
|
Некоторое
|
Выраженное
|
|
Функция легких – FEV1/PEF (по отношению к должным или персональным лучшим)
|
>80%
|
Больше или равно 80%
|
60–80%
|
<60%
|
|
Число обострений за год
|
0
|
1
|
2
|
>2
|
Таблица 2. Реальная практика базисной терапии пациентов с тяжелой БА
|
Вариант базисной терапии
|
Число пациентов
|
|
абс.
|
%
|
|
Монотерапия ИКС
|
22
|
21,4±4,0
|
|
ИКС в сочетании с ингаляционными ß2-агонистами
|
45
|
43,6±4,9
|
|
ИКС в сочетании с антилейкотриеновыми препаратами
|
5
|
4,9±2,1
|
|
ИКС в сочетании с ингаляционными ß2-агонистами и антилейкотриеновыми препаратами
|
22
|
21,4±4,0
|
|
ИКС в сочетании с ингаляционными ß2-агонистами, антилейкотриеновыми препаратами и пролонгированными теофиллинами
|
4
|
3,9±1,9
|
|
ИКС в сочетании с ингаляционными ß2-агонистами, антилейкотриеновыми препаратами, пролонгированными теофиллинами и системными стероидами
|
2
|
1,9±1,4
|
|
Комбинированная терапия в сочетании с анти-IgЕ-антителами
|
3
|
2,9±1,7
|
Пациенты были сгруппированы по возрасту, объему базисной терапии и уровню контроля БА.
Возраст пациентов. В возрастной структуре пациентов с тяжелой БА превалировали дети 6–15 лет (55,3%), каждый третий пациент с тяжелой астмой был подростком 15–18 лет (33%), дети в возрасте 3–6 лет составили 11,7%. Детей младшего возраста (первых трех лет жизни) в числе детей с тяжелой астмой не было.
Базисная терапия. Соотношение монотерапии ИКС и комбинированной терапии у пациентов с тяжелой БА в реальной клинической практике: монотерапии ИКС –21,4%, комбинированная терапия –78,6%.
Основой базисной терапии были ИКС (флютиказон, будесонид, беклометазон) и комбинированные препараты в виде фиксированной комбинации ИКС с ингаляционным ß2-агонистом (флютиказон/сальметерол, будесонид/формотерол). Монотерапия ИКС проводилась у каждого пятого пациента, у всех остальных – комбинированная. Основу комбинированной терапии составляла фиксированная комбинация ИКС с ингаляционным ß2-агонистом (76 (93,8±2,7%) из 81 пациентов, получавших комбинированную терапию). Редко комбинированная терапия была представлена сочетанием ИКС и антилейкотриенового препарата (только каждый двадцатый пациент). Каждом третьему пациенту (34,6±5,3%), находящемуся на комбинированной терапии, для достижения контроля болезни к фиксированной комбинации ИКС с ингаляционным ß2-агонистом дополнительно назначали еще один или два медикамента. Единичным детям, находящимся на комбинированной терапии, для достижения контроля астмы предлагали короткий курс системных стероидов. У трех пациентов для достижения контроля применяли терапию анти-IgЕ-антителами (омализумаб) (табл. 2). Комбинированная терапия с применением двух-трех препаратов, лечение омализумабом сопряжены с большими расходами на медикаментозное обеспечение этой категории пациентов.
Уровень контроля БА. Более чем у 2/3 (70,9±4,5%) пациентов удалось достичь цели терапии – полностью контролируемое и контролируемое течение БА. Однако у 30 из 103 (29,1±4,5%) астма все же осталась частично контролируемой и неконтролируемой (рисунок). Отсутствие контроля астмы влечет дополнительные материальные расходы, связанные с госпитализацией пациентов, вызовами бригад скорой помощи по поводу приступов астмы, затратами на оплату листков нетрудоспособности по уходу за больным ребенком и прочие косвенные расходы.
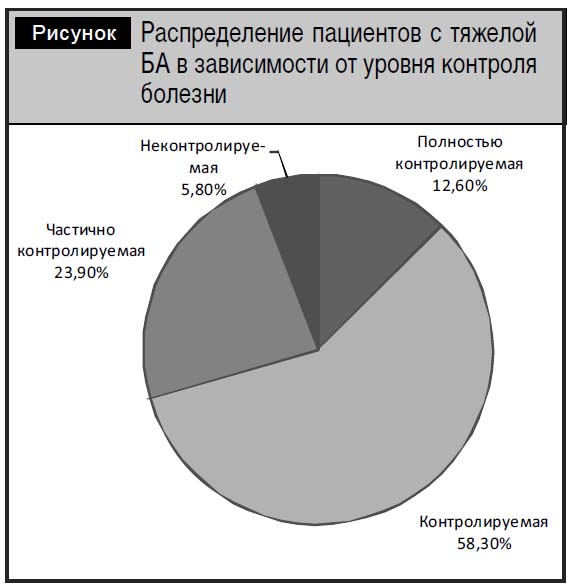
В связи с этим заслуживает внимания внедрение технологий, позволяющих улучшить контроль БА. Перспективно в этом плане внедрение в клиническую практику ИКС с высоким уровнем легочной депозиции. Таким свойством обладает циклесонид. В Республике Беларусь циклесонид зарегистрирован под названием Альвеско®.
Циклесонид (Альвеско®) – ингаляционный кортикостероид новой генерации, является пролекарством и активируется непосредственно в эпителиальных клетках легких в фармакологически активный метаболит дезциклесонид, обладающий высоким сродством к глюкокортикоидным рецепторам и способностью образовывать неактивные эфиры с жирными кислотами, служащими в качестве депо циклесонида. Фармакологические особенности молекулы циклесонида обеспечивают высокую локальную противовоспалительную активность препарата с минимальным риском системных эффектов и возможностью применения один раз в день, что способствует повышению приверженности терапии со стороны пациентов.
Циклесонид (Альвеско®), выпускаемый в виде дозированного аэрозольного ингалятора, генерирует самую большую фракцию мелкодисперсных частиц, что обеспечивает большую легочную депозицию (52% отпущенной дозы) и равномерное распределение препарата в дыхательных путях с некоторой преимущественной депозицией в дистальных бронхах. Благодаря малому размеру частиц (<1,1 микрона) циклесонид достигает мелких дыхательных путей (<2 мм в диаметре). А в силу низких депозиции и активации циклесонида в области рта и глотки частота возникновения нежелательных эффектов со стороны ротоглотки у пациентов, получающих циклесонид, минимальна, что делает его препаратом выбора у пациентов, имеющих высокий риск развития локальных побочных реакций на ИКС и уже отмечавших такие нежелательные явления ранее при применении ИКС. Все это делает Альвеско® препаратом выбора в терапии БА, особенно у детей и пациентов с высоким риском развития нежелательных явлений на фоне терапии другими ИКС [6, 7].
Свойства циклесонида позволяют рекомендовать его всем пациентам с БА, но особенно перспективно использование Альвеско® у больных, плохо отвечающих на терапию ИКС, при тяжелом течении заболевания и частых симптомах в ночные часы [8].
Высокая противовоспалительная активность, минимальное число системных и местных побочных эффектов, однократный прием в сутки делают использование данного препарата предпочтительным в педиатрической практике [9].
В международных исследованиях доказано, что циклесонид обладает высокой клинической эффективностью и минимальными системными и местными побочными эффектами при лечении детей с БА различной степени тяжести. В рандомизированном многоцентровом двойном слепом плацебоконтролируемом исследовании с участием 1018 детей с персистирующей БА в возрасте 4–11 лет оценивали эффективность и безопасность препарата в дозах 40, 80 и 160 мкг один раз в сутки. Применение циклесонида в дозах 80 и 160 мкг в течение 12 недель способствовало статистически достоверному улучшению функции легких – объема форсированного выдоха за первую секунду, показателей утренней и вечерней пиковой скорости выдоха. Также зафиксировано снижение общего балла симптомов астмы, потребности в препаратах скорой помощи и улучшение качества жизни пациентов по сравнению с плацебо. Циклесонид в дозе 40 мкг продемонстрировал статистически достоверную эффективность в отношении утренней пиковой скорости выдоха, симптомов астмы и качества жизни пациентов. Все три режима терапии показали хорошую переносимость и высокую безопасность, что подтверждалось отсутствием подавления функции гипоталамо-гипофизарно-надпочечниковой системы и изменения содержания кортизола в суточной моче (по сравнению с плацебо) [10].
Приводим собственное клиническое наблюдение за пациентом с трудностями в контроле астмы, который с успехом лечился препаратом Альвеско®.
Клиническое наблюдение
Мальчик В., 13 лет. Госпитализирован в пульмонологическое отделение УЗ «Минская областная детская клиническая больница» с жалобами на приступы удушающего кашля 4–5 раз в неделю (из них 1–2 раза в ночное время) и затрудненное дыхание через нос. Приступы облегчались после ингаляции беродуала.
Страдает БА в течение 7 лет. Гипоаллергенный быт дома не поддерживается. Последние 6 месяцев получал базисную терапию серетидом 50/500 по одной дозе два раза в день, к которому на 3 месяца присоединяли сингуляр по 10 мг один раз в сутки. Дополнительно проводили курс лечения системными стероидами в течение 14 дней. Контроля течения болезни достичь не удавалось. По поводу аллергического ринита назначалось повторное лечение фликсоназе по 2 дозы один раз в день по 4–6 недель.
Родился доношенным от первой физиологической беременности и родов в сроке гестации 39 недель с массой тела при рождении 3550. В период новорожденности перенес врожденную пневмонию. В течение 7 суток находился на ИВЛ. Болел ветряной оспой. Генеалогический анамнез по атопии не отягощен. Аллергологический анамнез: пищевая (цитрусовые) и медикаментозная гиперчувствительность (цефазолин, новокаин, сальбутамол) в виде крапивницы.
При госпитализации ребенок повышенного питания, наблюдалось затрудненное носовое дыхание, в легких с обеих сторон в нижних отделах выслушивались крепитирующие хрипы.
Проведено комплексное обследование. Общеклинические анализы крови и мочи без особенностей. В иммунограмме повышен уровень IgE до 1953 МЕ/мл. При проведении аллергологического тестирования методом скарификационных кожных проб выявлена сенсибилизация к кукурузе, луговым и сорным травам. В риноцитограмме эозинофилы 72% от клеточного состава. Исследование функции внешнего дыхания: нарушения по смешанному типу, ОФВ1 59% должного. Выполнены фармакологические пробы на обратимость бронхиальной обструкции: проба с беротеком отрицательная, проба с атровентом отрицательная, проба с беродуалом отрицательная, проба с формотеролом положительная. На рентгенограмме органов грудной клетки определен неравномерно усиленный легочный рисунок, преимущественно в базальных отделах с обеих сторон, с контурированием стенок бронхов, нечеткий. Компьютерная томография органов грудной клетки: легочной рисунок умеренно деформирован, несколько обеднен в среднем этаже легочных полей, отмечается невыраженное уплотнение стенок бронхов. Рентгеноскопия желудка с контрастом: гастроэзофагеальный рефлюкс I ст. Заключение фиброэзофагогастродуоденоскопии: эзофагит А, гастропатия эритематозная. ЭКГ без патологии. При ультразвуковом исследовании сердца выявлена дополнительная хорда полости левого желудочка. Консультация оториноларинголога: искривление перегородки носа влево. Консультация эндокринолога: экзогенно-конституциональное ожирение I-II степени, осложненная форма, стабильное течение. Юношеская гинекомастия, двусторонняя идиопатическая.
Клинический диагноз: Бронхиальная астма, IgЕ-опосредованная, тяжелое персистирующее течение, частично контролируемая. Хроническая дыхательная недостаточность I ст. Экзогенный аллергический альвеолит. Аллергический персистирующий ринит, умеренной степени тяжести. Искривление перегородки носа влево. Астено-невротический синдром. Экзогенно-конституциональное ожирение I-II степени, осложненная форма, стабильное течение. Юношеская гинекомастия, двусторонняя, идиопатическая.
Была назначена следующая контролирующая терапия: серетид 50/500 по одной дозе два раза в день 3 месяца, теопек-300 по 1/2 таблетки два раза в день 3 месяца.
Через 1 месяц пациент обратился повторно. Контроля астмы не наблюдалось.
Предпринята попытка смены терапии. Серетид 50/500 по одной дозе два раза в день 3 месяца в сочетании с теопеком-300 по 1/2 таблетки два раза в день 3 месяца и циклесонидом (Альвеско®) 160 мкг два раза в день 2 недели, с последующей отменой утренней дозы серетида на 2 недели, а затем – полный переход на Альвеско® 160 мкг утром и 320 мкг вечером.
С переходом на терапию Альвеско® в течение 3 месяцев терапии мальчик отмечал улучшение самочувствия, при аускультации не выслушивались хрипы, дыхание оставалось жестким. Удалось отказаться от терапии теопеком, серетидом в пользу Альвеско® (160 мкг утром и 320 мкг вечером). Приступы БА за эти 3 месяца были два раза. Улучшились показатели функции внешнего дыхания по данным повторной спирометрии: ОФВ1 стабильно выше 80% должного. Астма приобрела контролируемое течение.
Таким образом, у 29,1% детей 3–18 лет жизни с тяжелой БА, несмотря на комбированную терапию контролирующими препаратами, не удается достичь контроля болезни. С целью оптимизации терапии пациентов с тяжелой частично контролируемой и неконтролируемой астмой на стандартной базисной терапии необходимо внедрение в клиническую практику современных лекарственных средств, в том числе ИКС, отличающихся большей клинической эффективностью и безопасностью. В качестве такого препарата может рассматриваться циклесонид.
Л И Т Е Р А Т У Р А
1. Papadopoulos N.G., Arakawa H., Carlsen K.-H. et al. // Allergy. – 2012. – Vol.67. – P.976–997.
2. Жерносек В.Ф., Дюбкова Т.П. Диагностика и лечение аллергических болезней у детей: справочник. – Минск: РИВШ, 2013. – 120 с.
3. Жерносек В.Ф. // Семейный доктор. – 2012. – №1. – С.51–56.
4. Casale T.B. Severe asthma // Global atlas of asthma. – Zurich, 2013. – P.112–114.
5. Papadopoulos N.G. Asthma in childhood // Global atlas of asthma. – Zurich, 2013. – P.57–60.
6. Княжеская Н. // Врач. – 2012. – №2. – С.32–35.
7. Ненашева Н.М. // Эффективная фармакотерапия. Пульмонология и оториноларингология. – 2012. – №2. – С.24–33.
8. Архипов В.В., Архипова Д.Е. // Эффективная фармакотерапия. Аллергология и иммунология. – 2012. – №2. – С.6–11.
9. Эфендиева К.Е., Намазова-Баранова Л.С., Левина Ю.Г. и др. // Вопр. соврем. педиатрии. – 2013. – №1. – С.117–122.
10. Gelfand E.W., Georgitis J.W., Noonan M., Ruff M.E. // J. Pediatr. – 2006. – Vol.148. – P.377–383.
Медицинские новости. – 2014. – №12. – С. 29-32.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.