Gontschar I.A.1, Prudyvus I.S.2, Nedzvedz G.K.1
1Republican Scientific and Practical Center of Neurology and Neurosurgery, Minsk, Belarus
2N.N. Alexandrov Republican Scientific and Practical Center of Oncology and Medical Radiology, Minsk, Belarus
Progressive ischemic stroke: functional outcome and survival
Резюме. Цель исследования – анализ взаимосвязи клинических характеристик, факторов риска инсульта с особенностями клинического течения, функциональным исходом и выживаемостью пациентов при основных патогенетических подтипах острого ишемического инсульта (ИИ). Проведено проспективное исследование когорты из 1421 пациента с ИИ; средний возраст 69,5±11,1 года. Частота прогрессирующего клинического течения ИИ составила 30%. Выживаемость пациентов с прогрессирующим ИИ при сроке наблюдения 1 год составила 46,3%, с регрессирующим – 80,4% (р = 0,007). Неблагоприятное течение ИИ ассоциировано с возрастом пациентов, наличием тотального инсульта в каротидном бассейне, атеротромботическим подтипом инсульта, выраженным стенозированием церебральных артерий, фибрилляцией предсердий.
Ключевые слова: выживаемость, инфаркт мозга, ишемический инсульт, прогноз, прогрессирующий инсульт.
Медицинские новости. – 2015. – №2. – С. 68 –71.
Summary. The purpose of investigation is analysis of the relationship of clinical characteristics, risk factors of stroke with features оf clinical course, functional outcome and survival of patients with base pathogenic subtypes of acute ischemic stroke (IS). A prospective cohort study of 1421 patients with IS; average age 69.5±11.1 years was carried out. The frequency of progressive clinical course of IS was 30%. Survival of patients with progressive IS in follow-up of 1 year was 46.3%, while with retrogressive – 80.4% (p = 0.007). Unfavorable course of IS was associated with age, total anterior carotid stroke, atherothrombotic stroke subtype, severed stenosis of cerebral arteries, atrial fibrillation.
Keywords: survival, brain infarct, ischemic stroke, prognosis, progressive stroke.
Meditsinskie novosti. – 2015. – N2. – P. 68 –71.
По данным ВОЗ, сосудистые заболевания головного мозга – одна из ведущих причин заболеваемости, смертности и инвалидизации во всем мире [8, 16]. Однако если в странах с высоким доходом на душу населения за последние 40 лет произошло снижение заболеваемости инсультом на 42%, то в странах с умеренным и низким доходом уровень заболеваемости инсультом вырос на 100% [11, 17]. При этом удельный вес инфаркта головного мозга, или ишемического инсульта (ИИ), среди форм острого нарушения мозгового кровообращения достигает 80–85% [12]. Прогрессирование неврологической симптоматики развивается на фоне проводимой терапии у 16–43% пациентов с инсультом, значительно ухудшая прогноз в остром периоде заболевания [13].
Выявление предикторов и возможных патогенетических механизмов прогрессирования острого инфаркта мозга легло в основу проспективного исследования, включающего 1421 пациента с ИИ, госпитализированных в 2002–2014 гг. в инсультные отделения 5-й городской клинической больницы и Больницы скорой медицинской помощи города Минска.
Цель исследования – анализ взаимосвязи клинических характеристик, факторов риска инсульта с особенностями клинического течения, функциональным исходом и выживаемостью пациентов при основных патогенетических подтипах острого ишемического инсульта.
Материалы и методы
На пилотном этапе исследования был разработан методологический подход к понятию «прогрессирующий инсульт», отраженный в инструкции по применению [4]. Под прогрессирующим клиническим течением ИИ понимают нарастание очаговых неврологических и/или общемозговых симптомов инсульта на 2 и более баллов шкалы Национальных институтов здравоохранения (NIHSS) [1] в первые 7 суток лечения в стационаре либо смерть пациента в указанный период времени.
Исследуемая группа включала 665 (46,8%) мужчин и 756 (53,2%) женщин в возрасте от 30 до 98 лет; средний возраст 69,5±11,1 года. Инфаркт мозга диагностировали с помощью клинических и нейровизуализационных данных. При поступлении в стационар пациентам проводили компьютерную томографию (КТ) головного мозга, дополняя ее, при необходимости, повторной КТ или магнитно-резонансной томографией. Кроме того, пациентам выполняли ультразвуковое обследование магистральных артерий головы (МАГ) и транскраниальную допплерографию, определяя степень атеротромботического стенозирования артерий по критериям NASCET [8]. Выраженность неврологических нарушений оценивали с помощью шкалы NIHSS, функциональный исход инсульта – с использованием модифицированной шкалы Рэнкина (МШР) [1]. Функциональный исход острого периода острого нарушения мозгового крово-обращения (ОНМК) считали удовлетворительным (благоприятным) при полном или частичном восстановлении способностей пациентов к передвижению и самообслуживанию, соответствующие оценке по МШР 0–3 балла. Неудовлетворительный исход лечения – сохранение выраженных инвалидизирующих нарушений, потребность в постороннем уходе или смерть пациента – оценка 4, 5 и 6 баллов МШР соответственно.
На момент выписки из стационара по данным анамнеза, клинической картины заболевания, результатов инструментальных и лабораторных обследований определяли патогенетический вариант ИИ с применением критериев Оксфордского объединенного регистра инсульта [9]. Этиологический подтип инсульта классифицировали в соответствии с критериями TOAST [14], выделяя макроангиопатический, кардиоэмболический, микроангиопатический варианты инсульта. При отсутствии информации о состоянии экстра- и интракраниальных артерий инсульт относили к смешанному/неуточненному подтипу заболевания.
Лечение пациентов с ИИ включало антитромботические, антигипертензивные, нейропротекторные, симптоматические лекарственные средства [4–6]. Тромболитическую терапию пациентам, включенным в настоящее исследование, не проводили. Протокол исследования одобрен этическим комитетом РНПЦ неврологии и нейрохирургии. Критерием включения в исследование было наличие острого инфаркта головного мозга. Критериями исключения явились ОНМК неишемического характера (внутричерепное кровоизлияние, венозный синус-тромбоз), транзиторная ишемическая атака, черепно-мозговая травма, а также онкологические, аутоиммунные, дегенеративные заболевания центральной нервной системы.
Статистический анализ проводили с помощью программ R V.3.0.3 и SPSS Statistics 21. Для сравнения количественных данных с нормальным законом распределения в двух группах применяли дисперсионный анализ, для данных с распределением, отличным от нормального, – тест Манна–Уитни. Для сравнения качественных данных применяли двусторонний точный тест Фишера. Оценку общей наблюдаемой выживаемости пациентов с ИИ проводили с использованием метода Каплана–Майера. Стандартную ошибку точечной оценки выживаемости определяли по формуле Гринвуда. Оценку доверительного интервала выполняли исходя из восстановленного значения функции риска в заданной точке. Сравнение выживаемости в подгруппах выполняли с использованием лог-ранг теста. Различия считали достоверными при p<0,05.
Результаты и обсуждение
Прогрессирующее течение инсульта, сопровождающееся нарастанием неврологической симптоматики в течение первой недели лечения, зафиксировано у 427 (30,0%) пациентов, регрессирующее – у 994 (70,0%) человек. За время пребывания в инсультном отделении скончались 145 (10,2%) из 1421 пациента с острым инфарктом мозга.
Выполнено сопоставление долгосрочной выживаемости пациентов с ИИ в зависимости от клинического течения инсульта (n=1354 чел.). Как показано на рис. 1, прогрессирующее течение инсульта было ассоциировано с резким снижением выживаемости после ОНМК (р=0,007). Выживаемость пациентов с прогрессирующим ИИ при сроке наблюдения 1 год составила 0,463 {95% ДИ: 0,416–0,515}; при сроке наблюдения 3 года – 0,359 {95% ДИ: 0,312–0,413}; при сроке наблюдения 5 лет – 0,304 {95% ДИ: 0,256–0,361}. Благоприятный (регрессирующий) вариант развития инсульта характеризовался достоверно (p<0,001) более высоким уровнем выживаемости, которая достигала при сроке наблюдения 1 год – 0,804 {95% ДИ: 0,779–0,830}; при сроке наблюдения 3 года – 0,666 {95% ДИ: 0,635–0,699}; при сроке наблюдения 5 лет – 0,571 {95% ДИ: 0,536–0,607}.
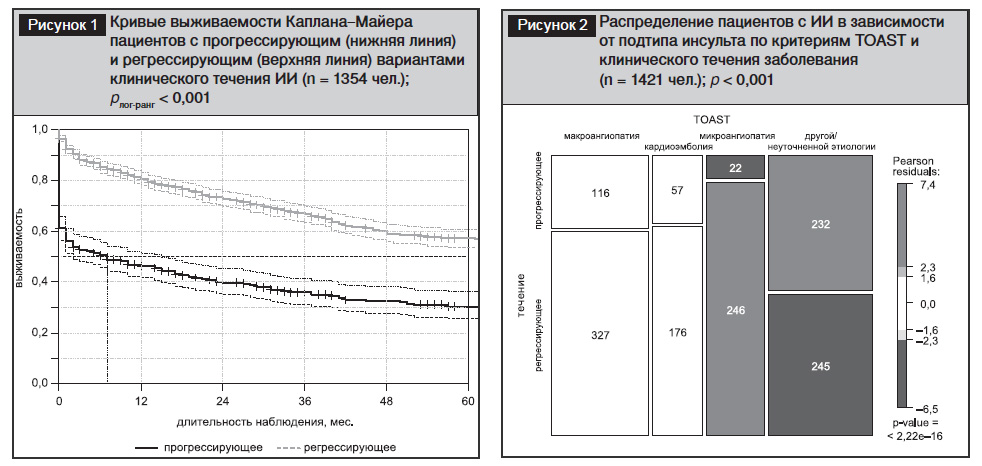
Были рассмотрены факторы, ассоциированные с прогрессирующим течением инсульта. Так, в ранее проведенных исследованиях было показано, что возраст является отягощающим фактором для прогрессирования ИИ [10, 18], что нашло свое подтверждение при анализе данных группы из 1421 пациента. Возраст пациентов с прогрессирующим ИИ составил 72,5±10,2 года, возраст пациентов с благоприятным развитием симптомов ОНМК – 68,1±11,3 года; р<0,001.
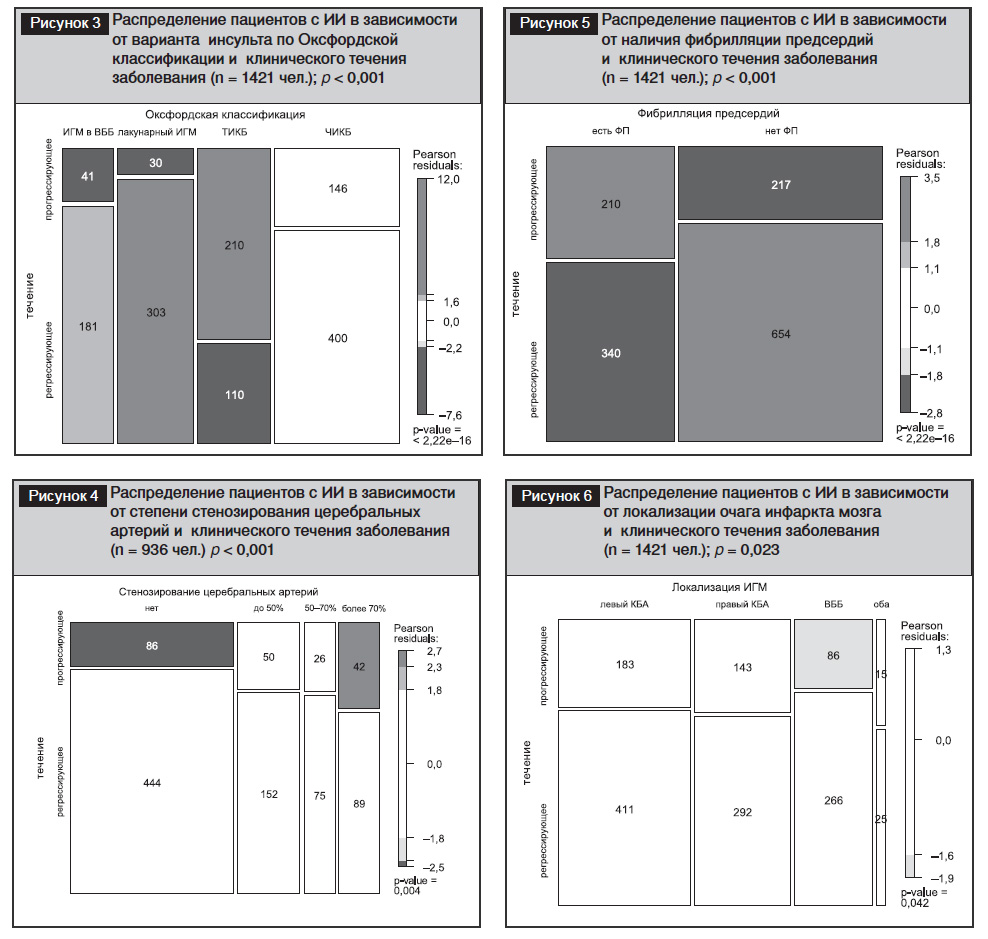
Согласно критериям TOAST [14], частота макроангиопатического (атеротромботического) подтипа ИИ составила 31,2%, кардиоэмболического – 16,4%, микроангиопатического (лакунарного) – 18,9%, инсульта другой/неуточненной этиологии – 33,6% (рис. 2). ИИ относили к последней из упомянутых категорий в случае неполного параклинического обследования, в том числе при отсутствии ультразвукового исследования артерий мозга, а также при конкуренции двух возможных причин церебральной ишемии – например при наличии ипсилатерального стеноза 65% общей сонной артерии и пароксизмальной фибрилляции предсердий (ФП). На рисунке показано, что прогрессирующее развитие ОНМК достоверно чаще зарегистрировано в группах инсульта другой/смешанной этиологии и атеротромботического ИИ, чем при кардиоэмболии и микроангиопатии (p<0,001).
Распределение клинических подтипов ИИ по Оксфордской классификации [9] было следующим: тотальный инсульт в каротидном бассейне (ТИКБ) – 22,5%, частичный инсульт в каротидном бассейне (ЧИКБ) – 38,4%, лакунарный синдром – 23,4%, ИГМ задней мозговой циркуляции (ИГМ в ВББ) – 15,6% (рис. 3). Прогрессирование симптомов ОНМК на фоне проводимого лечения чаще наблюдалось при тотальном и частичном инсультах в каротидном бассейне, чем при других вариантах ИИ (p<0,001).
Проанализированы результаты ультразвукового исследования экстра- и интракраниальных артерий, выполненного у 936 пациентов (рис. 4). В зависимости от степени атеротромботического поражения сосудов пациенты распределялись следующим образом: субстенозирование (n=530), стеноз 30–59% (n=202), стеноз 50–69% (n=101), стеноз или окклюзия артерии (n=131). При этом частота неблагоприятного развития симптомов заболевания возрастала с увеличением степени стеноза, составляя 16,2%, 24,8%, 25,7% и 32,1% соответственно (p<0,001). Наличие стеноза, превышающего 30% просвета церебральной артерии, увеличивало вероятность прогрессирующего нарастания симптомов ИИ почти в 2 раза по сравнению с субстенотическим поражением артерий: 118 (27,2%) из 434 человек и 86 (16,2%) из 530 человек соответственно; отношение шансов (ОШ) = 1,93 {95% ДИ: 1,41–2,64}; р<0,001.
Постоянная или пароксизмальная формы фибрилляции предсердий (ФП) выявлена у 546 (38,4%) из 1421 пациента (рис. 5). Наличие ФП было сопряжено с увеличением частоты неблагоприятного развития симптомов до 38,5%. При отсутствии аритмии вероятность нарастания неврологического дефицита составляла лишь 24,8%: ОШ=1,90 {95% ДИ: 1,51–2,39}; р<0,001.
На пилотном этапе исследования было продемонстрировано преобладание каротидной локализации очага ИГМ по сравнению с вертебрально-базилярной (ВББ) [6]. Анализ данных всей когорты пациентов с ИИ, включенных в исследование, показал, что при поражении левого каротидного бассейна артерий (КБА) доля прогрессирующего варианта инсульта составила 30,8%, при поражении правого КБА – 32,9%, бассейна задней мозговой циркуляции – 24,1%, при выявлении острых ишемических инфарктов в обеих КБА или в КБА и ВББ – 40,0% (р=0,023) (рис. 6).
Нарастание неврологических симптомов ОНМК в первые 7 суток наблюдения приводило к статистически значимому ухудшению функционального исхода инсульта, оцененного при выписке с помощью МШР (n=1418 чел.). Так, в случае прогрессирующего течения ИИ неудовлетворительный результат лечения (4–6 баллов МШР) зафиксирован у 69,6% пациентов, а при регрессирующем течении инсульта – лишь у 22,5%; ОШ=7,92 {95% ДИ: 6,14–10,22}; р<0,001. При этом группа лиц с прогрессирующим развитием заболевания уже в момент госпитализации отличалась тяжелой степенью нарушения неврологических функций от группы регрессирующего инсульта: 10 {6; 16} и 7 {5; 10} баллов NIHSS соответственно; p<0,001. Выявленные различия достигали своего максимума при оценке неврологического дефицита по окончании лечения в стационаре: 12 {7; 42} и 3 {2; 6} баллов соответственно; p<0,001.
Для обозначения прогрессирующего клинического течения ИИ применяют различные термины: «инсульт в развитии», «инсульт в прогрессии», «прогредиентный инсульт», «инсульт в ходу». В настоящее время мы используем определение прогрессирующего ИИ как инсульта, при котором нарастание очагового неврологического дефицита и/или снижение уровня сознания в течение первых 7 суток заболевания соответствуют 2 или более баллам шкалы NIHSS [4]. Частота прогрессирующего клинического течения ИИ в условиях инсультного отделения составляет 30%, что согласуется с результатами зарубежных неврологов. Так, в Гарвардском объединенном регистре инсульта нарастание неврологической симптоматики зафиксировано в 20% случаев. В Барселонском регистре инсульта 37% пациентов характеризовались ранним неврологическим ухудшением. Частота прогрессирования ОНМК составила 25% в японском исследовании острого ИИ. При анализе Лозаннского регистра инсульта отмечено, что ухудшение клинического состояния развилось у 34% пациентов с некардиоэмболическим ИГМ и у 15% – с кардиоэмболическим инсультом [10, 13, 15, 18].
Ряд крупных зарубежных исследований был посвящен выделению факторов риска «инсульта в прогрессии». Клиническими предикторами раннего (в течение первых 5 суток) ухудшения при ИИ считают: инициальную тяжесть инсульта, ФП, сахарный диабет, артериальную гипотензию, чрезмерно высокое артериальное давление, лакунарный инфаркт мозга [15]. Радиологическими предикторами прогрессирующего ИИ являются закупорка крупной мозговой артерии, отек мозга на ранних КТ, обширная зона инфаркта, превышающая 33% бассейна средней мозговой артерии (СМА), повышение плотности (гиперденсность) СМА при КТ-сканировании [3, 6].
В первые 30 суток ИИ летальность достигает 20% [2]. Наиболее частыми причинами смерти пациентов являются повреждение жизненно важных центров головного мозга, острая сердечно-сосудистая недостаточность, пневмония, тромбоэмболия легочной артерии и сепсис [7].
Ранние инвалидизирующие нарушения неврологических функций развиваются у 60–70% лиц, перенесших инфаркт мозга. Неврологические симптомы инсульта имеют тенденцию к исчезновению, в результате чего через 6 месяцев от начала заболевания они остаются у 40% пациентов, а через 1 год – у 30% [3].
В случае прогредиентного клинического течения ИИ существует ряд сложных патофизиологических механизмов, приводящих к утяжелению клинической картины инсульта, таких как недостаточность коллатерального кровоснабжения мозга, геморрагическая трансформация, увеличение внутриартериального тромба, реокклюзия церебральной артерии, повторный инфаркт мозга с вовлечением пораженного или нового сосудистого бассейна, повышение внутричерепного давления, судорожные припадки [15].
Состояние мозгового кровообращения находится в непосредственной зависимости не только от выраженности макро- и микроангиопатических изменений артерий мозга, но и от уровня системного артериального давления, насосной функции сердца, сердечного ритма, величины периферического сосудистого сопротивления, состояния симпато-парасимпатического баланса автономной нервной системы и гемореологических параметров крови [6]. Параметры вегетативной регуляции сердечного ритма, биомаркеры эндотелиальной дисфункции и сердечной недостаточности наряду с клиническими характеристиками служат паттернами ухудшения состояния в остром периоде ишемического инсульта. Знания врача о факторах риска ухудшения клинического состояния позволяют в первые сутки госпитализации в инсультное отделение выделить группу риска среди пациентов с ИИ для проведения адекватных лечебных и диагностических мероприятий, рекомендованных в инструкциях по применению, разработанных в ходе настоящего исследования [4–6].
Таким образом, прогрессирование неврологической симптоматики в течение первых 7 суток госпитализации пациентов с ИИ достигает 30%, представляя непосредственную угрозу для выживаемости и благоприятного функционального исхода острого нарушения мозгового кровообращения. Выживаемость пациентов с прогрессирующим ИИ при сроке наблюдения 1 год составила 46,3%, с регрессирующим клиническим течением инсульта – 80,4%. Неблагоприятное течение ИИ ассоциировано с возрастом пациентов, наличием тотального инсульта в каротидном бассейне, атеротромботическим подтипом ОНМК, выраженным стенозированием церебральных артерий, перманентной либо пароксизмальной формами ФП.
Л И Т Е Р А Т У Р А
1. Белова А.Н. Шкалы, тесты и опросники в неврологии и нейрохирурги. – М., 2004.
2. Виберс Д., Фейгин В., Браун Р. Инсульт. Клиническое руководство / 2-е изд. – М.:; СПб., 2005.
3. Ворлоу Ч.П. и др. Инсульт. Практическое руководство для ведения больных. – СПб.,1998.
4. Гончар И.А., Недзьведь Г.К., Фролов А.В. и др. Применение клинических и кардиоинтервалометрических предикторов для предупреждения прогрессирования инфаркта мозга: Инструкция по применению №150-1110, утв. 17.02.2011. – Минск, 2011.
5. Гончар И.А., Степанова Ю.И., Лихачев С.А. и др. Методы диагностики и лечения нарушений сосудисто-тромбоцитарного и плазменного гемостаза при остром инфаркте мозга: Инструкция по применению №228-1213, утв. 27.12.2013. – Минск, 2014.
6. Гончар И.А., Степанова Ю.И., Прудывус И.С. Биохимические предикторы и маркеры острого инфаркта мозга. – Минск, 2013.
7. Старченко А.А. Клиническая нейрореаниматология. Справочное руководство для врачей; под общ. ред. В.А. Хилько. – М., 2004.
8. Сулина З.А., Фонякин А.В., Гераскина Л.А. и др. Практическая кардионеврология. – М., 2010.
9. Bamford J., Sandercock P., Dennis M. et al. // Lancet. – 1991. –Vol. 337. – P.1521–1526.
10. Birschel P., Ellul J., Barer D. // Cerebrovasc. Dis. – 2004. – Vol.17. – P.242–252.
11. Feigin V.L., Lawes C.M., Bennett D.A. et at. // Lancet Neurol. – 2009. –Vol.8 (4). – P.355–369.
12. Kim A.S., Johnston S.C. // Circulation. – 2011. – Vol.124. – P.314–323.
13. Kwan J., Hand P. // QJM. – 2006. – Vol.99. – P.625–633.
14. McArdle P.F., Ay H., Brown R.D. Jr. et al. // Neurology. – 2014. – Vol.83 (18). – P.1653–1660.
15. Thanvi B., Treadwell S., Robinson T. // Postgrad. Med. J. – 2008. –Vol. 84. – P.412–417.
16. The Atlas of Heart Disease and Stroke / Ed. by J.Mackay, G.Mensah. – Geneva: WHO, 2004.
17. Thrift A.G., Cadilhac D.A., Thayabaranathan T. et al. // Int. J. Stroke. – 2014. – Vol.9. – P.6–18.
18.Weimar C. et al. // Arch. Neurol. – 2005. – Vol.62. – P.393–397.
Медицинские новости. – 2015. – №2. – С. 68-71.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.