|

Пристром А.М., Пырочкин А.В., Черноглаз П.Ф., Борисенко Т.Д., Гаврош Т.С., Дечко С.В., Лушникова И.Е.
Розувастатин (Мертенил®) в профилактике контраст-индуцированной нефропатии при проведении планового чрескожного коронарного вмешательства
1Белорусская медицинская академия последипломного образования, Минск, Беларусь, 1-я городская клиническая больница, Минск, Беларусь
Prystrom А.М.1, Pyrochkin A.V.1, Chernoglas P.F.2, Borisenko T.D.2,
Gavrosh T.S., Dechko S.V.1, Lushnikova I.E.2
1Belarusian Medical Academy of Post-Graduate Education, Minsk, Belarus
21st Minsk City Clinical Hospital, Minsk, Belarus
Rosuvastatin (Mertenil®) in the prevention of contrast-induced nephropathy after elective PCI
Резюме. Проведено открытое одноцентровое, проспективное, контролируемое, рандомизированное клиническое исследование у пациентов с ишемической болезнью сердца и проведением элективного чрескожного коронарного вмешательства (ЧКВ). Показано, что частота развития контраст-индуцированной нефропатии (КИН) составила 14%. Применение высоких доз розувастатина (40 мг в сутки в течение 7 дней до и 3 дней после выполнения элективного ЧКВ) сопровождалось статистически значимо меньшей частотой развития КИН (5,88% и 27%, p=0,04), отсутствием повышения в течение 48 часов после планового ЧКВ уровней креатинина, ингибитора цистеиновой протеиназы (цистатина С) и липокалина, ассоциированного с желатиназой нейтрофилов (NGAL), снижения расчетной скорости клубочковой фильтрации, характерных для контрольной группы, где не применялся розувастатин. Ингибитор цистатина С и NGAL, являясь высокочувствительными маркерами острого повреждения почек, могут использоваться в диагностике КИН.
Ключевые слова: чрескожное коронарное вмешательство (ЧКВ), контраст-индуцированная нефропатия, розувастатин, острое повреждение почек, цистатин С, липокалин, ассоциированный с желатиназой нейтрофилов.
Медицинские новости. – 2016. – №1. – С. 27–32.
Summary. Carry out open label, onecentric, prospective, controlled, randomized clinical trial in patients with Ischemic Heart Disease and elective PCI. Detected, contrast-induced nephropathy (CIN) revealed in 14%. Used high-doses rosuvastatin (40 mgdaily 7 day before and 3 day after elective PCI) accompanied statistically significant lower the incidence of CIN (5,88% versus 27%, p=0,04), no increase during 48 hours after elective PCI levels of creatinine, Inhibitors of cysteine proteases (Cystatin C), serum neutrophil gelatinase associated lipocalin (NGAL), no decrease glomerular filtration rate, characteristic of control group without rosuvastatin. Cystatin C and NGAL, as high sensitive markers of acute kidney injury, may be used in CIN diagnostics.
Keywords: percutaneous coronary intervention (PCI), contrast-induced nephropathy, Rosuvastatin, acute kidney injury, Cystatin C, neutrophil gelatinase associated lipocalin.
Meditsinskie novosti. – 2016. – N1. – P. 27–32.
В последнее десятилетие чрескожное коронарное вмешательство (ЧКВ) стало одной из наиболее часто выполняемых в медицине операций [11, 14]. С целью визуализации сосудов используется внутрикоронарное введение йодсодержащих рентгеноконтрастных средств (РКС). Почти у всех пациентов после введения РКС возникает умеренное транзиторное снижение скорости клубочковой фильтрации (СКФ). Общепринятого определения контраст-индуцированной нефропатии (КИН) нет, однако в большинстве случаев под КИН понимают ятрогенное острое повреждение почек (ОПП), сопровождающееся повышением концентрации сывороточного креатинина более чем на 25%, или на 44 мкмоль/л (0,5 мг/дл), от исходного уровня, при отсутствии других причин через 48–72 часа после вмешательства [6]. Половина случаев КИН диагностируется после проведения катетеризации сердца и проведения ЧКВ. Частота развития КИН варьирует от 3% среди пациентов с нормальной почечной функцией до 40% среди пациентов с хронической болезнью почек (ХБП) [4]. КИН редко сопровождается олигурией. Обычно креатинин сыворотки возвращается к исходному значению в течение 2 недель, тем не менее, развитие олигурии ассоциировано с повышением заболеваемости, смертности и продолжительности госпитализации [4]. По данным А.Р. Дунаевой (2014), КИН является третьей ведущей причиной госпитальной ОПП, ассоциированной с необходимостью проведения гемодиализа и высокой смертностью как в течение госпитализации, так и после выписки пациента из стационара [1]. 13% пациентов, подвергшихся гемодиализу, остаются на заместительной почечной терапии постоянно [4].
Патогенез. Введение РКC провоцирует последующую вазоконстрикцию вследствие повышенной выработки эндотелина и аденозина, подавления эндотелий-зависимой вазодилатации, а также повышения внутриклеточной концентрации кальция. Снижение почечного кровотока приводит к повреждению почки путем активации оксидативного стресса, развития осмотического канальцевого нефроза и ишемии внешних областей мозгового слоя почек. Сопутствующими факторами служат гипотензия, микроэмболии фрагментами атеросклеротических бляшек и кровотечения. Доказанными факторами риска развития КИН служат возраст пациента старше 75 лет, наличие ХБП, сахарного диабета или нарушения толерантности к глюкозе, обезвоживание, гипоальбуминемия (<35 г/л), анемия, фракция выброса левого желудочка (ФВ) <40% или нестабильность гемодинамики, атеросклероз периферических артерий, использование нефротоксичных препаратов (НПВС, диуретики), гиперурикемия или метаболический синдром. Большое значение имеют объем введенного РКС, использование высокоосмолярных РКС и повторное введение РКС.
Диагностика. Диагностика КИН основана на динамике концентрации сывороточного креатинина. Однако этот биомаркер реагирует на повреждение почек с большим опозданием и зависит от нескольких не связанных с функцией почки факторов: пол, возраст, мышечная масса, медикаменты, обезвоживание и статус питания. Кроме того, рост креатинина наблюдается при повреждении значительного количества (50%) нефронов. В то же время быстрота определения повреждений почек предельно важна, так как ранняя диагностика позволяет быстро принять необходимые меры, снизить тяжесть КИН и улучшить выживаемость пациентов. Среди биомаркеров, способных претендовать на лавры «почечного тропонина», наибольший интерес представляют цистатин С и липокалин, ассоциированный с желатиназой нейтрофилов (NGAL).
Цистатин С – ингибитор цистеиновой протеиназы массой 13 кДа – продуцируется всеми ядросодержащими клетками с постоянной скоростью, свободно фильтруется через клубочковую мембрану, полностью метаболизируется в почках и не секретируется проксимальными почечными канальцами [4]. Чем тяжелее ренальная патология, тем хуже цистатин С фильтруется в почках и тем выше его уровень в крови. Измерение концентрации цистатина С в крови позволяет вычислить значения СКФ с помощью формул значительно точнее, чем с использованием креатинина. Уровень цистатина С начинает расти уже через 8 часов после введения РКС, достигает пика через 24 часа, а повышение его концентрации свыше 101 нмоль/л обладает 76% спе-цифичностью и 80% чувствительностью в диагностике КИН [4]. Результаты мета-анализа 13 РКИ показали, что цистатин С сыворотки крови, взятый через 24 часа, является предиктором развития ОПП с чувствительностью и специфичностью в 84 и 82% соответственно [7].
При ишемическом и токсическом повреждении почек многократно увеличивается экспрессия NGAL в клетках канальцевого эпителия, возрастает его концентрация в плазме крови. Среди пациентов, у которых впоследствии развилась КИН, концентрации NGAL в плазме крови повышались уже через 2–4 часа и оставались высокими через 24 часа, в то время, когда уровень креатинина еще не нарастал [8]. Среди здоровых лиц концентрация NGAL колеблется от 40 до 100 нг/мл. Для диагностики КИН используется значение, превышающее 150 нг/мл с чувствительностью 76–90% и специфичностью 74–80% [4].
Благодаря своим плейотропным эффектам определенный интересв исследованиях по профилактике КИН представляют ингибиторы-3-гидрокси- 3-метилглутарил-СоА редуктазы (статины), имеющие физиологические эффекты, противоположные процессам развития КИН. Статины улучшают расслабление гладкой мускулатуры сосудистой стенки, связывают кислородные свободные радикалы, обладают противовоспалительным, антитромботическим действием и стимулируют выработку оксида азота эндотелием. Статины также улучшают работу сигнальных путей и предотвращают апоптоз эпителия почечных канальцев, снижают выработку эндотелина, тормозят ответ рецепторов к ангиотензину II, тем самым предотвращая развитие ишемии и сокращая время гипоперфузии почек.
В исследованиях по профилактике КИН изучались 3 препарата: симвастатин, аторвастатин и розувастатин. Последний имеет наибольшую гидрофильность.
Метаанализ исследований, сравнивавших эффективность высоких и низких доз статинов у пациентов с острым коронарным синдромом, показал преимущество высоких дозировок аторвастатина и симвастатина, в то же время при плановом ЧКВ различия оказались статистически незначимыми [9]. Выводы метаанализа 15 РКИ 2015 г. поддержали тезис о том, что лечение статинами снижает частоту развития КИН в сравнении с плацебо, а также смерти и заместительной почечной терапии. Высокие дозы статинов более эффективны, чем низкие вне зависимости от химических свойств. Рекомендуемая продолжительность предварительного назначения статинов неизвестна [8]. Схожая позиция озвучена в метаанализе 13 РКИ, выполненном в клинике Мейо в 2015 г. [9]. Результаты метаанализа 20 контролируемых исследований и 5 РКИ, посвященных розувастатину, показали, что перипроцедурное назначение последнего снижает риск развития КИН на 51%. Однако лечение розувастатином не показало эффекта в группе пациентов с ХБП, подвергнутых плановой коронароангиографии [10].
В совместном документе европейских и американских экспертов по реваскуляризации миокарда 2014 г. [14] впервые прописаны четкие рекомендации по профилактике КИН при выполнении ЧКВ. Все пациенты с ХБП должны получать адекватную гидратацию изотоническим раствором NaCl со скоростью 1 мл/кг/ч за 12 часов до и в течение 24 часов после ЧКВ (класс показаний I, уровень доказательности A). Необходимо использовать низкоосмолярные и изоосмолярные РКС (класс показаний I, уровень доказательности A). В дополнение к гидратации необходимо назначение коротких курсов терапии розувастатином в дозе 40 или 20 мг, аторвастатином – 80 мг или симвастатином – 80 мг (класс показаний IIa, уровень доказательности A).
Материалы и методы
Поскольку специфических методов лечения КИН не разработано, внимание в современных условиях сосредоточено на разработке эффективной стратегии профилактики развития и ранней диагностики этого частого осложнения. С целью оценки эффективности розувастатина (Мертенил®, ОАО «Гедеон Рихтер») в профилактике КИН при выполнении планового ЧКВ проведено открытое одноцентровое, проспективное, контролируемое, рандомизированное клиническое исследование. Под нашим наблюдением находились 78 пациентов с ишемической болезнью сердца, у которых имелись показания к проведению планового ЧКВ на основании ранее выполненной диагностической коронароангиографии.
Критерии включения в исследование следующие: возраст 45–80 лет; способность пациента выполнять предписания врача и соблюдать необходимые по протоколу испытания процедуры; клинически верифицированный диагноз – ишемическая болезнь сердца; стабильная стенокардия, функциональный класс II–III, НI–IIA (ХСН ФК I–II NYHA); наличие критических стенозов по результатам ранее выполненной коронароангиографии (стеноз ствола либо проксимального отдела передней межжелудочковой ветви >50%, стеноз других коронарных артерий >75%); информированное согласие.
Критерии невключения в клиническое испытание: повышенная чувствительность к РКС или другим применяемым лекарственным средствам; прием пациентами статинов в течение последних 4 недель; подозрение на острый инфаркт миокарда; нестабильное течение стенокардии; артериальная гипотония с показателями систолического АД ≤90 мм рт. ст.; застойная сердечная недостаточность (III или IV ФК по классификации NYHA); острое нарушение мозгового кровообращения; коронарная ангиопластика или шунтирование в течение последних 6 месяцев; тяжелое поражение периферических артерий; поражение клапанов сердца, оказывающее влияние на гемодинамику; хирургические операции на сердце в течение последних 6 месяцев; тяжелая бронхиальная астма или хроническая обструктивная болезнь легких; обструктивная гипертрофическая кардиомиопатия; указания на наличие психического заболевания, алкогольной, наркотической зависимости; хроническая печеночная недостаточность; хроническая почечная недостаточность IIIБ–V стадий; онкологическое заболевание; беременность и период лактации.
Критерии исключения испытуемых (прекращение лечения исследуемым препаратом): добровольное прекращение приема препарата самим пациентом, который свободно мог отказаться от дальнейшего участия в испытании без каких-либо последствий для будущего лечения; пациент полностью завершил исследование согласно протоколу; наличие какой-либо побочной реакции, которое являлось основанием для исключения пациента из исследования; грубое нарушение протокола исследования; отзыв информированного согласия; потеря контакта с пациентом.
Рандомизация пациентов проводилась методом лототрона (с использованием генератора «псевдослучайных чисел»). Рандомизационный код определялся по номеру лота. 34 пациентам (основная группа) за 7 дней до планируемой операции начиналась терапия 40 мг розувастатина и продолжалась в течение 3-х дней после ЧКВ. Пациенты контрольной группы (44 человека) статины не принимали. После выписки всем пациентам был рекомендован прием розувастатина в дозах для достижения целевого уровня холестерина липопротеидов низкой плотности <1,8 ммоль/л. В соответствии с установленной в клинике практикой (плановое стентирование проводится в день поступления) пациенты получали внутривенную гидратацию 0,9% NaCl со скоростью 1 мл/кг/ч во время и в течение 8–12 часов после проведения ЧКВ. Взятие крови на сывороточный креатинин проводилось до операции, через 24 и 48 часов после ЧКВ. Цистатин С и NGAL анализировались через 24 и 48 часов после ЧКВ. Полученную плазму замораживали и хранили до определения вышеуказанных показателей при температуре –70 °С. Для расчета СКФ по формуле Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) для креатинина и соотношения креатинин/цистатин С был использован калькулятор, представленный на сайте The National Kidney Foundation [13]. Риск развития КИН определялся по шкале, предложенной R. Mehran [3]. При проведении ЧКВ использовалось неионное изоосмолярное РКС Iodixanol. Первичной конечной точкой исследования являлась частота развития ОПП в виде повышения уровня креатинина более чем на 25%, или на 44 мкмоль/л, от исходного через 24–48 часов после вмешательства, также оценивались такие конечные точки, как повышение цистатина С и NGAL, снижение СКФ более чем на 25% в течение 48 часов. Проводился анализ динамики уровней креатинина, цистатина С и NGAL.
Количественное определение цистатина С в плазме крови осуществлялось с помощью иммунотурбодиметрического анализа с латексным усилением по калибровочной кривой с использованием реактивов и калибраторов Dialab (Австрия), количественное определение NGAL в плазме крови – проводилось аналогичным методом с использованием реактивов и калибраторов Audit Diagnostics (Ирландия). Статистический анализ полученных данных проводился с помощью программного обеспечения Statistica 5.5, StatSoftCorp. (США) для медико-биологических исследований. Значения изучаемых показателей представлены в виде среднего арифметического значения (M) и среднего квадратичного (стандартного) отклонения (SD), а асимметричные вариационные ряды – в виде медианы (Ме) и интерквартильного интервала [25-й; 75-й процентиль]. При ненормальном распределении применялись непараметрические методы статистики: сравнение двух независимых групп проводилось путем проверки статистических гипотез с применением непараметрического U-критерия Манна – Уитни, для сравнения двух зависимых групп использовался T-критерий Вилкоксона, для сравнения групп по качественному признаку – c2 Пирсона, по бинарному признаку – точный критерий Фишера. Проводился непараметрический корреляционный анализ по Спирмену. Достоверность различий в группах была принята при уровне статистической значимости p<0,05 [2].
Результаты и обсуждение
Сравнительная клинико-биохимическая характеристика пациентов в основной (розувастатин) и контрольной группах представлена в табл. 1.
Таблица 1. Характеристика пациентов, перенесших чрескожное коронарное вмешательство
|
Показатель/Группа
|
Основная группа, n=34
|
Контрольная группа, n=44
|
p, p1
|
|
Возраст, годы
|
67,5±9,69
|
67,1±7,73
|
p=0,82
|
|
Возраст старше 75 лет, n
|
10
|
4
|
p1=0,035*
|
|
Пол (М/Ж)
|
38/6
|
26/8
|
p1=0,3
|
|
Индекс массы тела, кг/м2
|
29±6,3
|
29±7,0
|
p=0,69
|
|
ФВ, %
|
50,2±8,29
|
51,18±5,65
|
p=0,86
|
|
Сахарный диабет, n (%)
|
14 (41%)
|
8 (18%)
|
p1=0,02*
|
|
Объем РКС, мл
|
329±119
|
320±121
|
p=0,33
|
|
Креатинин при поступлении, мкмоль/л
|
110,19±40,6
|
101,77±24,8
|
p=0,63
|
|
Мочевина при поступлении, ммоль/л
|
7,8±3,86
|
7,38±2,99
|
p=0,76
|
|
Калий при поступлении, ммоль/л
|
4,35±0,54
|
4,48±0,44
|
p=0,03*
|
|
Креатинин через 24 часа, мкмоль/л
|
101,11±44,72
|
112,69±34,2
|
p=0,03*
|
|
Мочевина через 24 часа, ммоль/л
|
7,16±2,84
|
7,61±3,5
|
p=0,79
|
|
Калий через 24 часа, ммоль/л
|
4,23±0,43
|
4,48±0,7
|
p=0,20
|
|
Креатинин через 48 часов, мкмоль/л
|
108,05±51,14
|
119,72±35,8
|
p=0,02*
|
|
Мочевина через 48 часов, ммоль/л
|
7,02±2,67
|
7,38±2,48
|
p=0,46
|
|
Калий через 48 часов, ммоль/л
|
4,48±0,36
|
4,48±0,45
|
p=0,69
|
|
NGAL через 24 часа, нг/мл
|
170 [138; 234]
|
175 [121; 236]
|
p=0,9
|
|
NGAL через 48 часов, нг/мл
|
165 [119; 194]
|
200 [153; 259]
|
p=0,07
|
|
Цистатин С через 24 часа, мг/л
|
0,87±0,49
|
0,94±0,41
|
p=0,26
|
|
Цистатин С через 48 часов, мг/л
|
0,79±0,44
|
1,10±0,64
|
p=0,005*
|
|
CKD-EPI для креатинина, СКФ при поступлении, мл/мин/1,73 м2
|
63,13±23,5
|
68,52±19,9
|
p=0,39
|
|
CKD-EPI для креатинина, СКФ через 24 часа, мл/мин/1,73 м2
|
70,65±25,6
|
62,75±22,5
|
p=0,15
|
|
CKD-EPI для креатинина, СКФ через 48 часов, мл/мин/1,73 м2
|
66,5±25,5
|
58,22±20,1
|
p=0,11
|
|
CKD-EPI для креатинина и цистатина С, СКФ через 24 часа,
мл/мин/1,73 м2
|
86,58±32,6
|
77,22±30,3
|
p=0,16
|
|
CKD-EPI для креатинина и цистатина С, СКФ через 48 часов,
мл/мин/1,73 м2
|
85,24±29,1
|
70,36±29,3
|
p=0,011*
|
|
1-я группа риска КИН по Mehran, n (%)
|
12 (35%)
|
26 (59%)
|
c2 Пирсона 5,97 p=0,05
|
|
2-я группа риска КИН по Mehran, n (%)
|
16 (47%)
|
16 (36%)
|
|
|
3-я группа риска КИН по Mehran, n (%)
|
6 (17,6%)
|
2 (4,5%)
|
|
|
КИН, n (%)
|
2 (5,88%)
|
12 (27%)
|
p1=0,04*
|
Примечания: * – статистически значимые различия показателей с вероятностью ошибки, p<0,05; p – вероятность ошибки для критерия Манна – Уитни; p1 – вероятность ошибки для точного критерия Фишера.
Почти по всем исходным показателям, перечисленным в табл. 1, группы статистически значимо не отличались между собой. В основной группе оказалось больше пациентов старше 75 лет (p1=0,035) и пациентов с сахарным диабетом (p1=0,02), однако при распределении исследуемых в категории риска развития КИН по шкале R. Mehran статистически значимых различий между группами не выявлено (c2 =5,97, p=0,05), что указывает на их сопоставимость.
Динамика изучаемых показателей в группах пациентов представлена в табл. 2 и 3.
Таблица 2. Динамика изучаемых показателей в основной группе
|
Показатель
|
При поступлении, n=34
|
Через 24 часа, n=34
|
Через
48 часов,
n=34
|
p1
|
p2
|
p3
|
|
Креатинин, мкмоль/л
|
110,19±40,6
|
101,11±44,72
|
108,05±51,14
|
0,11
|
0,24
|
0,12
|
|
Мочевина, ммоль/л
|
7,8±3,86
|
7,16±2,84
|
7,02±2,67
|
0,76
|
0,56
|
0,84
|
|
Калий, ммоль/л
|
4,35±0,54
|
4,23±0,43
|
4,48±0,36
|
0,54
|
0,17
|
0,006*
|
|
NGAL, нг/мл
|
–
|
199±129
|
169±58
|
–
|
–
|
0,32
|
|
Цистатин С, мг/л
|
–
|
0,87±0,49
|
0,79±0,44
|
–
|
–
|
0,27
|
|
CKD-EPI
для креатинина, СКФ,
мл/мин/1,73 м2
|
63,13±23,5
|
70,65±25,6
|
66,5±25,5
|
0,22
|
0,15
|
0,23
|
|
CKD-EPI для креатинина и цистатина С, мл/мин/1,73 м2
|
–
|
86,58±32,6
|
85,24±29,1
|
–
|
–
|
0,78
|
Примечания: p1 – вероятность ошибки для критерия Вилкоксона (сравнение при поступлении и через 24 часа); p2 – вероятность ошибки для критерия Вилкоксона (сравнение при поступлении и через 48 часов); p3 – вероятность ошибки для критерия Вилкоксона (сравнение через 24 часа и через 48 часов); * – статистически значимые различия показателей с вероятностью ошибки, p<0,05.
Таблица 3. Динамика изучаемых показателей в контрольной группе
|
Показатель
|
При поступлении, n=34
|
Через
24 часа, n=34
|
Через
48 часов, n=34
|
p1
|
p2
|
p3
|
|
Креатинин, мкмоль/л
|
101,77±24,8
|
112,69±34,2
|
119,7±235,8
|
<0,001*
|
0,007*
|
0,013*
|
|
Мочевина, ммоль/л
|
7,38±2,99
|
7,61±3,5
|
7,38±2,48
|
0,42
|
0,89
|
0,67
|
|
Калий, ммоль/л
|
4,48±0,44
|
4,48±0,7
|
4,48±0,45
|
0,19
|
0,38
|
0,45
|
|
NGAL, нг/мл
|
–
|
196±112
|
222±168
|
–
|
–
|
0,04*
|
|
Цистатин С, мг/л
|
–
|
0,94±0,41
|
1,10±0,64
|
–
|
–
|
0,06
|
|
CKD-EPI для креатинина, СКФ, мл/мин/1,73 м2
|
68,52±19,9
|
62,75±22,5
|
58,22±20,1
|
0,005*
|
<0,001*
|
0,01*
|
|
CKD-EPI для креатинина и цистатина С, мл/мин/1,73 м2
|
–
|
77,22±30,3
|
70,36±29,3
|
–
|
–
|
0,045*
|
Примечания: p1– вероятность ошибки для критерия Вилкоксона (сравнение при поступлении и через 24 часа); p2 – вероятность ошибки для критерия Вилкоксона (сравнение при поступлении и через 48 часов); p3 – вероятность ошибки для критерия Вилкоксона (сравнение через 24 часа и через 48 часов); * – статистически значимые различия показателей с вероятностью ошибки, p<0,05.
В основной группе значимого роста креатинина, цистатина С через 24 и 48 часов после проведения ЧКВ не было выявлено. Не отмечено значимого снижения СКФ для креатинина, интегрального показателя креатинин/цистатин С. Через 24 часа было отмечено увеличение содержания NGAL в плазме крови в 2 раза (ожидаемые значения 37–106 нг/мл), что отражает воздействие РКС на почечную функцию, а также тенденция к снижению концентраций через 48 часов. Уровень цистатина С не повысился сверх референсных значений в 0,4–1,2 мг/л. Проведенный корреляционный анализ (табл. 4) не выявил ассоциации между уровнем креатинина через 24 часа и концентрацией NGAL (r=0,19, p=0,2), однако между уровнями креатинина и цистатина С определена прямая корреляционная зависимость как через 24, так и через 48 часов (r=47; p<0,001 и r=0,78; p=0,004 соответственно), что свидетельствует о параллельности и однонаправленности патологических изменений. В основной группе (с применением розувастатина) было отмечено 2 случая развития КИН.
В контрольной группе было отмечено значимое повышение уровня креатинина через 24 после ЧКВ (p<0,001) и через 48 часов (p=0,007), а также значимый прирост за последние 24 часа (p=0,013). Наблюдалась тенденция к повышению уровня цистатина С (p=0,06). Концентрации NGAL также увеличились в 2 раза через 24 часа и достоверно продолжили повышаться через 48 часов (p=0,01), что указывает на продолжение патологических процессов в паренхиме почек. Это подтверждается статистически значимым снижением СКФ, рассчитанным для креатинина через 24 (p=0,005) и 48 (p<0,001) часов, а также за последние 24 часа (p=0,01). Подобная динамика отмечена и для СКФ, рассчитанной для интегрального показателя креатинин/цистатин С (p=0,045). Проведенный корреляционный анализ выявил сильную прямую зависимость между уровнем креатинина через 24 и 48 часов после проведения ЧКВ и концентрациями NGAL, цистатина С в плазме, объемом РКС (табл. 4). В группе пациентов, не принимавших статины перед ЧКВ, КИН развилась у 10 человек. Общее количество случаев КИН составило 12 из 78 (14%), что соответствует данным других исследований [8], однако в основной группе частота развития КИН оказалась статистически значимо ниже (F=0,038; p1=0,04) (см. рисунок).
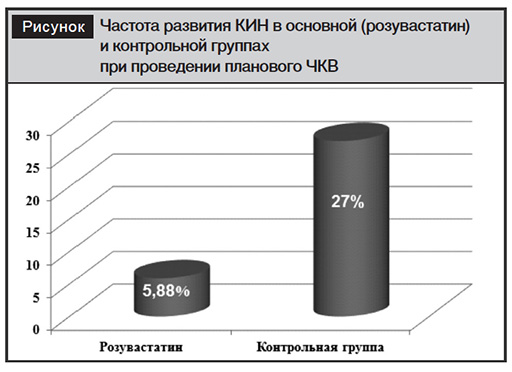
Таблица 4. Статистически значимые корреляции и их коэффициенты в основной и контрольной группах
|
Коррелированные показатели
в основной группе
|
r
|
p
|
Коррелированные показатели
в контрольной группе
|
r
|
p
|
|
Возраст и креатинин при поступлении
|
0,48
|
<0,001*
|
Возраст и креатинин при поступлении
|
0,48
|
<0,001*
|
|
Возраст и креатинин через 24 часа
|
0,44
|
<0,001*
|
Возраст и креатинин через 24 часа
|
0,60
|
<0,001*
|
|
Креатинин через 24 часа и NGAL через 24 часа
|
0,19
|
0,2
|
Креатинин через 24 часа и NGAL
через 24 часа
|
0,68
|
<0,001*
|
|
Креатинин через 24 часа и цистатин С через 24 часа
|
0,47
|
0,004*
|
Креатинин через 24 часа и цистатин С через 24 часа
|
0,66
|
<0,001*
|
|
Креатинин через 48 часов и цистатин С через 48 часов
|
0,78
|
<0,001*
|
Креатинин через 48 часов и цистатин С через 48 часов
|
0,74
|
<0,001*
|
|
ФВ (%) и NGAL
|
–0,41
|
0,046*
|
Креатинин через 48 часов и объем РКС
|
0,37
|
0,01*
|
|
Объем РКС и NGAL через 24 часа
|
–0,41
|
0,046*
|
Креатинин через 48 часов и NGAL через 48 часов
|
0,34
|
0,048*
|
|
Цистатин С через 24 часа и СКФ
для креатинина при поступлении
|
–0,66
|
<0,001*
|
Цистатин С через 24 часа и СКФ
для креатинина через 24 часа
|
0,70
|
<0,001*
|
|
–
|
–
|
–
|
Цистатин С через 48 часов и СКФ
для креатинина через 48 часов
|
–0,75
|
<0,001*
|
|
–
|
–
|
–
|
Цистатин С через 24 часа и объем РКС
|
0,31
|
0,04*
|
|
–
|
–
|
–
|
Цистатин С через 48 часов и объем РКС
|
0,40
|
0,006*
|
|
–
|
–
|
–
|
СКФ для креатинина через 24 часа
и NGAL через 24 часа
|
–0,65
|
<0,001*
|
Примечание: p – вероятность ошибки для r-критерия Спирмена.
Таким образом, в нашем исследовании подтверждается позитивная роль розувастатина в профилактике КИН у пациентов, перенесших элективное ЧКВ. Особенность работы – предложенная схема назначения (40 мг в сутки 7 дней до и 3 дня после ЧКВ), ранее не применявшаяся в клинических исследованиях. В исследованиях с розувастатином, включенных в выше-указанные метаанализы, для диагностики КИН использовался только креатинин плазмы крови. В нашей работе в дополнение к креатинину определялись более чувствительные биомаркеры повреждения почек: уровни цистатина С и NGAL. После применения РКС наблюдалось повышение уровней цистатина С и NGAL, что свидетельствует о развитии повреждения почек, однако через 48 часов после планового выполнения ЧКВ в основной группе уровни цистатина С и NGAL начинают снижаться, а в контрольной группе остаются на прежнем уровне.
Выводы:
1. При применении наиболее безопасного неионного изоосмолярного РКС Iodixanol при проведении планового ЧКВ развитие острого повреждения почек в виде повышения уровня креатинина более чем на 25%, или на 44 мкмоль/л, от исходного через 24–48 часов после вмешательства наблюдалось в 14% случаев.
2. Высокие дозы розувастатина рекомендованы для профилактики контраст-индуцированной нефропатии: при назначении розувастатина 40 мг в сутки в течение 7 дней до и 3 дней после выполнения элективного чрескожного коронарного вмешательства контраст-индуцированная нефропатия была выявлена только у 2 пациентов (5,88%), тогда как в контрольной группе – у 12 пациентов (27%), p=0,04. В течение 48 часов после планового ЧКВ в контрольной группе наблюдался рост уровней креатинина, цистатина С и NGAL, снижение расчетной СКФ, что указывало на продолжение патологических процессов в паренхиме почек. В то время как у пациентов, применявших высокие дозы розувастатина, статистически значимых различий в динамике маркеров почечного повреждения и расчетной СКФ не отмечалось.
3. Ингибитор цистеиновой протеиназы (цистатин С) и липокалин, ассоциированный с желатиназой нейтрофилов (NGAL), являются высокочувствительными маркерами ОПП, высококоррелирующими со «стандартом диагностики КИН» – уровнем креатинина (r=0,64–0,76, р<0,001).
Л И Т Е Р А Т У Р А
1. Дунаева, А.Р. Контраст-индуцированная нефропатия при коронароангиографии / А.Р. Дунаева // Практич. мед. – 2014. – Т.79, №3. – С.37–39.
2. Реброва, О.Ю. Статистический анализ медицинских данных / О.Ю. Реброва. – М.: Медиасфера, 2006. – 305 с.
3. Mehran, R. A simple risk score for prediction of contrast-induced nephropathy after percutaneous coronary intervention: development and initial validation / R. Mehran [et al.] // J. Am CollCardiol. – 2004. – Vol.44. – P.1393–1399.
4. Azzalini, L. Contrast-induced Nephropathy: from Pathophysiology to Preventive Strategies / L. Azzalini, V. Spagnoli, H.Q. Ly // Can J. Cardiol. – 2015. – doi: 10.1016/j.cjca.2015.05.013.
5. Cheungpasitporn, W. Periprocedural effects of statins on the incidence of contrast-induced acute kidney injury: a systematic review and meta-analysis of randomized controlled trials / W. Cheungpasitporn, C. Thongprayoon // Ren Fail. – 2015. – doi: 10.3109/0886022X.2015.1010939.
6. Morcos, S.K. Contrast media induced nephrotoxicity: A consensus report members of contrast media safety committee of the European Society of Urogenital Radiology (ESUR) / S.K.Morcos [et al.] // EurRadiol. – 1999. – Vol.9. – P.1602–1613.
7. Zhang, Zh. Cystatin C in Prediction of Acute Kidney Injury: A Systemic Review and Meta-analysis / Zh. Zhang [et al.] //Am J Kidney Dis. – 2011. – Vol.58 (3). – P.356–365.
8. Mamta, P. Serum neutrophil gelatinase associated lipocalin (NGAL) and cystatin C as early predictors of contrast-induced acute kidney injury in patients undergoing percutaneous coronary intervention / P. Mamta // Clin Chim Acta. – 2014. – Vol.435. – P.48–52.
9. Gandhi, S. Statins and contrast-induced acute kidney injury with coronary angiography / S. Gandhi [et al.] // Am J. Med. – 2014. – Vol.127. – P.987–1000.
10. Chyou, A.C. Statins in the Prevention of Contrast-Induced Nephropathy / A.C. Chyou [et al.] // Curr Treat Options Cardio Med. – 2015. – doi: 10.1007/s11936-015-0375-0.
11. Stefanini, G.G. Drug-eluting coronary-artery stents / G.G. Stefanini, D.R.Jr. Holmes // N. Engl. J. Med. – 2013. – Vol.368(3). – P.254–265.
12. Yang, Y. Rosuvastatin Treatment for Preventing Contrast-Induced Acute Kidney Injury After Cardiac Catheterization: A Meta-Analysis of Randomized Controlled Trials / Y. Yang, Y. Wu, Y. Hu // Medicine. – 2015. – Vol.94(30). – P.1226. – doi:10.1097/MD.0000000000001226.
13. The National Kidney Foundation. Kidney.org (electronic resource). – 2015. – Available at: http://www.kidney.org/professionals/kdoqi/gfr_calculator.cfm(accessed 01 December 2015).
14. Windecker, S. 2014 ESC/EACTS Guidelines on myocardial revascularization. The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) / S. Windecker [et al.] // Eur Heart J. – 2014. – doi:10.1093/eurheartj/ehu278.
Медицинские новости. – 2016. – №1. – С. 27-32.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.
Содержание »
Архив »
|
|