
Sujayeva V.A.
Republican Scientific and Practical Centre «Cardiology», Minsk, Belarus
Opportunities of metabolic therapy at microvascular angina taking
into account a new paradigm of ischemic heart disease development
Резюме. Приведен исторический экскурс, посвященный проблеме стенокардии, отражающий эволюцию взглядов на патогенез развития заболевания. Отдельно рассмотрены особые формы стенокардии, вызывающие наибольшее число вопросов при постановке диагноза и выборе лечения, а именно стенокардия, которая развивается у лиц в отсутствие диагностически значимого поражения коронарных артерий (микроваскулярная стенокардия, кардиальный синдром Х). Описаны современные подходы к выбору терапии с учетом основных патофизиологических механизмов формирования ишемии миокарда при микроваскулярной стенокардии. Дано обоснование целесообразности использования триметазидина – препарата, обладающего метаболическим, а не гемодинамическим действием.
Ключевые слова: ишемическая болезнь сердца, микроваскулярная стенокардия, кардиальный синдром Х, патогенез, атеросклероз коронарных артерий, метаболизм, триметазидин.
Медицинские новости. – 2016. – №3. – С. 14–20.
Summary. Author described historical digression devoted to angina problem, also reflected evolution of views on a problem taking into account new data on pathogenesis of disease. The special attention was put on angina without significant lesion of coronary arteries (microvascular angina or cardiac syndrome X) because this form of angina is the most discussable at statement of the diagnosis, verification and a choice of treatment. Author gave description of therapeutic approaches taking into account the main pathophysiological mechanisms of myocardial ischemia development at microvascular angina. There is justification of expediency of trimetazidine – medicine with not hemodynamic but also metabolic action.
Keywords: ischemic heart disease, microvascular angina, cardiac syndrome X, ischemia’s pathogenesis, atherosclerosis, coronary arteries, metabolism, trimetazidine.
Meditsinskie novosti. – 2016. – N3. – P. 14–20.
Стенокардия (устар. «грудная жаба», лат. «angina pectoris») подразумевает наличие характерных (давящих, сжимающих) болевых ощущений за грудиной, которые появляются при физической нагрузке, эмоциональном стрессе или после приема пищи, иррадиируют в область левого плеча, шеи, нижнюю челюсть, между лопаток, левую подлопаточную область, купируются нитроглицерином или вскоре после прекращения воздействия провоцирующего фактора [4].
Считается, что клиническая картина стенокардии была впервые описана William Heberden, однако в истории медицины существуют доказательства того, что стенокардия была известна и ранее, но имевшиеся знания не могли объяснить сущность заболевания и его причины. Например, философ Сенека в письме к Луцилию описывает свои болезненные ощущения, которые напоминают симптомы стенокардии: «Приступ очень короткий и подобен грозе. Обычно завершается в течение одного часа. Я пережил все телесные страдания и муки, но ни одно из них не было таким болезненным. Почему? Потому что иметь любую болезнь – значит быть больным; иметь это заболевание – значит умирать» [4].
Описание клинических симптомов, напоминающих стенокардию, также можно найти у Fabrizio Bartoletti (1576–1630), Harrevey (1578–1658), Caspar Bartolini (1674), Giambattista Morgagni (1684–1771) и некоторых других исследователей того времени [1]. Однако ни один из перечисленных авторов не выделил описанные изменения в отдельную нозологическую форму.
В 1772 г. доктор William Heberden впервые использовал термин «angina pectoris», дал классическое описание клинической картины заболевания, но не объяснил патогенез развития данных симптомов. Несколько лет спустя после доклада William Heberden, один из пациентов, страдавший припадками anginapectoris, завещал свой труп для вскрытия. При аутопсии в сердце не было найдено анатомических изменений (возможно, потому, что при проведении вскрытия не были исследованы коронарные артерии).
Впервые значение изменений коронарных артерий для возникновения приступов anginapectoris на основании сопоставления данных аутопсии с прижизненной клинической картиной заболевания отметил Edward Jenner. Взаимосвязь изменений коронарных артерий и симптомов ишемической болезни сердца (ИБС) признавали также Parry, Fothergill, Black (1795) [1].
Шотландский хирург Джон Хантер, который сам умер от стенокардии, в 1779 г. писал о взаимосвязи кальцификации коронарных артерий со стенокардией. Он же первый высказал предположение, что ангинозная боль возникает вследствие уменьшения снабжения сердца кровью [4].
На рубеже XIX–XX веков стенокардия относилась к редким заболеваниям, тогда как в последние десятилетия XX – начале XXI века она приняла черты своего рода «неинфекционной эпидемии». Термин «ишемическая болезнь сердца», или «коронарная болезнь сердца» (КБС), был введен по рекомендации Комитета экспертов Всемирной организации здравоохранения в 1967 г. для обозначения острых и хронических заболеваний сердца, вызванных недостаточным снабжением миокарда кровью, а также обструктивными заболеваниями коронарных артерий. Все остальные названия было рекомендовано не употреблять [4].
Следующей заметной вехой в понимании патофизиологических процессов формирования ишемии миокарда при ИБС считаются труды Gould и Lipscomb (1974), которые описали взаимосвязь между сужением коронарных артерий и коронарным кровотоком. Было установлено, что уменьшение диаметра коронарной артерии ≥50% ограничивает максимальную ее способность к дилатации, а уменьшение диаметра ≥85% – ограничивает коронарный кровоток в покое [11].
Эта концепция была перенесена в клиническую практику: сужение просвета коронарной артерии ≥50% было определено как гемодинамически значимый стеноз, а сужение просвета ≥85% – как критический стеноз коронарной артерии [20].
Концепция «критически значимого стеноза коронарных артерий» превратилась в концепцию «стеноза, вызывающего ишемию». На основании этой концепции, в качестве основной причины ИБС было признано сужение просвета коронарной артерии атеросклеротической бляшкой, что нашло отражение в подходах к ведению пациентов со стенокардией. При таком взгляде на патогенез ИБС основная цель, преследуемая при назначении медикаментозного лечения – уменьшение потребности миокарда в кислороде за счет снижения пред- и постнагрузки, что достигалось при использовании препаратов, обладающих гемодинамическим действием. Так, бета-адреноблокаторы (БАБ) и недигидропиридиновые антагонисты кальция (АК) (бензотиазепины, фенилалкиламины) способствовали уменьшению частоты сердечных сокращений (ЧСС) в покое и при нагрузке, дигидропиридиновые АК и периферические вазодилататоры (нитраты) способствовали уменьшению постнагрузки.
Целесообразность гемодинамической разгрузки миокарда для лечения стабильной стенокардии отражена в ряде Рекомендаций Европейского и Американского кардиологических обществ [9, 10].
Среди врачей-клиницистов довольно прочно укоренилось мнение, что имеется прямая причинно-следственная связь между обструкцией коронарных артерий и ИБС, многие воспринимают данные понятия как синонимы. Зачастую диагноз «стенокардия» выставлялся только при наличии гемодинамически значимых стенозов по данным коронароангиографии (КАГ). При отсутствии сужения коронарных артерий при КАГ диагноз ИБС отрицался, назначались дополнительные исследования для исключения сопутствующей патологии (позвоночника, желудочно-кишечного тракта, депрессии и т. д.).
Появление новых данных о патофизиологии формирования ишемии миокарда постепенно ставило под сомнение традиционную парадигму развития ИБС, в центре которой находилась атеросклеротическая обструкция коронарной артерии. Так, по данным F. Lin и соавт., из 163 обследованных ими пациентов, имевших приступы стенокардии, только у 39 (24%) был выявлен обструктивный атеросклероз коронарных артерий, еще 105 (64%) имели необструктивные изменения. Но наиболее важно, что у 15 (38%) из 39 пациентов с диагностически значимыми изменениями коронарных артерий результаты нагрузочных тестов для выявления ишемии миокарда были отрицательными [22].
В исследовании H.C. McGill и соавт. установлено, что при аутопсии молодых людей, умерших от внесердечных причин (суицид, убийство, несчастный случай), у 60% имелись значимые стенозы передней межжелудочковой артерии, хотя при жизни клиническая картина ИБС или стенокардии отсутствовала [26].
При анализе данных 212 пациентов, поступавших в стационар с острым коронарным синдромом (ОКС), в 30,6% случаев было определено отсутствие диагностически значимых изменений коронарных артерий [23].
Особенно часто несоответствие между клинической картиной стенокардии и характером поражения коронарного русла выявляется у лиц женского пола. В исследовании GUSTO IIb среди 12 142 пациентов с ОКС у 30,5% лиц женского пола с нестабильной стенокардией и у 10,5% женщин с инфарктом миокарда (ИМ) с подъемом сегмента ST наблюдались малоизмененные коронарные артерии [23].
По данным S. Agrawal и соавт., у 20–30% пациентов, имеющих стенокардитические боли, коронарные артерии были не изменены или мало изменены [5].
Вместе с тем многочисленные данные с использованием эхокардиографических (ЭхоКГ) и рентгенологических методов визуализации свидетельствуют о том, что у пациентов, не имеющих диагностически значимых изменений коронарных артерий, зачастую при нагрузочных тестах выявляется выраженная ишемия миокарда.
Долгое время получение таких данных трактовалось как «ложноположительный» результат нагрузочного теста. Однако в 1973 г., изучив электрокардиографические (ЭКГ) и метаболические изменения после развития ишемии миокарда во время теста стимуляции правого предсердия, H. Kemp описал новое заболевание, назвав его «кардиальный синдром Х» [17].
Критерии «кардиального синдрома Х» [34]:
1. Стресс-индуцированная ишемия миокарда при физической нагрузке, типичный для стенокардии дискомфорт в грудной клетке.
2. Депрессия сегмента ST во время приступа стенокардии.
3. Нормальные эпикардиальные коронарные артерии по данным КАГ.
4. Отсутствие спонтанного или индуцированного спазма коронарных артерий при введении ацетилхолина или эргоновина.
5. Отсутствие сердечных или внесердечных системных заболеваний (гипертрофическая кардиомиопатия или сахарный диабет – СД), ассоциированных с микроваскулярной дисфункцией.
Термин «микроваскулярная стенокардия» впервые предложили Cannon и Epstein в 1988 г. для обозначения состояния при наличии:
– «нормальных» коронарных артерий;
– типичных симптомов стенокардии;
– доказательств ишемии миокарда по данным стресс-тестов [7, 18, 21].
Микроваскулярная стенокардия рассматривалась как «первичная» при отсутствии сопутствующих заболеваний сердечно-сосудистой системы, сопровождающихся микроваскулярной дисфункцией – артериальная гипертензия (АГ), гипертрофическая кардиомиопатия и т.д. Протекать данное заболевание может как стабильно, так и нестабильно, вплоть до развития ОКС [19].
В дальнейшем во избежание разночтений в настоящей статье стенокардия в отсутствие диагностически значимых стенозов коронарных артерий будет именоваться микроваскулярной.
Патофизиологической основой микроваскулярной стенокардии является эндотелиальная дисфункция коронарных сосудов микроциркуляторного русла. Нарушению эндотелиальной функции, помимо общепринятых факторов риска, таких как дислипидемия, курение, АГ, способствуют инсулинорезистентность, дефицит эстрогенов у женщин в перименопаузальном периоде, оксидативный стресс и воспаление.
Считается, что распространенность микроваскулярной стенокардии у женщин выше в сравнении с лицами мужского пола. Так, в исследовании K.H. Humphris и соавт. при анализе данных 32 856 пациентов, у которых в связи с подозрением на ИБС была выполнена КАГ, 23,3% женщин и только 7,1% мужчин имели нормальные коронарные артерии [13]. Схожие данные получены A.K. Sullivan и соавт.: гемодинамически значимые стенозы выявлены у 41% женщин и лишь у 8% мужчин [41].
Ранее признавалось, что при отсутствии гемодинамически значимых стенозов коронарных артерий вероятность развития неблагоприятных сердечно-сосудистых событий низкая, а прогноз в целом благоприятный. Такая точка зрения подкреплялась данными довольно крупного исследования, проведенного M.N. Papanicolaou и соавт. в 1986 г. Было установлено, что 10-летняя выживаемость без ИМ у пациентов (n=1491), имевших симптомы стенокардии и малоизмененные коронарные артерии (отсутствие стеноза эпикардиальных артерий >25%), составила 99% [33].
Однако более поздние исследования были не столь оптимистичны. В крупном исследовании Women’s Ische-mia Syndrome Evaluation (WISE) было установлено, что в течение 5 лет неблагоприятные сердечно-сосудистые события (ИМ, госпитализации в связи с сердечной недостаточностью, инсульт, смерть от сердечно-сосудистых причин, смерть от всех причин) развивались даже при отсутствии существенных изменений коронарного русла. Так, при малоизмененных коронарных артериях (сужение просвета сосуда от 1 до 49%) при наличии симптомов стенокардии неблагоприятные сердечно-сосудистые события имели место у 16% из 222 пациенток. При отсутствии каких-либо стенозов, но при наличии симптомов стенокардии неблагоприятный исход выявлен у 9% из 319 обследованных и даже у пациенток, не имевших клинической картины стенокардии, неблагоприятные события в течение 5 лет отмечались у 2,4% из 5932 обследованных [12].
Недавно полученные данные также подтверждают ухудшение прогноза у симптомных пациентов с нормальными или малоизмененными коронарными артериями в сравнении с бессимптомными лицами, сопоставимыми по полу, возрасту и другим факторам риска [14, 39]. Немаловажно также существенное ухудшение качества жизни у данной категории пациентов [5].
Эндотелиальная микроваскулярная дисфункция при кардиальном синдроме Х проявляется как в виде уменьшения резерва вазодилатации, так и в виде повышения сосудистого сопротивления микроциркуляторного русла.
Радионуклидные методы исследования позволяют объективизировать преходящие изменения миокардиальной перфузии у 30% пациентов с микроваскулярной стенокардией [25, 28].
При обследовании с таллием установлена взаимосвязь между системной эндотелиальной дисфункцией и появлением дефектов перфузии у лиц с микроваскулярной стенокардией [25, 44]. Одним из возможных механизмов дефектов перфузии называется нарушение работы натрий-калиевого насоса [44].
При магнитно-резонансном исследовании J.R. Panting и соавт. обнаружили уменьшение перфузионного резерва у лиц с микроваскулярной стенокардией в сравнении со здоровыми пациентами [32]. При ядерном магнитно-резонансном исследовании с радиоактивным фосфором у женщин, имевших положительный результат стресс-тестов в выявлении ишемии миокарда, прямое измерение высокоэнергетических фосфатов в миокарде позволило получить доказательства метаболических изменений [6].
Таким образом, приведенные выше данные свидетельствуют о том, что симптомы стенокардии и ишемия миокарда могут быть обусловлены не только поражением коронарных артерий, но и рядом других причин, что приводит к недостаточному поступлению кислорода к миокардиоциту. В свою очередь ишемия на клеточном уровне вызывает метаболические нарушения, которые могут выявляться с помощью современных визуализационных методов исследования.
Широкое внедрение в кардиологическую практику новых рентгенологических методов визуализации, накопление данных о характере изменения миокарда в отсутствие поражения коронарных артерий, сопоставление полученных данных с результатами КАГ и аутопсии расширили знания в области патогенеза формирования ишемии миокарда при ИБС, что привело к изменению парадигмы патогенеза ИБС, которая впервые была представлена M. Marzilli и соавт. в виде «Солнечной системы» (рис. 1) [23, 24].
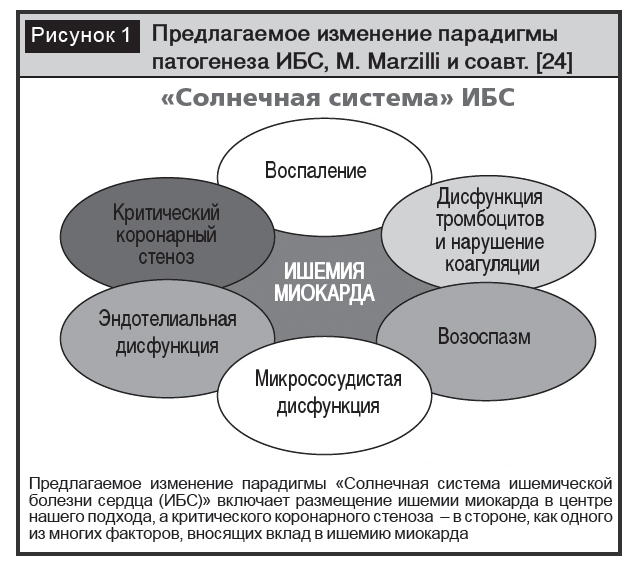
В соответствии с современными представлениями, ишемия миокарда возникает в результате преходящего дисбаланса между доставкой крови и метаболическими потребностями сердца не только по причине стенозирующего атеросклероза, но и вследствие микроваскулярной дисфункции, спазма коронарных артерий или их сочетания [29].
Новая парадигма ИБС позволяет найти ответы на необъяснимые ранее вопросы:
1) чем обусловлена стенокардия и ишемия миокарда при нагрузочных тестах у лиц, не имеющих диагностически значимых стенозов коронарных артерий;
2) в чем причина развития ОКС (вплоть до ИМ) при малоизмененных или неизмененных коронарных артериях;
3) почему использование препаратов, обладающих свойством уменьшать потребность миокарда в кислороде за счет воздействия на гемодинамические параметры, не всегда эффективно при лечении стенокардии;
4) почему наблюдается улучшение симптомов стенокардии, рост толерантности к физической нагрузке (ТФН) и времени до появления ишемии миокарда по данным диагностических стресс-тестов при использовании препаратов, обладающих метаболическим, а не гемодинамическим действием (например, триметазидина).
Изменение парадигмы патогенеза ИБС нашло отражение в Рекомендациях ESC 2013 г. по лечению пациентов со стабильной болезнью коронарных артерий (БКА) [23], то есть сфера влияния новых рекомендаций стала шире по сравнению с предыдущими Рекомендациями 2006 г., посвященным лечению лиц со стабильной стенокардией [9].
В Рекомендациях ESC 2013 г. отмечено, что фармакотерапия у лиц со стабильной БКА должна быть направлена как на устранение симптомов стенокардии, так и на предотвращение развития неблагоприятных сердечно-сосудистых событий [29]. Наиболее убедительные доказательства о положительном влиянии на прогноз у пациентов со стабильной БКА имеются для ацетилсалициловой кислоты (АСК) [15], статинов [37], у лиц с хронической сердечной недостаточностью (ХСН), АГ и СД – для ингибиторов ангиотензинпревращающего фермента (иАПФ), при их непереносимости – для антагонистов рецепторов ангиотензина II (АРА) [42, 36].
Однако ни один из препаратов вышеперечисленных групп не оказывает влияния на симптомы стенокардии. С другой стороны, препараты, улучшающие симптомы стенокардии, не всегда имеют достаточную, с современной точки зрения, доказательную базу о положительном влиянии на выживаемость. Это диктует патофизиологическую обоснованность комплексного подхода к назначению медикаментозной терапии.
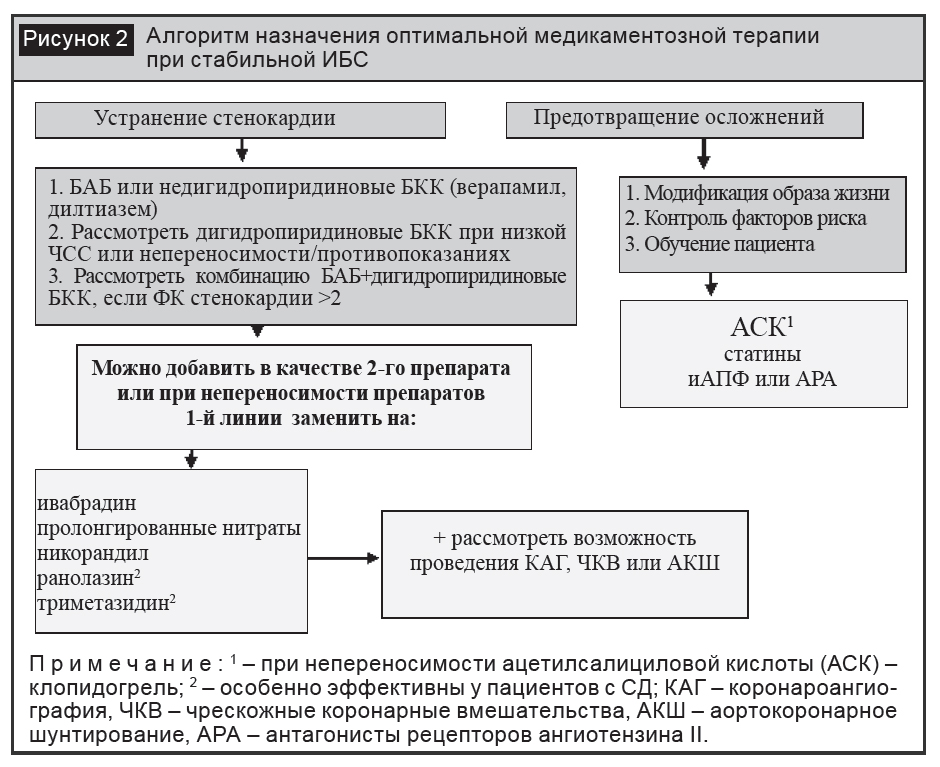
Для устранения симптомов стенокардии и ишемии миокарда рекомендовано назначать лекарственные средства, которые с учетом различного влияния на прогноз разделяются на препараты 1-й линии (доказанно улучшающие прогноз) и препараты 2-й линии (доказательная база о влиянии на прогноз недостаточна либо полученные данные имеют противоречивый характер). К препаратам 1-й линии относятся бета-адреноблокаторы (БАБ) и АК, обладающие гемодинамическим действием.
При недостаточной эффективности в виде монотерапии препаратов 1-й линии рекомендовано назначение комбинированного лечения. Если использование комбинированной терапии недостаточно для купирования симптомов стенокардии, а также при непереносимости препаратов 1-й линии возможно назначение препаратов 2-й линии, к которым относятся нитраты пролонгированного действия, триметазидин, ивабрадин, никорандил, ранолазин (рис. 2) [9, 29].
Триметазидин относится к классу антиишемических препаратов, обладающих не гемодинамическим, а метаболическим действием. Этот препарат путем селективного ингибирования митохондриальной 3-кетоацилКоА-тиолазы уменьшает окисление жирных кислот, что стимулирует использование глюкозы. Таким образом, под действием триметазидина в условиях дефицита кислорода восстанавливается сопряжение гликолиза и окислительного декарбоксилирования, увеличивается количество пирувата, трансформирующегося в ацетил-коэнзим А (ацетил-КоА), что в конечном итоге приводит к увеличению продукции аденозинтрифосфата (АТФ).
Окисление глюкозы способствует синтезу большего количества молекул АТФ на одну потребляемую молекулу кислорода, улучшает баланс между потребностью миокарда в кислороде и его поступлением.
Устранение дефицита внутриклеточного уровня АТФ, возникающего в условиях ишемии миокарда, составляет основу антиишемического кардиопротективного действия препарата. Кроме того, триметазидин активно участвует в утилизации сохраняющихся жирных кислот, стимулируя обмен фосфолипидов в сарколемме. Следствием этого являются уменьшение содержания свободных жирных кислот и создание благоприятных условий для восстановления структурной целостности клеточных мембран. Важный результат действия триметазидина – устранение ацидоза и высокой концентрации внутриклеточного кальция, характерных для ишемии, и перерастяжения кардиомиоцитов, наблюдающихся при стенокардии и хронической сердечной недостаточности (ХСН).
Протективное действие триметазидина в отношении кардиомиоцитов и эндотелиальных клеток уменьшает механическую и эндотелиальную дисфункции, характерные для ишемии и ХСН. Это обеспечивает защиту миокарда от некроза и апоптоза. Поскольку эффекты триметазидина не связаны с влиянием на гемодинамику, его применение, в отличие от традиционных антиангинальных препаратов, не увеличивает риск артериальной гипотензии, брадикардии, нарушений проводимости и усугубления ХСН [2, 3].
Рекомендации ESC 2013 г., учитывающие новую парадигму ИБС, достаточно четко регламентируют ведение пациентов со стабильной БКА. Однако в отношении лиц с микроваскулярной стенокардией такой четкой позиции нет, лечение микроваскулярной стенокардии до сих пор, даже в эру медицины, основанной на доказательствах, является эмпирическим. Это связано как с недостаточным знанием причин этого состояния, так и с небольшим количеством накопленных данных об эффективности более новых, чем нитраты, антиангинальных средств (триметазидин, ивабрадин, никорандил, ранолазин) [5, 23, 24, 29].
Наивысший (I) класс доказанности имеет рекомендация назначения всем пациентам с микроваскулярной стенокардией препаратов, улучшающих прогноз, – АСК и статинов [29]. Традиционные антиишемические препараты (БАБ и АК), как и при стабильной БКА, в лечении микроваскулярной стенокардии являются препаратами 1-й линии, причем предпочтительно добавлять АК к БАБ, а не наоборот [7]. Такой подход обусловлен полученными A. Oto, K.M. Gürses данными о том, что пропранолол более выраженно в сравнении с верапамилом и атенолол значительно эффективнее в сравнении с амлодипином способствовали уменьшению числа приступов стенокардии у пациентов с неизмененными коронарными артериями [31].
Также установлено, что БАБ III поколения (небиволол и карведилол), обладающие дополнительным действием на эндотелийзависимую вазодилатацию, более эффективны при лечении микроваскулярной стенокардии, чем традиционные БАБ [31].
Несмотря на хорошо известный антиангинальный механизм действия АК, при микроваскулярной стенокардии эффективность препаратов данной группы остается не до конца ясным. С одной стороны, A. Oto, K.M. Gürses показали, что время до появления ишемии миокарда при стресс-тестах после приема верапамила или нифедипина увеличивается более значимо в сравнении с плацебо [31]. С другой стороны, внутривенное введение дилтиазема не оказывало существенного действия на исходно сниженный резерв коронарного кровотока у лиц со стенокардией, не имеющих существенных коронарных стенозов.
При рефрактерности симптомов микроваскулярной стенокардии к БАБ, АК или к их комбинации к комплексной терапии рекомендовано присоединять иАПФ или АРА, которые могут влиять на эндотелиальную функцию за счет уменьшения вазоконстрикторного действия АТ-II [29].
Однако данные об эффективности иАПФ и АРА при микроваскулярной стенокардии получены в небольших исследованиях, причем преимущественно у лиц с СД, имеющих отличные от кардиального синдрома Х механизмы эндотелиальной дисфункции, вследствие чего данная рекомендация имеет невысокий класс рекомендованности (таблица).
Таблица. Лечение пациентов с микроваскулярной стенокардией с учетом доказанности эффективности вмешательства [29]
|
Рекомендации
|
Класс
рекомендации
|
Уровень
доказанности
|
|
Рекомендуется назначать всем пациентам препараты для вторичной профилактики, включая АСК и статины
|
I
|
B
|
|
Бета-адреноблокаторы рекомендуются
в качестве препаратов первой линии
|
I
|
B
|
|
Антагонисты ионов кальция рекомендуются, если БАБ не обеспечивают достаточного симптоматического эффекта или не переносятся
|
I
|
B
|
|
У пациентов с рефрактерными симптомами
можно рассматривать иАПФ или никорандил
|
IIb
|
B
|
|
Ксантиновые производные или нелекарственные методы лечения (нейростимуляция) можно рассматривать
у пациентов с симптомами, рефрактерными
к перечисленным выше препаратам
|
IIb
|
B
|
Для пациентов с микроваскулярной стенокардией характерна низкая эффективность нитратов (как короткодействующих, так и имеющих пролонгированное действие), что затрудняет как купирование приступов, так и их профилактику и существенно ухудшает качество жизни. Купировать болевой синдром при микроваскулярной стенокардии удалось лишь у 42% пациентов, причем при одновременном приеме короткодействующего нитроглицерина и АК [31].
Так, ученые продемонстрировали, что у лиц, имеющих диагностически значимые стенозы коронарных артерий, сублингвальный прием короткодействующего нитроглицерина увеличивает время до появления ишемии миокарда при стресс-тестах, что не характерно для лиц с микроваскулярной стенокардией. Полученные в настоящем исследовании данные позволили сделать вывод, что нитраты не оказывают существенного вазодилатирующего действия на сосуды микроциркуляторного русла [31].
Пациентам с микроваскулярной стенокардией, рефрактерной к разным комбинациям ранее назначенных препаратов, могут быть предложены другие формы лечения [29]. Ксантиновые производные (аминофиллин) рекомендовано добавлять к антиишемическому лечению с целью уменьшения стенокардии за счет блокады аденозиновых рецепторов, так как аденозин является одним из медиаторов ишемической боли в сердце. Индивидуальная реакция на боль в последнее время называется одной из возможных причин развития клинической картины стенокардии при отсутствии изменений коронарных артерий [31].
В 2014 г. в Европейском кардиологическом журнале вышел обзор, посвященный лечению микроваскулярной стенокардии, с учетом полученных новых данных [31]. Практически одновременно в журнале «Клиническая кардиология» опубликована точка зрения Американского общества кардиологов на лечение «кардиального синдрома Х» [5].
В представленных Рекомендациях ESC и ACC/AHA, помимо указанных традиционных антиангинальных препаратов для лечения стенокардии в отсутствие значимых стенозов коронарных артерий, отдельное внимание уделено как использованию, так и продолжению дальнейших исследований эффективности новых лекарственных средств (ранолазин, ивабрадин и триметазидин) [5, 31].
Эффективность 4-недельного приема ранолазина у женщин с микроваскулярной стенокардией доказана P.K. Mehta и соавт. При этом установлено как улучшение симптомов стенокардии, так и уменьшение выраженности ишемии миокарда по данным стресс-тестов [27].
Добавление ранолазина к традиционной антиангинальной терапии в течение 4 недель в исследовании [31] способствовало уменьшению выраженности болевого синдрома и частоты развития приступов при микроваскулярной стенокардии, однако не оказывало влияния на эндотелиальную функцию и резерв коронарного кровотока по данным инструментальных методов обследования.
Еще одним относительно новым антиангинальным лекарственным средством является ивабрадин, механизм действия которого заключается в ингибировании If-каналов синусового узла. В работе [43] доказано, что 4-недельный прием ивабрадина способствует существенному улучшению симптомов стенокардии без влияния на эндотелиальную функцию и резерв коронарного кровотока. По-видимому, данное лекарственное средство обладает значительной положительной перспективой для лечения микроваскулярной стенокардии, так как, в отличие от БАБ, ивабрадин не вызывает вазоконстрикцию, обладая при этом сопоставимым отрицательным инотропным действием. Проведение клинических исследований в этой области целесообразно, получение их результатов может изменить уровень доказанности IIb (B) для данного препарата и открыть новую страницу в лечении микроваскулярной стенокардии.
Еще одним из перспективных, но недостаточно изученных направлений в лечении микроваскулярной стенокардии с точки зрения новой парадигмы ИБС, является использование препаратов, влияющих не на стеноз коронарной артерии, а на метаболизм миокардиоцита. Таким свойством обладает, например, триметазидин. Кроме того, патофизиологическую целесообразность его использования при микроваскулярной стенокардии обусловливает его способность улучшать эндотелийзависимую вазодилатацию [2, 3].
Клинические доказательства эффективности триметазидина при микроваскулярной стенокардии получены в двойном слепом плацебо-контролируемом исследовании S. Nalbagantgil и соавт., проведенном у 35 пациентов с микроваскулярной стенокардией (8 мужчин, 27 женщин) в возрасте 36–57 лет (в среднем 43,9±6,4 года). Под влиянием 4-недельного приема триметазидина в суточной дозе 60 мг наблюдалось более выраженное в сравнении с группой плацебо уменьшение выраженности депрессии сегмента ST при стресс-тесте, а также увеличение времени выполнения теста до появления ишемии миокарда, что позволило сделать авторам вывод об эффективности триметазидина при микроваскулярной стенокардии [30].
D. Rogacka и соавт. изучали влияние триметазидина в дозе 20 мг 3 раза в день на симптомы стенокардии и ТФН у пациентов с кардиальным синдромом Х. В исследование было включено 34 пациента (20 женщин и 14 мужчин) в возрасте 32–60 лет, у которых имела место клиническая картина стенокардии, положительный результат стресс-теста и неизмененные коронарные артерии по данным КАГ. Через 1 месяц лечения у 11,76% обследованных отмечался отрицательный результат стресс-теста на наличие ишемии миокарда; через 6 месяцев таких пациентов было 14,71%. Через 6 месяцев приема триметазидина симптомы стенокардии выявлялись лишь у 38,23% пациентов, в то время как исходно были у 76,47% (р<0,05). При этом триметазидин не оказывал существенного влияния на АД и ЧСС. Время выполнения стресс-теста до появления ишемии миокарда увеличилось от 563,4±190,4 с до 652,9±206,2 – через 1 месяц приема препарата (р=0,0047) и до 650,3±207,8 – через 6 месяцев (р=0,0094) [38].
Практика показывает, что эффективность антиангинального лечения микроваскулярной стенокардии крайне широко варьирует, и для достижения удовлетворительного результата зачастую требуется пробное назначение разных лекарственных средств и их комбинаций [29].
Таким образом, в лечении микроваскулярной стенокардии остается большое количество «белых пятен», которые требуют продолжения исследований. Для этой формы стенокардии характерно существенное ухудшение качества жизни, резкое ограничение повседневной двигательной активности, безосновательный вызов «скорой помощи», что в совокупности способствует росту затрат здравоохранения на лечение.
Косвенный экономически ущерб при микроваскулярной стенокардии обусловлен также тем, что пациенты зачастую вынуждены отказываться от работы из-за выраженности симптомов и малой эффективности медикаментозного лечения. Продолжительные, постоянно повторяющиеся боли в груди являются поводом для необоснованного выполнения коронароангиографий, в том числе повторных. По данным [35], расходы здравоохранения на лечение 1 пациентки со стенокардией без значимых изменений коронарных артерий в течение всей ее жизни могут достигать 1 млн долларов США. Использование рациональных комбинаций антиангинальных препаратов с различными механизмами действия (гемодинамическое и метаболическое) может стать одним из возможных решений данной проблемы и требует дальнейшего детального изучения.
Л И Т Е Р А Т У Р А
1. Большая медицинская энциклопедия / под ред. Н.А. Семашко. – М., 1929. – Т.8. – С.142.
2. Задионченко В.С., Шехян Г.Г., Багатырова К.М. и др. // РМЖ. – 2012. – №11. – С.548.
3. Лупанов В.П. // Consilium Medicum. – 2014. – №05. – С.37–43.
4. Портал медицинских лекций. – [Электрон. ресурс]. http://medlec.org/lek3-8759.html. – Дата доступа 08.02.2016.
5. Agrawal S., Mehta P.K., Merz N.D. // Cardiol Clin. – 2014. – Vol.32(3). – P.463–478. doi:10.1016/j.ccl.2014.04.006.
6. Buchthal S.D., den Hollander J.A., Merz C.N. et al. // N. Engl. J. Med. – 2000. – Vol.342. – P.829–35.
7. Cannon R.O., Watson R.M., Rosing D.R., Epstein S.E. // Am. J. Cardiol. – 1985. – Vol.56. – P.242–246.
8. CAPRIE Steering Committee // Lancet. – 1996. – Vol.348. – P.1329–1339.
9. Fox K., Garcia M.A., Ardissino D., Buszman P. et al. // Eur. Heart. J. – 2006. – Vol.27. – P.1341–1381.
10. Gibbons R.J., Abrams J., Chatterjee K. et al. // Circulation. – 2003. – Vol.107. – P.149–158.
11. Gould KL., Lipscomb K. // Am. J. Cardiol. – 1974. – Vol.34. – P.48–55.
12. Gulati M., Cooper-DeHoff R.M., McClure C. et al. // Arch. Intern. Med. –2009. – Vol.169(9). – P.843–850.
13. Humphries K.H., Pu A., Gao M., Carere R.G. et al. // Am. Heart J. – 2008. – Vol.155(2). – P.375–381.
14. Jespersen L., Hvelplund A., Abildstrom S.Z. et al. // Eur. Heart J. – 2012. – Vol.33(6). – P.734–744.
15. Juul-Moller S., Edvardsson N., Jahnmatz B. et al. // Lancet. – 1992. – Vol.340. – P.1421–1425.
16. Kaski J.C. // Cardiovasc. Res. – 2002. – Vol.53. – Р.620–626.
17. Kemp H.G. Jr. // Am. J. Cardiol. – 1973. – Vol.32(3). – P.375–376.
18. Kemp H.G., Kronmal R.A., Vliestra R.E. et al. // J. Am. Coll. Cardiol. – 1986. – Vol.7. – P.479–483.
19. Lanza G.A., Crea F. // Circulation. – 2010. – Vol.121. – P.2317–2325.
20. Levine G.N., Bates E.R., Blankenship J.C. et al. // J. Am. Coll. Cardiol. – 2011. – Vol.58. – P.e44 –122.
21. Lichtlen P.R., Bargheer K., Wenzlaff P. // J. Am. Coll. Cardiol. – 1995. – Vol.25. – P.1013–1018.
22. Lin F., Shaw L.J., Berman D.S. et al. // Atherosclerosis. – 2008. – Vol.197. – P.700–709.
23. GUSTO IIb (Global Use of Strategies to Open Occluded Coronary Arteries IIb Investigators) // N. Engl. J. Med. – 1996. – Vol.335. – Р.775–782.
24. Marzilli M., Merz C.N.B., Boden W.E. et al. // Рацио-нальная фармакотерапия в кардиологии. – 2012. – Vol.8(5). – Р.721–726.
25. Masci P.G., Laclaustra M., Lara J.G. et al. // Am. J. Cardiol. – 2005. – Vol.95. – P.1478–1480.
26. McGill H.C., Jr., McMahan C.A., Zieske A.W. et al. // Circulation. – 2000. – Vol.102. – P.374–379.
27. Mehta P.K., Goykhman P., Thomson L.E. et al. // JACC Cardiovasc Imaging. – 2011. – Vol.4 (5). – P.514–22.
28. Mendelsohn M.E., Karas R.H. // N. Engl. J. Med. – 1999. – Vol.340. – P.1801–1811.
29. Montalescot G., Sechtem U., Achenbach S. et al. // Eur. Heart J. – 2013. – Vol.34. – Р.2949–3007.
30. Nalbantgil S., Altinti A., Yilmaz H et al. // Int. J. Angiol. – 1999. – Vol.8(1). – P.40–43.
31. Oto A., Gürses K.M. // Eur. J. ESC Council for Cardiology Practice. – 2014. – Vol.12, N30.
32. Panting J.R., Gatehouse P.D., Yang G.Z. et al. // N. Engl. J. Med. – 2002. – Vol.346. – P.1948–1953.
33. Papanicolaou M.N., Califf R.M., Hlatky M.A. et al. // Am. J. Cardiol. – 1986. – Vol.58 (13). – P.1181–1187.
34. Parsyan A., Pilote L. // Can. J. Cardiol. – 2012. – Vol.28 (Suppl.2). – P.S3–6.
35. Pepine C.J., Anderson R.D., Sharaf B.L. et al. // J. Am. Coll. Cardiol. – 2010. – Vol.55. – P.2825–2832.
36. Pfeffer M.A., Braunwald E., Moye L.A. et al. // N. Engl. J. Med. – 1992. – Vol.327. – P.669–677.
37. Reiner Z., Catapano A.L., De Backer G. et al. // Eur. Heart. J. – 2011. – Vol.32. – P.1769–1818.
38. Rogacka D., Guzik P., Wykretowicz A et al. // Coron. Artery Dis. – 2000. – Vol.11(2). – P.171–177.
39. Sedlak T.L., Lee M., Izadnegahdar M. et al. // Am. Heart. J. – 2013. – Vol.166 (1). – P.38–44.
40. Sueda S., Kohno H., Fukuda H. et al. // Chest. – 2003. – Vol.123. – P.380–386.
41. Sullivan A.K., Holdright D.R., Wright C.A. et al. // BMJ. –1994. – Vol.308 (6933). – P.883–886.
42. The SOLVD Investigators // N. Eng J Med. – 1991. – Vol.325. – P.293–302.
43. Villano A., Di Franco A., Nerla R. et al. // Am. J. Cardiol. – 2013. – Vol.112 (1). – P.8–13.
44. Zeiher AM., Krause T., Schachinger V. et al. // Circulation. – 1995. – Vol.91. – P.2345–2352.
Медицинские новости. – 2016. – №3. – С. 14-20.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.