Adamenka A.I.1, Silivontchik N.N.2
1Belarusian State Medical University, Minsk
2Belarusian Medical Academy of Post-Graduate Education, Minsk
StillenTM in prevention of nonsteroidal anti-inflammatory drugs-associated
gastropathy: recommendations for practicing physician
Резюме. Нестероидные противовоспалительные средства (НПВС) входят в лидирующую группу лекарственных средств не только по частоте использования, но и по частоте побочных эффектов. В статье изложены основные механизмы развития поражений желудочно-кишечного тракта, связанные с приемом ацетилсалициловой кислоты и НПВС, клинико-эндоскопическая характеристика проявлений, факторы риска НПВС-гастропатии, методы лечения и профилактики, представлена информация о новом растительном цитопротекторе под торговым названием Стиллен® (StillenTM).
Ключевые слова: нестероидные противовоспалительные средства, ацетилсалициловая кислота, НПВС-гастропатия, профилактика, цитопротекторы.
Медицинские новости. – 2016. – №3. – С. 34–39.
Summary. Nonsteroidal anti-inflammatory drugs (NSAIDs) are included into the leading medicines of not only on use frequency, but also on the frequency of side effects. In this article is provided the main mechanisms of digestive tract damages connected with acetilsalicylic acid and NSAIDs, clinic-endoscopic findings, risk factors of NSAID-gastropathy, prevention and treatment strategy, information on a new vegetable cytoprotective agent StillenTM.
Keywords: nonsteroidal anti-inflammatory drugs, acetylsalicylic acid, NSAID-gastropathy, prevention, cytoprotective agents.
Meditsinskie novosti. – 2016. – N3. – P. 34–39.
Нестероидные противовоспалительные средства (НПВС), в том числе ацетилсалициловая кислота (АСК), прочно вошли в повседневную практику. Согласно литературным данным, около 1,2% населения во всем мире принимает НПВС регулярно [35], намного больше людей принимают их периодически как обезболивающие и противовоспалительные лекарственные средства (ЛС). НПВС чрезвычайно широко востребованы в ревматологической, кардиологической практике, для лечения боли и воспаления. С каждым годом показания для назначения НПВС, как и их количество, расширяются. Так, обсуждается возможность применения НПВС для хемопревенции колоректального рака [34].
НПВС входят в лидирующую группу не только по частоте использования, но и по частоте побочных эффектов, в том числе серьезных. НПВС индуцируют изменения слизистой оболочки (СО) желудка и двенадцатиперстной кишки, которые в целом определяются термином «НПВС-гастропатия». Наряду с Нelicobacter pylori (Н. pylori)НПВС являются ведущим этиологическим фактором развития язвы желудка и двенадцатиперстной кишки, а также гастроинтестинальных кровотечений и перфораций. Показано, что в течение 1 года лечения НПВС у 2–5% у пациентов возникают субэпителиальные геморрагии, эрозии и язвы желудка, реже – двенадцатиперстной кишки, протекающие часто бессимптомно, выявляемые при эндоскопическом исследовании, с риском кровотечений и перфораций [1, 4–6, 8, 9, 29]. Согласно анализу, проведенному Управлением по надзору за качеством пищевых продуктов и лекарственных средств США (FDA), ежегодно поражение ЖКТ, связанное с приемом НПВС, становится причиной 100–200 тыс. госпитализаций и 10–20 тыс. смертельных исходов [15]. Исследования, проведенные в Республике Беларусь, показали, что НПВС-гастропатия развивается у 30,5% пациентов, регулярно принимающих НПВС [2].
В целом, у пациентов, принимающих НПВС, абсолютный риск гастроэнтерологических осложнений увеличивается в 7 раз, потребность в стационарном лечении – в 6 раз, а смертность в 2 раза выше, чем в популяции [8]. Все вышеперечисленное привлекает особое внимание к проблеме безопасного применения НПВС, остающейся одной из наиболее актуальных в современной клинической медицине.
Патофизиология поражения
желудочно-кишечного тракта
под влиянием НПВС
При приеме НПВС может поражаться любой отдел ЖКТ. По сравнению с желудком поражения других отделов ЖКТ – пищевода и кишечника («НПВС-энтеропатия») – обсуждаются реже, однако также занимают важное место в клинической практике. Основной механизм поражения ЖКТ ? нарушение защитного барьера СО. Патологическое воздействие НПВС на ЖКТ осуществляется на нескольких уровнях: во время всасывания при любом способе введения (через рот или прямую кишку); вследствие системного воздействия после всасывания; после экскреции печенью при попадании НПВС с желчью в кишечник; при повторном попадании в желудок вследствие дуодено-гастрального рефлюкса и в кишечник в процессе энтеро-гепатической циркуляции.
Эффекты НПВС реализуются через местные и системные механизмы, причем ведущая роль отводится системным, к которым относятся выработка простагландинов и некоторых других факторов (фактор некроза опухолей, стимуляция лейкоцитов и образование активных форм кислорода) [4, 5, 9, 26, 29].
В ЖКТ простагландины поддерживают эффективность защитного барьера, суммарно их эффект можно определить термином «цитопротекция». СО желудка подвергается действию различных агрессивных факторов, в том числе НПВС. Для защиты от повреждений стенкой желудка выделяются собственные простагландины, которые стимулируют продукцию адекватной по количеству и качеству гастродуоденальной слизи, секрецию в просвет желудка бикарбонатов, увеличивают кровоток, обеспечивают регенерацию СО. Недостаток простагландинов решающим образом снижает защитные свойства гастродуоденальной СО.
Повреждающие эффекты НПВС обусловлены их способностью тормозить синтез простагландинов, что связано с основным фармакологическим эффектом НПВС и осуществляется через ингибирование активности циклооксигеназы (ЦОГ). В организме человека имеется два изофермента ЦОГ – ЦОГ-1 (физиологическая – присутствует в ЖКТ, почках, тромбоцитах) и ЦОГ-2 (индуцируемая – в норме присутствует в тканях в очень малом количестве, но резко возрастает при воспалении). Положительные терапевтические эффекты НПВС связываются с их способностью ингибировать ЦОГ-2, побочные – с ингибированием ЦОГ-1.
Все НПВС подавляют активность обеих изоформ ЦОГ, но в неодинаковой степени, что определяет их безопасность в отношении ЖКТ. В последнее время в качестве главного классификационного признака НПВС используется селективность в отношении ЦОГ (табл. 1).
Таблица 1. Классификации нестероидных противовоспалительных средств
|
Российская классификация [9]
|
Классификация FDA [37]
|
|
Неселективные (неспецифические)
ингибиторы ЦОГ-1 и ЦОГ-2:
ацеклофенак, ацетилсалициловая кислота, диклофенак, ибупрофен, кетопрофен, кеторолак, набуметон, напроксен, пироксикам, сулиндак
|
Неселективные НПВС:
ацеклофенак, ацетилсалициловая кислота, диклофенак, ибупрофен, кетопрофен, кеторолак, мелоксикам, набуметон, напроксен, нимесулид, пироксикам, сулиндак
|
|
Препараты с преимущественным
влиянием на ЦОГ-2:
мелоксикам, нимесулид
|
ЦОГ-2 селективные НПВС (коксибы):
вальдекоксиб, целекоксиб, эторикоксиб
|
|
Коксибы (специфические ингибиторы ЦОГ-2):
вальдекоксиб, целекоксиб, эторикоксиб
|
Относительно безопасности НПВС и рисков гастроинтестинальных осложнений выполнено огромное число исследований. Согласно данным большинства из них, наиболее безопасными ЛС среди неселективных (неспецифических) ингибиторов ЦОГ-1 и ЦОГ-2 являются ацеклофенак, ибупрофен, диклофенак, а наиболее токсичными – индометацин и кеторолак [9, 15, 29].
Клинико-эндоскопическая
характеристика
НПВС-гастропатии
Побочные желудочные симптомы на фоне приема НПВС – тяжесть или боли в эпигастрии (желудочная диспепсия), а также тошнота, рвота, изжога – отмечаются у 30–40% потребителей, чаще при длительном приеме, и в 5–15% случаев могут стать причиной прерывания лечения уже в первые 6 месяцев. Клиническая симптоматика слабо коррелируют с истинной тяжестью поражения СО. Так, у 40% пациентов с эрозиями клинические симптомы отсутствуют, а у 50% с их наличием патологических изменений при эндоскопии не обнаруживается [5–7, 9, 39]. Таким образом, можно сказать, что НПВС-гастропатия в значительной степени феномен эндоскопический.
Эндоскопические характеристики НПВС-гастропатии включают субэпителиальные геморрагии, эрозии, язвы, кровотечение. Эрозивно-язвенные изменения имеют некоторые особенности: более часто локализуются в антральном отделе желудка, эндоскопическая картина более соответствует «острой язве» ? определяется небольшая неглубокая язва, которая может заживать без рубца.
Особенностью НПВС-гастропатии является ее склонность к частому рецидивированию при продолжении приема ЛС. Так, частота рецидивов НПВС-индуцированных язв и множественных эрозий у пациентов в контрольных группах исследований SCUR, ASTRONAUT, OMNIUM и исследования профилактического эффекта мизопростола и лансопразола за период наблюдения 3–6 месяцев составила от 16 до 49% [19, 20, 23, 36].
Клинический диагноз у пациента с НПВС-гастропатией формируется на основании формы патологии (диспепсия, гастрит, эрозии, язва, осложнения) с указанием на связь с НПВС/АСК на основе МКБ-10.
МКБ-10. Лекарственные средства, медикаменты и биологические вещества, являющиеся причиной неблагоприятных реакций при терапевтическом применении (Y40 ?Y45)
Y45 Анальгезирующие, жаропонижающие и противовоспалительные средства.
Y45.1 Салицилаты.
Y45.2 Производные пропионовой кислоты.
Y45.3 Другие нестероидные противовоспалительные средства [NSAID].
Y45.5 Противоревматические средства.
Y45.8 Другие анальгезирующие, жаропонижающие и противовоспалительные средства.
Y45.9 Анальгезирующие, жаропонижающие и противовоспалительные средства неуточненные.
Факторы риска
Факторы риска НПВС-гастропатии в достаточной степени изучены и должны быть выявлены и учтены при назначении НПВС (табл. 2) [1–10, 15, 16, 20, 22–24, 29, 32].
Таблица 2. Факторы риска НПВП-гастропатии
|
Факторы риска
|
Комментарии
|
|
Гастродуоденальные язвы и их осложнения
в анамнезе
|
–
|
|
Пожилой и старческий возраст
|
После 65 лет сравнительный риск (RR) = 2,5
· У лиц старших возрастных групп, особенно женщин, НПВС-гастропатия чаще
по сравнению с молодыми протекает латентно и сопровождается угрожающими жизни осложнениями (кровотечение, перфорация).
· Пациенты пожилого возраста наиболее подвержены НПВС-гастропатии, что связано
с многими факторами: низкая регенераторная способность слизистой оболочки,
снижение скорости элиминации НПВС, прием больших относительно массы тела доз НПВС, частый одновременный прием других лекарств
|
|
Инфекция H. pylori
|
H. pylori и НПВС являются независимыми факторами риска язвообразования
|
|
Сочетанное применение нескольких НПВП
|
–
|
|
Сочетание НПВП с АСК или другими
антиагрегантами
|
–
|
|
Большие дозы НПВП
|
–
|
|
Алкоголь
|
RR = 4,2 при приеме низких доз аспирина
|
|
Курение
|
–
|
|
Использование антагонистов кальциевых каналов, антикоагулянтов и кортикостероидов
|
RR = 2,5 при дополнительном приеме антагонистов кальциевых каналов
RR = 1,8–14,6 при дополнительном приеме ГКС
|
|
Сопутствующие тяжелые заболевания (сердечная недостаточность, артериальная гипертензия,
заболевания печени и почек)
|
–
|
Наибольшая выраженность изменений слизистой и вероятность развития эрозий и язв возникает в первый месяц применения НПВС. Микроскопические изменения СО заметны уже через несколько минут после приема НПВС, однако в любой период применения ЛС риск осложнений не исчезает. Заживление повреждений может наступить при продолжении приема НПВС («желудочная адаптация»), особенно у молодых лиц; процесс заживления происходит быстрее, если больной воздерживается от приема НПВС 1–2 дня в неделю.
Не установлено четкой связи между способом введения ЛС и частотой побочных явлений: свечи, инъекции, таблетки с кишечнорастворимым покрытием, быстрорастворимые, ретардные и забуференные формы, pro-drugs (набуметон, сулиндак) позволяют избежать только симптоматических побочных эффектов, но существенно не снижают риск эрозивно-язвенных изменений и не оказывают заметного влияния на скорость их заживления на фоне противоязвенной терапии. Есть наблюдения, что НПВС в виде ректальных свечей вызывали даже больше осложнений, чем при пероральном приеме (возможно, это объясняется применением ректальных свечей в группе больных с более высокой степенью риска) [5–10, 23, 24].
Проведенные в Республике Беларусь исследования факторов риска НПВС-гастропатии показали, что прогностическое значение в развитии НПВС-гастропатии могут также иметь морфологические характеристики СО желудка (атрофия фундального отдела желудка) [3].
Следует подчеркнуть определенную опасность низких доз АСК, которая часто недооценивается (табл. 3).
Таблица 3. Риск низких доз ацетилсалициловой кислоты
|
Доза АСК
|
Риск гастропатии
|
|
75 мг
|
× 2,3
|
|
150 мг
|
× 3,2
|
|
375 мг
|
× 3,9
|
|
1200 мг
|
× 6,4
|
Забуференные и кишечнорастворимые формы АСК не уменьшают риск верхних гастроинтестинальных кровотечений. Анализ риска первичных кардиоваскулярных событий у 1000 пациентов с 5% риском их развития в течение 5 лет показал, что прием аспирина позволяет предотвратить от 6 до 20 случаев инфаркта миокарда, но сопровождается развитием от 2 до 6 случаев гастроинтестинальных кровотечений и от 0 до 2 случаев геморрагического инсульта [18].
У каждого пациента необходимо на основе выявления и оценки отельных конкретных факторов риска оценивать индивидуальный риск НПВС-гастропатии (табл. 4).
Таблица 4. Стратификация факторов риска НПВС-гастропатии [32]
|
Низкий риск
|
Повышенный риск (средний)
|
Высокий риск
|
|
Нет
факторов риска
|
≥ 1 фактора риска: неосложненная язва
в анамнезе (эрадикация H. pylori
проведена); высокие дозы НПВП или их сочетанный прием (включая безрецептурные препараты); сердечно-сосудистые заболевания; сопутствующее использование низких доз аспирина или антиагрегантов, ГКС
или варфарина; преклонный возраст
|
В анамнезе осложненная язва (кровотечение, стеноз или прободение)
|
Стратификация факторов риска постоянно совершенствуется, и в 2009 г. Комитетом Американского колледжа гастроэнтерологов (ACG) было опубликовано руководство по предупреждению развития НПВС-зависимых язвенных осложнений, в котором несколько изменены факторы желудочно-кишечного риска и подход к их стратификации (табл. 5) [23].
Таблица 5. Рекомендации ACG стратификации факторов риска НПВС-гастропатии
|
Высокий риск
|
Умеренный риск
|
Низкий риск
|
|
1. В анамнезе осложненная язва (особенно недавно)
|
1. Возраст >65 лет
|
Нет факторов риска
|
|
2. Множественные (≥2) факторы риска
|
2. Высокая доза НПВС
|
|
3. В анамнезе неосложненная язва
|
|
4. Сопутствующий прием АСК (включая малые дозы), кортикостероидов или антикоагулянтов
|
Учет кардиоваскулярного риска
при обеспечении снижения
желудочно-кишечного риска НПВП
В последние годы областью внимания специалистов стала оценка и учет риска развития кардиоваскулярных осложнений при использовании НПВС. Установлено, что прием НПВС в некоторых случаях может сопровождаться дестабилизацией артериальной гипертензии, прогрессированием сердечной недостаточности и повышением риска развития кардиоваскулярных катастроф. Это связано с эффектами НПВС в отношении синтеза простациклина в эндотелии сосудов и продукции тромбоксана тромбоцитами с дисбалансом в системе «тромбоксан – простациклин» в пользу тромбоксана, угнетением синтеза простагландинов в почках со снижением почечного кровотока и клубочковой фильтрации и другими изменениями, которые могут привести к развитию перечисленных выше осложнений. Из НПВС эти эффекты оказались наименее выраженными у напроксена [4, 22, 38].
С учетом полученных данных при назначении НПВС приходится оценивать не только риски поражения ЖКТ, но и сердечно-сосудистые, при наличии которых НПВС комбинируются с АСК (табл. 6) [23, 24].
Таблица 6. Рекомендации АCG по предупреждению НПВС-зависимых язвенных осложнений с учетом сердечно-сосудистого риска
|
Сердечно-
сосудистый риск
|
Желудочно-кишечный риск
|
|
Низкий
|
Умеренный
|
Высокий
|
|
Обычный
|
НПВС (наименее ульцерогенный в минимальной дозе) без назначения других препаратов
|
НПВС + ИПП
|
Если возможно – альтернативная терапия или селективные ЦОГ-2 + ИПП
|
|
Высокий
|
Напроксен + ИПП
|
Напроксен + ИПП
|
Избегать НПВС, включая селективные ЦОГ-2.
Альтернативная терапия
|
Таким образом, для пациентов с высоким сердечно-сосудистым риском при необходимости приема НПВС препаратом выбора из всей группы НПВС (кроме АСК) является напроксен, так как именно это ЛС не усиливает сердечно-сосудистые риски.
Лечение и профилактика
НПВС-гастропатии
Акценты в лечении НПВС в настоящее время смещены в сторону безопасности, сформированы представления о профилактике и лечении НПВС-гастропатии.
Общие правила профилактики НПВС-гастропатии [5, 9, 12, 24].
· Хотя местные гастроинтестинальные эффекты НПВС не являются ведущими, рекомендуется принимать НПВС после еды, запивая таблетку достаточным количеством воды. При возможности стоит пропускать в приеме 1–2 дня в неделю (для регенерации СО). Необходимо помнить о том, что альтернативные пути введения НПВС (парентеральный, ректальный) не предохраняют от возможности развития побочных эффектов со стороны ЖКТ.
· В случаях, когда имеет значение преимущественно анальгезирующий, а не противовоспалительный эффект, целесообразно использовать парацетамол, который не угнетает ЦОГ в слизистой оболочке ЖКТ и потому не вызывает гастропатию.
· Лечение следует начинать с менее токсичных НПВС с коротким периодом полувыведения, к которым относятся ацеклофенак, ибупрофен, диклофенак, или селективных ингибиторов ЦОГ-2. Постепенно увеличивать дозу НПВС, оценивать эффект в течение 5–10 дней и лишь при его отсутствии использовать более токсичный НПВС.
· При обнаружении признаков НПВС-гастропатии необходимо обсудить вопрос о возможности отказа от приема НПВС. При невозможности прервать лечение – максимально уменьшить среднюю суточную дозу НПВС. В ряде случаев по показаниям – назначение низких доз глюкокортикостероидов.
· При наличии факторов риска и развитии диспепсических симптомов – проведение эндоскопического исследования.
· При наличии факторов риска – профилактически принимать ЛС, обладающие гастропротективным действием.
· Монотерапия невсасывающимися антацидами, сукральфатом, висмута дицитратом, хотя и может быть использована для купирования симптомов диспепсии, неэффективна в отношении как лечения, так и профилактики НПВС-гастропатии.
Лекарственные средства для лечения и профилактики НПВС-гастропатии.
Требования к идеальному ЛС для предотвращения вызванного НПВС повреждения ЖКТ были сформулированы еще в 1986 г. [35]:
1) такое ЛС не должно ухудшать течение основного заболевания;
2) не должно мешать противовоспалительному и болеутоляющему эффекту НПВС;
3) должно быть эффективным в борьбе с побочными эффектами, вызванными длительным приемом НПВС;
4) должно купировать кровотечение, вызванное НПВС.
Безопасность и эффективность различных гастропротективных мероприятий была оценена в обзоре 40 рандомизированных контролируемых исследований [20, 21, 23, 24, 29, 36]. Полученные результаты свидетельствуют, что для профилактики НПВС-гастропатий доказанной следует считать эффективность двойной дозы блокаторов Н2-гистаминорецепторов, стандартной дозы ингибиторов протонной помпы (ИПП) и мизопростола.
Современные рекомендации по лечению и профилактике НПВС-гастропатий рекомендуют использовать ИПП в качестве основной группы ЛС ввиду наибольшего количества доказательств их пользы при низком риске побочных эффектов [9, 12, 23, 24, 29]. ИПП, подавляя кислото-образование в желудке, не оказывают прямого цитопротективного действия, однако низкий уровень внутрижелудочного рН ухудшает течение НПВС-индуцированных повреждений гастродуоденальной СО.
Ингибирование образования активных форм кислорода путем использования антиоксидантов может представлять альтернативный перспективный путь профилактики НПВС-индуцированных эрозивно-язвенных повреждений ЖКТ.
Гастроцитопротекция
Теоретически с учетом эффектов НПВС для профилактики НПВС-индуцированных повреждений слизистой ЖКТ наиболее обосновано применение простагландинов, которые патогенетически являются средствами заместительной терапии. Профилактический эффект мизопростола, синтетического аналога простагландина Е1, был изучен у 8843 больных ревматоидным артритом, получавших НПВС в рандомизированном двойном слепом плацебо-контролированном 6-месячном исследовании MUCOSA. При применении мизопростола частота осложнений со стороны ЖКТ снизилась на 26,6%, а частота серьезных подтвержденных осложнений – на 40%. Наибольший эффект был отмечен у пациентов группы высокого желудочно-кишечного риска (у пациентов с язвой в анамнезе риск кровотечения снизился на 50%) [24].Однако применение мизопростола характеризовалось частым развитием побочных эффектов: желудочной диспепсии, диареи, системной вазодилатации (гипотонии, головных болей, гиперемии лица), что особенно существенно для лиц пожилого возраста. В исследованиях подтверждена высокая частота побочных эффектов при применении мизопростола – 25% против 10–12% при применении ИПП [35]. Кроме того, число отрицательных моментов его использования дополняют необходимость частого приема (4 раза в день) и высокая стоимость. Поэтому в настоящее время мизопростол, несмотря на патогенетическое обоснование, редко используется в клинической практике для профилактики и лечения НПВС-гастропатии.
В 2016 г. на рынке Республики Беларусь для профилактики НПВС-гастропатии зарегистрировано новое лекарственное средство под торговым названием Стиллен® (StillenTM) с цитопротективным действием, сопоставимым по эффективности с мизопростолом.
Стиллен® представляет собой густой экстракт из листьев азиатской полыни (Artemisiae Herba) и является природным цитопротектором. Лечебные эффекты Стиллена® обеспечивает компонент азиатской полыни Эупатилин, который через ингибирование образования активных форм кислорода и модуляцию киназы р38 и NF-KB-зависимых путей подавляет образование и высвобождение медиаторов воспаления в гастродуоденальной СО, активирует продукцию простагландинов и слизи [26, 27, 31, 35].
Основные эффекты Стиллена® были открыты в начале 90-х годов прошлого века, после чего были проведены доклинические и клинические исследования (28 исследований различного уровня), подтвердившие его клиническую эффективность в отношении эрозивно-язвенных поражений ЖКТ и безопасность приема для человека.
Доказано, что Стиллен® оказывает лечебный эффект при эрозивно-язвенных поражениях СО желудка и двенадцатиперстной кишки посредством увеличения продукции простагландина Е2 и слизи, также обладает антиоксидантным и противовоспалительным действием. При этом Стиллен® не влияет на противовоспалительный или анальгетический эффект НПВС (исследования проведены с напроксеном), секрецию желудочного сока и не стимулирует выработку соляной кислоты [35].
В 2002 г. препарат был выпущен на рынок Южной Кореи и сразу получил признание на азиатском рынке, где используется для лечения и профилактики не только НПВС-гастропатии, но и острых и хронических гастритов, в том числе Н. рylori-ассоциированных.
В Республике Беларусь Стиллен® зарегистрирован как средство для профилактики НПВС-индуцированных эрозивно-язвенных поражений желудка и 12-перстной кишки.
Подтверждают клиническую эффективность Стиллена® результаты нескольких рандомизированных контролируемых исследований. Первое было проведено для сравнения эффективности и безопасности применения Стиллена® и мизопростола. Мизопростол доказанно эффективно устраняет повреждения ЖКТ при приеме НПВС и поэтому был выбран в качестве препарата сравнения. В исследовании приняли участие 266 здоровых добровольцев, выбранных методом случайного отбора, которые принимали Стиллен® 60 мг 3 раза в день или мизопростол по 200 мкг 3 раза в день в течение 4 недель с эндоскопической оценкой состояния слизистой оболочки желудка и двенадцатиперстной кишки до и в конце лечения. На 4-й неделе суммарные уровни гастропротекции при применении Стиллена® и мизопростола составили 85,1% и 95,2% соответственно с отсутствием достоверной разницы между группами, что указывало на не меньшую эффективность Стиллена® по сравнению с мизопростолом. Частота побочных явлений в группе Стиллена® была достоверно ниже, чем в группе мизопростола, и составила 56,4% (95% ДИ, 48,0–64,8%) и 69,2% (95% ДИ, 61,3–77,0%) соответственно (Р=0,031) [27].
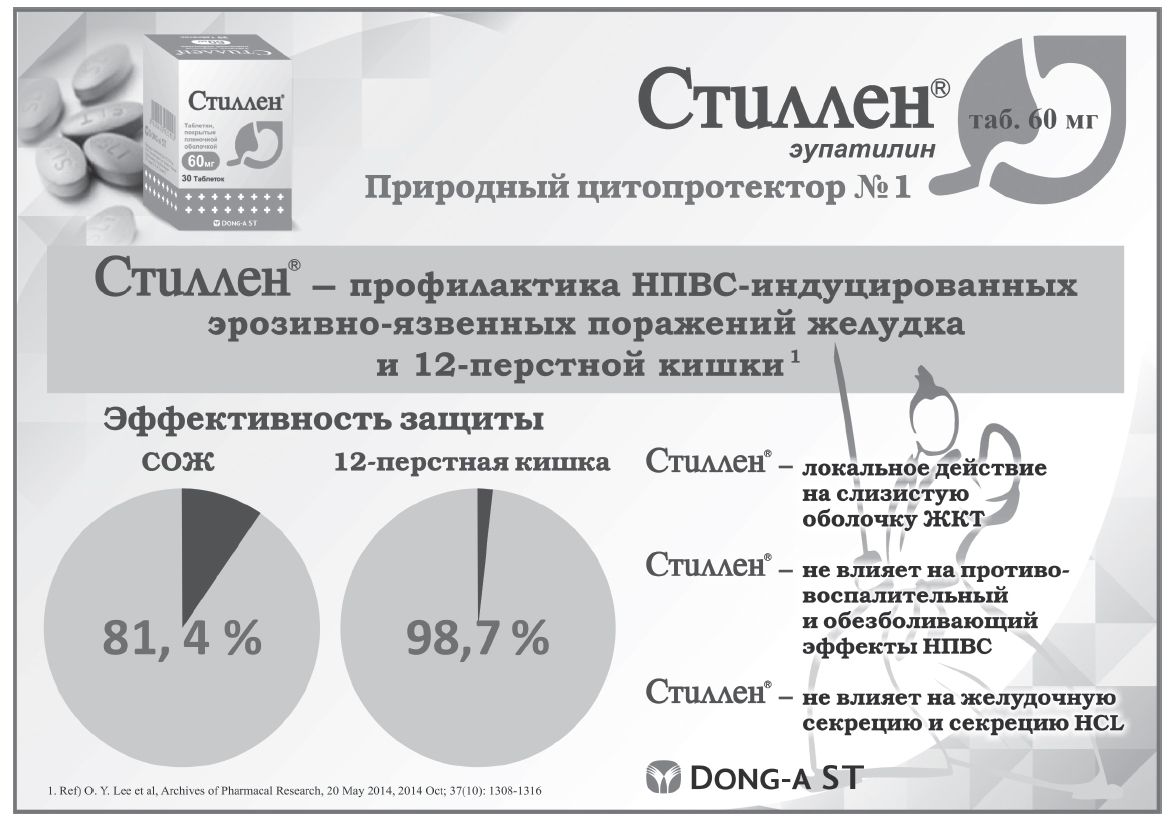
В другом исследовании сравнивалась эффективность и безопасность Стиллена® и мизопростола в снижении НПВС-индуцированных эрозивно-язвенных поражений СО желудка и двенадцатиперстной кишки с участием 520 пациентов с ревматологическими, неврологическими заболеваниями и болевым синдромом другой этиологии, принимавших НПВС дважды в день в течение 4 недель вместе с мизопростолом 200 мкг 3 раза в деньили Стилленом® 60 мг 3раза в день. Показано, что Стиллен® эффективно и надежно предупреждал повреждения СО при 4-недельном приеме НПВС: степень защиты СО желудка в группе Стиллена® была высокой (81,4%) и не ниже, чем в группе мизопростола (89,3%), степень защиты СО двенадцатиперстной кишки и язвообразования в течение 4-недельного лечения НПВС достоверно в группах не различались. Побочные эффекты в группе Стиллена® были достоверно реже, как и в предыдущем исследовании (–0,2±2,8 против 1,2±3,2; р<0,0001) [26]. Стоит отметить, что в этом исследовании пациенты с высоким риском развития НПВС-гастропатии (в анамнезе осложненная язва: кровотечение, стеноз или прободение) были исключены. В таких ситуациях предпочтительным способом профилактики НПВС-индуцированных поражений ЖКТ остается прием селективного ингибитора ЦОГ-2 с ИПП [23, 26]. Настоящее исследование подчеркивает, что выбор Стиллена® более приемлем у пациентов со средним риском осложнений.
Еще одно исследование было проведено для оценки сравнительной эффективности Стиллена® и цетраксата (Cetraxate (NeuerTM) – гастропротектор, разработанный в Японии) при участии 512 добровольцев с эрозивными поражениями слизистой оболочки желудка. Показано, что Стиллен® был более эффективен для лечения эрозий СО желудка, чем цетраксат, и продемонстрировал высокую степень безопасности в отношении побочных явлений [33].
Изучение эффектов Стиллена® продолжается. В экспериментальных исследованиях было показано, что Стиллен® восстанавливает СО пищевода при рефлюкс-эзофагите, предупреждает появление и способствует заживлению эрозий и язв СО, индуцированных приемом этанола [26, 28, 35]. Есть данные о лечебных эффектах Стиллена® со стороны других органов и систем. Так, показано противовоспалительное и цитопротективное действие в отношении поджелудочной железы и печени, получены данные о влиянии Стиллена® на моторику нижних отделов кишечника, согласно которым ЛС оказывает спазмолитический эффект [31], изучаются нефропротективные свойства Стиллена®, получены обнадеживающие результаты [30], что демонстрирует высокий терапевтический потенциал Стиллена®.
Таким образом, анализ имеющихся данных дает основание рассматривать Стиллен® как эффективное лекарственное средство для профилактики НПВС-индуцированных эрозивно-язвенных поражений слизистой оболочки желудка и двенадцатиперстной кишки с благоприятным профилем безопасности. Это расширяет диапазон терапевтических возможностей и предоставляет практическому врачу новый подход и возможность выбора способа профилактики НПВС-гастропатии. Стиллен® в дозе 60 мг 3 раза в день может быть использован для профилактики НПВС-индуцированных эрозивно-язвенных поражений СО желудка и двенадцатиперстной кишки у пациентов с низким и средним риском.
Л И Т Е Р А Т У Р А
1. Биккинина Г.М., Сафуанов А.Р. // Молодой ученый. – 2015. – №7. – С.269–272.
2. Дикарева Е.А., Макаренко Е.В., Пиманов С.И. // Вестник ВГМУ. – 2015. – Т.14, №5. – С.39–45.
3. Дикарева Е.А., Макаренко Е.В., Пиманов С.И. // Вестник ВГМУ. – 2015. – Т.14, №5. – С.46–56.
4. Драпкина О.М., Гацолаева Д.С. // Справочник поликлинич. врача. – 2006. – Т.4, №8. – С.24–31.
5. Каратеев А.Е. // Фарматека. – 2006. – №6. – С.24–29.
6. Каратеев А.Е., Яхно Н.Н., Лазебник Л.Б. и др. Применение нестероидных противовоспалительных препаратов: клинич. рекоменд. – М.: ИМА-Пресс, 2009. – 167 с.
7. Ким В.А. // Эксперим. и клинич. гастроэнтерол. – 2008. – №8. – С.84–91.
8. НасоновЕ.Л. // Consilium Medicum. – 1999. – Т.1, №5. – С.13–18.
9. Ревматология: клинич. рекоменд. / под ред. Е.Л.Насонова. – М.: ГЭОТАР-МЕДИА. – 2011. – 738 с.
10. Яковенко А.В., Григорьев П.Я., Яковенко Э.П. и др. // Эксперим. и клинич. гастроэнтерол. – 2006. – №2. – С.1–4.
11. Adebayo D., Bjarnason I. // Postgrad. Med. J. – 2006. – Vol.82. – P. 186–191.
12. Antman E.M., Bennett J.S., Daugherty A.et al. // Circulation. – 2007. – Vol.115. – Р.1634–1642.
13. Bjanason I., Hayllar J., Macpherson A.J., Russell S. // Gastroenterology. – 1993. – Vol.104. – P.1832–1847.
14. Chan F.K., Graham D.Y. // Aliment. Pharmacol. Ther. – 2004. – Vol.19. – P.1051–1061.
15. Fries J., Kristen N., Bennet M. et al. // Arthritis Rheum. – 2004. – Vol.50. – Р.2433–40.
16. Fries J.F., Williams C.A., Bloch D.A. et al. // Am. J. Med. – 1991. – Vol.91. – Р.212–22.
17. Goldstein J.L. // Digestion. – 2004. – Vol.69 (Suppl.1). – P.25–33.
18. Hayden M., Pignone M., Phillips C., Mulrow C. // Ann. Intern. Med. – 2002. – Vol.136. – P.161–172.
19. Hawkey C.J., Karrascch J.A., Szczepanski L. et al. // N. Engl. J. Med. – 1998. – Vol.338. – Р.727–734.
20. Henry D., Lim L.L., Garcia Rodriguez L.A. et al. // BMJ. – 1996. – Vol.312, N7046. – P.1563–1566.
21. Lain L. // Rew. Gastroenterol. Dis. – 2004. – Vol.4. – Р.33–41.
22. Lanas A., Garcia-Rodriquez L.A., Arroyo M.T. et al. // Gut. – 2006. – Vol.55. – P.1731–1738.
23. Lanza F., Chan F.К., Quigley E.et al. // Am. J. Gastroenterol. – 2009. – Vol.104. – Р.728–738.
24. Lanza F. // Am. J. Gastroenterol. – 1998. – Vol.93. – Р.2037–2046.
25. Laporte J. // Drug Safety. – 2004. – Vol.27. – P.411–420.
26. Lee Oh Young, Kang Dae-Hwan, Lee Dong Ho et al. // Arch. Pharm. Res. – 2014. – Vol.37. – Р.1308–1316.
27. Lee Kang Nyeong, Lee Oh Young, Choi Myung-Gyu et al. //J. Korean Med. Sci. – 2011. – Vol.26. – Р.1074–1080.
28. Lim Jae Chun, Park Sun Young, Nam Yoonjin et al. // Korean J. Physiol. Pharmacol. – 2012– Vol.16. – Р.313–320.
29. Moore R.A., Sheena Derry, Lee S. Simon et al. // Pain Pract. – 2014. – Vol.14. – Р.378–395.
30. Park Jun Yeon, Dahae Lee, Hyuk-Jai Jang et al. // Evid. Based Complement. Alternat. Med. – 2015. – Vol.15. – Р.483–498.
31. Seung-Bum Ryoo, Heung-Kwon Oh, Sung A.Yu. et al. // Korean J. Physiol. Pharmacol. – 2014. – Vol.18. – Р.383–390.
32. Scheiman J.M., Cryer B., Asaka M. et al. // Aliment. Pharmacol. Ther. Symp. Ser. – 2005. – Vol.1. – P. 26–32.
33. Sang Yong Seol, Myung Hwan Kim, Jong Sun Ryu et al. // World J. Gastroenterol. – 2004. – Vol.10. – Р.2379–2382.
34. Shebl F.M., Hsing A.W., Yikyung Park et al. // PLoS One. – 2014. – Vol.9. – Р.114–116.
35. Tae Oh Young, Byong Kweon Ryu, Jun I. Ko et al. // Arch. Pharm. Res. – 1997. – Vol.20, N5. – P.414–419.
36. Yeomans N.D., Tulassay Z., Juhasz L. et al. // N. Engl. J. Med. – 1998. – Vol.338, N11. – P.719–726.
37. http://www.fda.gov/cder/drug/infopage/cox2/
38. http://www.provisor.com.ua/archive/2007/N11/me-chanism.php
Медицинские новости. – 2016. – №3. – С. 34-39.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.