Tolibov D.S., Rakhimbaeva G.S.
Tashkent Medical Academy, Uzbekistan
Validation of the new diagnostic complex of biomarkers
for differential diagnosis of Alzheimer’s disease
Резюме. Для проведения исследований было отобрано 147 больных с верифицированными диагнозами: болезнь Альцгеймера (n=17), ранняя форма болезни Альцгеймера (n=30) и хроническая ишемия мозга с сосудистой деменций (n=100). Установлена высокая диагностическая эффективность комплекса биомаркеров, включающего определение дегидроэпиандростерона сульфата (ДГЕА-с), аполипопротеина Е4 (Аро-Е4) и бета-амилоида белка (Аb1-42), для ранней диагностики и выявления групп риска при болезни Альцгеймера. Увеличение уровня маркеров Аb1-42 и Аро-Е4 у больных в пределах 25–50% и снижение ДГЕА-с на 40–50% свидетельствовало о развитии у пациента хронической ишемии мозга; увеличение концентрации маркеров Аb1-42 и Аро-Е4 у больных в пределах 50–100% и снижение ДГЕА-с более чем в 10 раз позволило установить развитие ранней формы заболевания; при уже развившейся болезни Альцгеймера концентрации маркеров Аb1-42 и Аро-Е4 возрастали в разы и происходило снижение ДГЕА-с более чем в 10 раз.
Ключевые слова: болезнь Альцгеймера, бета-амилоид белок Аb1-42, аполипопротеин Е4, дегидроэпиандростерон сульфат.
Медицинские новости. – 2016. – №4. – С. 63–65.
Summary. For studies were selected 147 patients with verified diagnosis of Alzheimer’s disease (n=17), early form of Alzheimer’s disease (n=30) and chronic ischemia with vascular dementia (n=100). Established the high efficiency of diagnostic complex of biomarkers, including a definition degidroepiandrosteron sulfate (DHEA-S), apolipoprotein E4 (Apo-E4) and the amyloid beta protein (Ab1-42), for the early diagnosis and to identify risk groups of Alzheimer’s disease: increase in markers of Ab1-42 and Apo-E4 at patients within the 25–50% and decreased DHEA-S on 40–50% indicated the development in a patient the chronic cerebral ischemia; increasing the concentration of markers Ab1-42 and Apo-E4 at patients within 50–100% and decrease DHEA-S more than 10 times established the early forms of AD; in developed AD the markers of Ab1-42 and Apo-E4 increased many times and a decrease DHEA-S with more than 10 times.
Keywords: Alzheimer’s disease, beta-amyloid protein Ab1-42, apolipoprotein E4, dehydroepiandrosteron sulfate.
Meditsinskie novosti. – 2016. – N4. – P. 63–65.
Болезнь Альцгеймера (БА) – широко распространенное заболевание во всем мире. По заключению экспертов Всемирной организации здравоохранения, БА является наиболее частой причиной слабоумия в пожилом и старческом возрасте. Глобальная распространенность деменции в мире (с преимущественным удельным весом БА), по данным 2010 г., составляет 35,6 млн лиц и будет практически удваиваться каждые 20 лет – до 65,7 млн в 2030 г. и 115,4 млн в 2050 г. Особенно резкое увеличение ожидается в странах со средним и низким уровнем дохода. Заболеваемость БА увеличивается с возрастом. Так, в группе лиц старше 65 лет количество больных удваивается каждые пять лет. В условиях демографической ситуации с прогнозируемым старением населения во всем мире проблема БА приобретает особую актуальность и социально-экономическую значимость [3].
Ни один известный на сегодняшний день биомаркер при самостоятельном использовании в клинике не может выполнить роль решающего фактора при установлении диагноза БА. Это прежде всего связано с перекрестным определением известных биомаркеров, соотносимых с течением БА, при других патологиях нервной системы. В связи с этим нами была выдвинута гипотеза о комплексном использовании важнейших биомаркеров для ранней диагностики, мониторинга эффективности терапии и выявления групп риска БА. Суть выдвинутой гипотезы состоит в одномоментном определении у больных ряда биомаркеров (дегидроэпиандростерон сульфат (ДГЕА-с), аполипопротеин Е4 (Аро-Е4) и бета-амилоид белок (Аb1-42) и при установлении дискриминационных уровней данных соединений – выработка соответствующего диагноза или отнесение пациента к группе риска развития БА. При создании настоящей гипотезы мы исходили из данных современных исследований, описывающих модель патогенеза БА, которая может быть использована и для потенциальных терапевтических подходов. Выбор биомаркеров, входящих в выбранный нами диагностический комплекс, продиктован участием определенных белков в патогенезе БА, в том числе на ранних бессимптомных стадиях БА.
Цель исследования – апробация нового диагностического комплекса биомаркеров для дифференциальной диагностики болезни Альцгеймера с хронической ишемией мозга и сосудистой деменцией.
Материалы и методы
Для проведения исследований было отобрано 147 больных с верифицированными диагнозами: болезнь Альцгеймера (n=17), ранняя болезнь Альцгеймера (n=30) и хроническая ишемия мозга с сосудистой деменций (n=100).
Исследуемые биомаркеры определяли в сыворотке крови больных. Определение бета-амилоида белка 1-42 (Аb1-42) осуществляли с помощью диагностических наборов для иммуноферментного исследования Humanamyloidbeta 1-42 (Аb1-42) ELISAKit (Eastbiopharm), определение аполипопротеина Е4 осуществляли с помощью наборов HumanApolipoproteinE4 (Apo-E4) ELISA Kit (Eastbiopharm), определение дегидроэпиандростерона сульфата (ДГЕА-с) осуществляли с помощью диагностических наборов ImmunoFA-DGEA-S (Immunotex, Россия).
Результаты и обсуждение
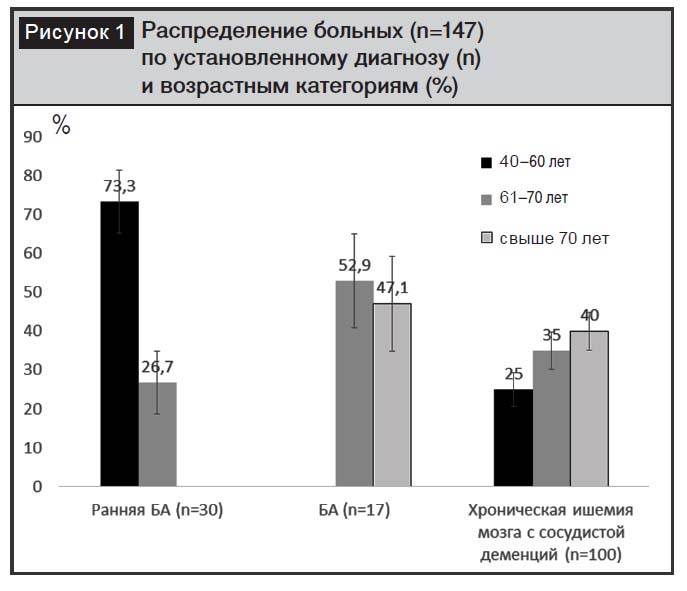
Распределение пациентов по установленному диагнозу и возрастным категориям приведено на рис. 1. Среди обследованных пациентов с БА женщины составили 47,1±12,1%, с ранней БА – 50,0±9,1%, с хронической ишемией мозга – 61,0±4,9%.
Средний возраст больных с БА составил 71,05±1,15 года, с ранней БА – 57,2±0,92, с хронической ишемией мозга – 67,18±1,06 года. Пациентов с БА младше 60 лет не было, распределение больных в возрастных категориях 61–70 лет и старше 70 лет было приблизительно равным. Большинство пациентов с ранней стадией БА (73,3±8,1%) были младше 60 лет (40–60 лет), не наблюдалось больных старше 70 лет. Большинство больных с хронической ишемией мозга были старше 70 лет (40,0±4,9%), однако доля пациентов в возрастных группах 40–60 лет и 61–70 лет также была значительной (25,0±4,3 и 35,0±4,8% соответственно).
Полученные нами результаты соотносятся с уже известными данными по возрастному распределению патологий – предшественников старческой деменции, таких как БА, болезнь Паркинсона, болезнь Гентингтона, прионные болезни, фронтотемпоральная деменция, различные формы амилоидозов [6, 7]. Значительный возраст больных с БА и хронической ишемией мозга объясняется накоплением с возрастом внутриклеточных или экстраклеточных белковых агрегатов, которое отмечается при различных нейродегенеративных заболеваниях, что выделяет их в особый класс заболеваний, получивших название «конформационные болезни». Хотя накоплению токсических белковых продуктов отводится центральная роль в патогенезе этих заболеваний, целый ряд исследований, проведенных в последнее время на различных трансгенных организмах, показывает, что в основе хорошо известных патологических изменений для ряда заболеваний может лежать сложная комбинация доминантных «loss-of-function» и «gain-of-function» эффектов, обозначающих потерю или приобретение новых функций как на уровне отдельных белков и клеточных функций, так и за счет полиморфизма отдельных генов. Именно этими эффектами объясняется значительное «омоложение» контингента пациентов с ранней стадией БА, которое мы наблюдали в наших исследованиях.
Раннее развитие БА также провоцируют наследственные формы данного заболевания. Так, мутации в генах PS1 и PS2, как и в гене АРР, являются аутосомно-доминантными. При этом мутации в PS1 в основном вызывают более тяжелые формы заболевания и в более раннем возрасте. Некоторые мутации в PS1 рассматриваются как причина возникновения симптомов в возрасте 20–30 лет. Описано около 180 мутаций в гене PS1, большинство из которых патогенные [2]. Эти мутации приводят к увеличению соотношения Аb1-42:Аb1-40. Мутаций в гене PS2 описано немногим более 20, не все из них патогенны, и симптомы заболевания, как правило, не манифестируют до 40–50 лет. Хотя семейные формы наблюдаются сравнительно редко при БА, именно на их долю чаще всего приходятся случаи развития болезни в возрасте 40–50 лет. В нашем исследовании значительная доля больных с хронической ишемией мозга и ранней БА в возрасте до 60 лет также может быть объяснена наследственными факторами, которые индуцировали раннее развитие заболевания.
В таблице представлены результаты определения комплекса биомаркеров у больных ранней БА, БА, хронической ишемией мозга и здоровых пациентов.
Таблица. Результаты определения комплекса биомаркеров у обследованных пациентов
|
Группа пациентов
|
Биомаркер
|
|
Аb1-42, пг/мл
|
Аро-Е4, нг/мл
|
ДГЕА-с, мкмоль/л
|
|
Ранняя БА (n=30)
|
393,0±14,30
|
31,1±1,19
|
0,15±0,01
|
|
БА (n=17)
|
615,3±21,88
|
62,4±2,45
|
0,17±0,01
|
|
Хроническая ишемия мозга (n=100)
|
313,6±4,78
|
21,2±0,44
|
1,14±0,09
|
|
Здоровые
|
250,0±3,20
|
15,0±1,10
|
2,6±0,1
|
Наименьшие показатели среди исследованных групп больных при определении дегидроэпиандростерона сульфата (ДГЕА-с), белков Аро-Е4 и Аb1-42 наблюдались в группе с хронической ишемией мозга: уровень Аb1-42 был повышен на 25,4% по сравнению с его содержанием в сыворотке крови здоровых людей (концентрация в норме – 250 пг/мл); уровень Аро-Е4 – на 41,3% (концентрация в норме – 15 нг/мл); уровень ДГЕА-с снижался на 43,8% (концентрация в норме – 2,6 мкмоль/л). У пациентов с ранней БА уровень Аb1-42 был повышен на 57,2% по сравнению с содержанием данного маркера в сыворотке крови здоровых людей, уровень Аро-Е4 – на 107,3%, уровень ДГЕА-с снижался более чем в 17 раз. У пациентов с БА уровень Аb1-42 был повышен в 1,9 раза по сравнению с содержанием в сыворотке крови здоровых людей, уровень Аро-Е4 – в 2,9 раза, а уровень ДГЕА-с снижался более чем в 15 раз.
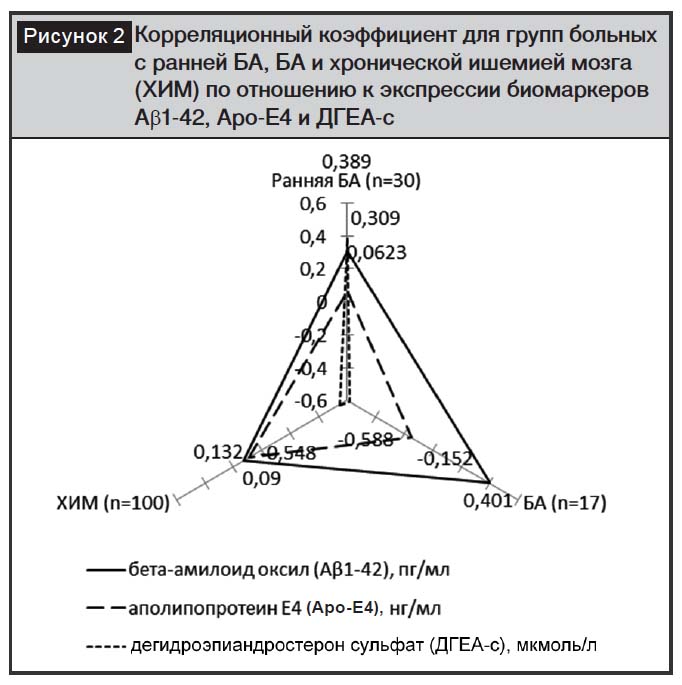
На рис. 2 представлены расчеты корреляционного коэффициента возраста в группах больных с ранней БА, БА и хронической ишемией мозга (ХИМ) по отношению к экспрессии биомаркеров Аb1-42, Аро-Е4 и ДГЕА-с. Наибольшая положительная корреляция наблюдалась в группе больных с ранней БА по отношению ко всем исследованным биомаркерам, то есть омоложение симптоматических проявлений при ранней БА наиболее отражается на содержании в сыворотке крови диагностически значимых белков. Наибольшую корреляционную зависимость возраста больных от экспрессии маркеров мы наблюдали по отношению к концентрации Аb1-42: во всех исследованных группах корреляционный коэффициент варьировал от 0,132 до 0,309.
Образование бета-амилоида происходит путем последовательного формирования димеров, олигомеров и, в финале, – полимеров; способ зависит от концентрации: начальная медленная фаза нуклеации может быть катализирована аполипопротеином Е4, ионами (такими как Fe3+) или гликозаминогликанами, которые, вероятно, индуцируют образование b-волокон. Агрегация амилоида может быть причиной воспалительного ответа, который включается в патологический процесс [4]. Активация микроглии и астроцитов ассоциирована с образованием нейритных бляшек. Это сопровождается увеличением концентрации воспалительных медиаторов, таких как C1q, в каскаде комплемента и цитокинов (фактор некроза опухоли a, интерлейкин 1b, трансформирующий фактор роста b1 и интерлейкин 6) [5].
Токсичность Аb олигомеров по отношению к клеткам в значительной степени происходит за счет оксидативного стресса, нарушения кальциевого гомеостаза, окислительного повреждения ДНК, липидов и белков [1]. Наличие Аb увеличивает оксидативный стресс с образованием внутриклеточных супероксидных радикалов и H2O2. Кумулятивные результаты повреждения включают окисление липидов и белков. Таким образом, токсический эффект Аb в значительной степени зависит от индукции воспалительного ответа и внутриклеточного повреждения и связан с индуцирующими факторами, в частности с концентрациями ДГЕА-с и Аро-Е4.
Таким образом, использованный нами комплекс биомаркеров демонстрирует дифференциацию патологического процесса в зависимости от развития нейродегенеративных процессов. Установлена высокая диагностическая эффективность комплекса биомаркеров, включающего определение в сыворотке крови больных дегидроэпиандростерона сульфата (ДГЕА-с), аполипопротеина Е4 (Аро-Е4) и бета-амилоида белка (Аb1-42), для ранней диагностики, мониторинга эффективности терапии и выявления групп риска при болезни Альцгеймера и хронической ишемии мозга: увеличение уровня маркеров Аb1-42 и Аро-Е4 в сыворотке крови больных в пределах 25–50% и снижение ДГЕА-с на 40–50% свидетельствовало о развитии у пациента хронической ишемии мозга; увеличение концентрации маркеров Аb1-42 и Аро-Е4 в сыворотке крови больных в пределах 50–100% и снижение ДГЕА-с более чем в 10 раз позволило установить развитие ранней формы БА; при уже развившейся БА концентрации маркеров Аb1-42 и Аро-Е4 в сыворотке крови больных возрастали в разы и происходило снижение ДГЕА-с более чем в 10 раз.
Использование предлагаемого нами комплекса биомаркеров в клинической практике, при наличии сопутствующих клинических проявлений, дает возможность с высокой достоверностью верифицировать диагноз ранней формы БА, корректировать терапевтическое воздействие, проводить мониторинг лечения или в случае бессимптомных состояний, с учетом возраста больного и/или наследственной отягощенности, – проводить профилактические мероприятия, отнеся пациента к группе риска развития БА.
Л И Т Е Р А Т У Р А
1. Barage S.H., Sonawane K.D. // Neuropeptides. – 2015. – N52. – P.1–18.
2. Chibnik L.B., Yu L., Eaton M.L. et al. // Ann. Clin. Transl. Neurol. – 2015. – Vol.2, N6. – P.636–647.
3. Cornutiu G. // J. Clin. Med. Res. – 2015. – Vol.7, N9. – P.657–666.
4. Leoni V. // Clin. Chem. Lab. Med. – 2011. – Vol.49, N3. – P.375–383.
5. Lopes Pinheiro M.A., Kooij G., Mizee M.R. et al. // Biochim. Biophys. Acta. – 2015. –S0925–4439(15)00318–X (Epub. ahead of print).
6. Mitchell S.L. // N. Engl. J. Med. –2015. – Vol.372, N26. – P.2533–2540.
7. Thompson A.J., Barrow C.J. // Curr. Med. Chem. –2002. – N9. – P.1751–1762.
Медицинские новости. – 2016. – №1. – С. 63-65.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.