Shepelkevich A.P.
Belarusian State Medical University, Minsk
Current approaches to prevention and treatment of vitamin D deficiency
Резюме. В статье представлены обзорные данные о роли витамина D в регуляции метаболических процессов в норме и патологии. Отражены современные подходы к лабораторной оценке содержания витамина D (кальцидиола – 25(ОН)D), данные эпидемиологических исследований по оценке распространенности дефицита витамина D; возможностям профилактики и лечения с использованием комплексного подхода, включающего особенности образа жизни, и применением современных лекарственных средств.
Ключевые слова: дефицит витамина D, остеопороз, переломы, профилактика, лечение.
Медицинские новости. – 2016. – №6. – С. 11–17.
Summary. The paper presents the survey findings on the role of the vitamin in the regulation of metabolic processes in health and disease. It reflects modern approaches to laboratory assessment of vitamin D (calcidiol – 25(OH)D), epidemiological studies assessing the prevalence of vitamin D deficiency; possibilities of prevention and treatment using an integrated approach, including lifestyle factors and the use of modern medicines.
Keywords: vitamin D deficiency, osteoporosis, fractures, prevention, treatment
Meditsinskie novosti. – 2016. – N6. – P. 11–17.
Демографические изменения, произошедшие в последние десятилетия ХХ века и продолжающиеся в ХХI, среди которых заметное увеличение продолжительности жизни населения и количества лиц в популяции старше 50 лет, во многом обусловили повышение внимания медицинской общественности к проблеме неинфекционных заболеваний, являющихся основной причиной смертности в современном мире. В структуре неинфекционных заболеваний остеопороз (ОП) занимает одну из ведущих позиций наряду с кардиоваскулярной патологией, онкологическими заболеваниями и сахарным диабетом. Медико-социальная значимость ОП обусловлена его тяжелыми осложнениями – переломами костей скелета вследствие минимальной травмы [1–7].
Эксперты ВОЗ подчеркивают необходимость разработки глобальной стратегии по контролю над заболеваемостью ОП, выделяя в качестве основных три направления: ранняя диагностика, профилактика и лечение [3].
Стратегия профилактики разрабатывалась с учетом особенностей формирования костно-мышечной системы, ее эволюции в течение жизни, патофизиологии ОП и заключается в формировании прочного скелета, предотвращении или замедлении потерь костной массы и предупреждении переломов [1–7].
Основной целью профилактики и лечения ОП является снижение частоты переломов. Результаты крупных проспективных исследований свидетельствуют о том, что наиболее эффективными мероприятиями в этом плане являются: назначение препаратов кальция и витамина D, ношение бедренных протекторов пожилыми па-циентам с высоким риском падений, а также применение фармакотерапии ОП [3, 4].
В настоящее время помимо постмено-паузального и сенильного ОП роль дефицита витамина Dубедительно доказана в формировании большого количества заболеваний и синдромов (табл. 1) [8–11].
Таблица 1. Состояния и заболевания, обусловленные дефицитом и избытком витамина D
|
Недостаточное поступление витамина D с пищей и недостаточное пребывание на солнце
|
Гипервитаминоз:
– передозировка препаратов витамина D или его активных метаболитов;
– повышенное потребление продуктов, содержащих витамин D;
– чрезмерное пребывание на солнце
|
|
Группы риска:
– дети, рожденные зимой;
– пожилые люди с ограничением подвижности возможности пребывать на солнце;
– лица с ограничением возможности пребывать на солнце по социально-экономическим и религиозным причинам;
– темнокожие женщины и дети, иммигрировавшие в страны с малым количеством солнечных дней в течение года
|
|
Снижение кишечной абсорбции жиров и жирорастворимых витаминов:
– глютеновая энтеропатия;
– хронический панкреатит;
– цирроз;
– препараты, нарушающие всасывание жиров
|
|
Усиление катаболизма либо снижение синтеза витамина D или его метаболитов:
– прием препаратов, метаболизирующихся системой Р450 цитохрома: барбитураты, противосудорожные средства, рифампицин;
– повышение активности метаболизма на фоне низкого потребление кальция и/или гиперпаратиреоза;
– снижение уровней кальцидиола (25-ОН-D) и других метаболитов:
– нефротический синдром;
– перитонеальный и программный гемодиализ;
– снижение ПГТ (гипопаратиреоз);
– прием глюкокортикостероидов;
– сахарный диабет;
– гипогонадизм
|
Наиболее известен и хорошо изучен дефицит поступления витамина Dс пищей или недостаточной инсоляцией в детском возрасте, обусловливающий развитие рахита, у взрослых – остеомаляции.
Одним из проявлений синдрома маль-абсорбции является нарушение всасывания витамина Dи кальция. При различных формах гипопаратиреоза имеет место гипокальциемия, гипофосфатемия и снижение содержания витамина D [8, 9].
Историческая справка. История открытия витамина Dберет начало в 1913 г. в США (штат Висконсин), где сотрудниками лаборатории по изучению сельскохозяйственной продукции во главе с Е. McCollumв рыбьем жире был обнаружен «жирорастворимый фактор роста», способный оказывать лечебный эффект при рахите, повышать минерализацию костей, который впоследствии был назван витамином D. Однако выделить витамин D1 (эргостерин) стало возможным лишь в 1924 г., когда А. Гесс и М. Вейншток синтезировали его из растительных масел путем воздействия ультрафиолетовых лучей длиной волны 280–310 нм [9].
Одновременно был установлен факт образования витамина D под влиянием ультрафиолетового облучения и выявлено его положительное влияние на метаболизм кальция и фосфора. Признанием научных заслуг ученых стало присуждение A. Windaus в 1928 г. Нобелевской премии по химии за цикл работ по выделению витамина D и установлению строения растительных стеролов [9].
В последующем проводились углубленные исследования в области изучения биологических свойств и метаболизма витамина D, роли его дефицита в развитии метаболических остеопатий (различные формы ОП, остеомаляции, остеодистрофии при хронической почечной недостаточности). Кроме того, большое количество экспериментальных и клинических данных свидетельствует о роли дефицита витамина D, как важного фактора риска в развитии артериальной гипертензии, ряда онкологических заболеваний (рак молочной и предстательной железы, толстого кишечника), аутоиммунной патологии (сахарный диабет, рассеянный склероз, ревматоидный артрит), ряда инфекций (туберкулез) [8, 9].
В результате научных исследований была обоснована необходимость применения препаратов нативного витамина D и содержащих его продуктов в профилактической медицине. Интерес к проблеме дефицита витамина D интенсифицировал работы в области изучения его метаболизма, рецепции, генетических аспектов при различных заболеваниях. Полученные данные позволили создать на основе природного витамина D, его аналогов и производных новые лекарственные средства с заданными фармакологическими свойствами [8–11].
Метаболизм, роль витамина D в регуляции метаболических процессов. В последние десятилетия сформировано представление о витамине D как о стероидном прегормоне, превращающемся в организме в активный метаболит – D-гормон, обладающий наряду с мощным регулирующим влиянием на обмен кальция рядом других важных биологических функций. Под термином «витамин D» объединяют группу сходных по химическому строению двух форм витамина: D2 и D3 [9].
Витамин D2 (эргокальциферол) поступает в организм с пищей и содержится преимущественно в продуктах растительного происхождения (злаковые растения, рыбий жир, сливочное масло, молоко, яичный желток), он относится к числу жирорастворимых витаминов и в организме метаболизируется с образованием производных, обладающих сходным с витамином D3 действием. Его применяют в медицине для профилактики и лечения рахита у детей, для уменьшения гипокальциемии при хронической почечной недостаточности и лечения тяжелых форм мальабсорбции кальция [6, 8, 9, 11, 12].
Содержание витамина D3 (колекальциферола) меньше зависит от поступления извне, преимущественно он образуется из находящегося в коже предшественника (провитамина D3) под влиянием солнечного света. Когда все тело подвергается воздействию солнечных лучей в дозе, вызывающей легкую эритему, содержание витамина D3 в крови увеличивается так же, как после приема внутрь 10 000 МЕ витамина D3 [6, 8, 9, 11, 12]. При этом концентрация 25(ОН)D может достигать 150 нг/мл без какого-либо отрицательного влияния на обмен кальция. Необходимость профилактического назначения витамина D3 возникает только тогда, когда отмечается недостаточная инсоляция. С возрастом способность кожи производить витамин D3 уменьшается, после 65 лет она может снижаться более, чем в 4 раза [10, 11]. Для проявления физиологической активности витамин D3 в организме подвергается превращениям в печени и почках в активный метаболит кальцитриол – 25(ОН)-витамин D (рис. 1) [9, 11].
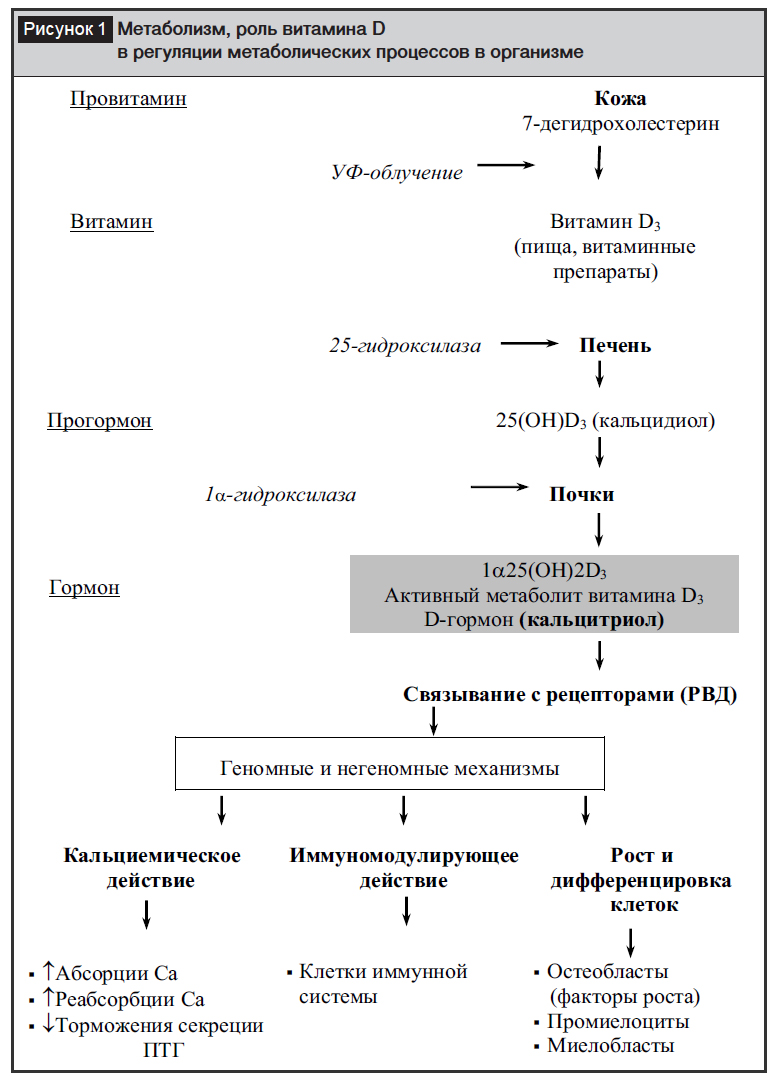
Кальцитриол – биологически активная форма витамина D, образующаяся при гидроксилировании в печени, а затем в почках витаминов D2 и D3. Регуляция синтеза кальцитриола в почках является непосредственной функцией циркулирующего в крови паратиреоидного гормона (ПТГ), на концентрацию которого, в свою очередь, по механизму обратной связи оказывают влияние как уровень самого активного метаболита витамина D3, так и концентрация ионизированного кальция в плазме крови [8, 9]. В кишечнике витамин D3 осуществляет регуляцию активного всасывания поступающего с пищей кальция – процесса, почти полностью зависящего от действия этого гормона, а в почках он наряду с другими кальциемическими гормонами регулирует реабсорбцию кальция в петле Генле. Кальцитриол стимулирует активность остеобластов и способствует минерализации костного матрикса. Вместе с тем он увеличивает активность и число остеокластов, что стимулирует костную резорбцию [9]. Однако имеются также данные, свидетельствующие о том, что под его влиянием происходит подавление имеющейся повышенной костной резорбции. Активные метаболиты витамина D3 способствуют формированию микромозолей в костях и заживлению микропереломов, что повышает прочность и плотность костной ткани [12].
Регуляция фосфорно-кальциевого обмена. 1?, 25-дигидроксивитамин D3 (1?,25(OH)2D3, кальцитриол, D-гормон) вместе с ПТГ и кальцитонином традиционно объединяют в группу кальцийрегулирующих гормонов, важной функцией которых является поддержание в плазме крови физиологического уровня кальция за счет как прямого, так и опосредованного влияния на органы-мишени [1–7].
Каждый из кальцийтропных гормонов влияет также на абсорбцию и метаболизм фосфора. Кроме поддержания кальциевого гомеостаза 1?, 25-дигидроксивитамин D3 воздействует также на ряд систем организма, таких как иммунная и кроветворная, регулирует рост и дифференцировку клеток (рис. 2) [7].
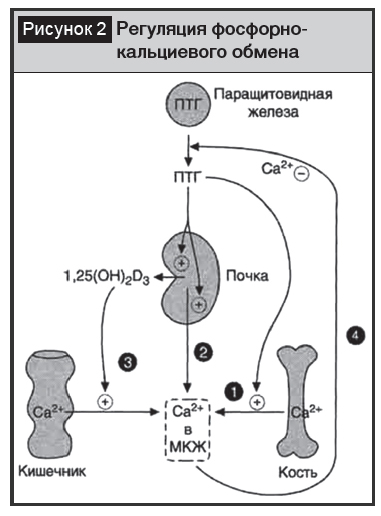
Регуляция кальциевого гомеостаза – одна из основных и наиболее подробно изученных функций, реализация которой осуществляется главным образом на уровне трех органов мишеней: кишечника, почек и скелетной системы.
Регуляция процессов костного ремоделирования с участием витамина D осуществляется как непосредственно, так и опосредованно. Остеокласты (ОК) не имеют рецепторов к витамину D (PBД) и поэтому являются объектом его непрямых эффектов. Действие кальцитриола проявляется на стадии остеокластогенеза и заключается, с одной стороны, в стимуляции созревания и дифференцировки клеток-предшественников ОК и их превращения в моноциты, а с другой – в регуляции дифференцировки ОК за счет механизмов, в которых участвуют другие клетки костной ткани – остеобласты (ОБ), имеющие PBД [6–9]. Опосредованное действие D-гормона осуществляется за счет активации местных пептидных биологически активных факторов, образующихся в костной ткани (табл. 2) [8, 9, 12–14].
Таблица 2. Локализация рецепторов к витамину D
|
Система/Орган/Клетка
|
Функции
|
Патология
|
|
Кишечник
|
Абсорбция минералов (кальция)
|
Мальабсорбция кальция
|
|
ОБ
|
Костеобразование и минерализация
|
ОП, остеомаляция, остеодистрофия
|
|
ОК
|
Костная резорбция
|
|
|
Кожа
|
Дифференцировка кераноцитов
Рост и восстановление волос
|
Аллопеция
|
|
Репродуктивная система
|
Овариальная/тестикулярная функция
|
Бесплодие
|
|
Иммунная система
|
Иммунологический контроль
|
Аутоиммунные заболевания
|
|
Ренин-ангиотензинная система
|
Контроль объема крови
|
Артериальная гипертензия
|
|
Мозг
|
Ментальная функция
|
Шизофрения
|
Действие D-гормона проявляется во влиянии на дифференцировку и пролиферацию клеток скелетных мышц, а также и в реализации кальцийзависимых механизмов, являющихся одними из центральных в процессе мышечного сокращения [8, 9,].
Фермент 25(OH)D – 1?-гидроксилаза и PВД были обнаружены в клетках иммунной системы. Эффекты 1?,25(OH)2D3 и его аналогов в отношении иммунной системы обычно проявляются при использовании в относительно высоких фармакологических дозах (концентрациях) и реализуются главным образом на уровне клеток – лимфоцитов и моноцитов/ макрофагов [8, 9, 13, 14].
Основы лабораторной диагностики состояния витамин D-системы. Частота встречаемости дефицита витамина D. Согласно Клиническим рекомендациям Российской ассоциации эндокринологов 2015 г. широкий популяционный скрининг дефицита витамина D не рекомендуется. Он показан только пациентам, имеющим факторы риска его развития (табл. 3) [15].
Таблица 3. Группы лиц с высоким риском тяжелого дефицита витамина D, которым показан биохимический скрининг
|
Заболевания костей
|
Рахит
Остеомаляция
ОП
Гиперпаратиреоз
|
|
Пожилые лица старше 60 лет
|
Падение в анамнезе
Низкоэнергетический перелом в анамнезе
|
|
Ожирение
|
Взрослые с ИМТ 30 кг/м2 и более
Пациенты после бариатрических операций
|
|
Беременные и кормящие женщины, имеющие факторы риска или не желающие принимать профилактически препараты витамина D
Дети и взрослые с темным оттенком кожи
|
Беременные женщины с темной кожей, ожирением, гестационным сахарным диабетом, минимальным нахождением на солнце, беременные женщины, не получающие добавки витамина D
Жители или выходцы из Индии, Азии, Африки
|
|
Хроническая болезнь почек
|
СКФ <60 мл/мин
|
|
Печеночная недостаточность
|
Стадии II–IV
|
|
Синдромы мальабсорбции
|
Воспалительные заболевания кишечника (болезнь Крона, неспецифический язвенный колит, целиакия)
Бариатрические операции
Радиационный энтерит
Муковисцедоз
|
|
Гранулематозные заболевания
|
Саркоидоз
Туберкулез
Гистоплазмоз
Бериллиоз
Коккцидиомикоз
|
|
Прием лекарственных препаратов
|
Глюкокортикоиды
Антиретровирусные препараты
Противогрибковые препараты
Холестирамин
Противоэпилептические препараты
|
Для оценки состояния витамина D используется определение в сыворотки крови наиболее стабильной формы витамина D – 25(ОН)D (кальцидиола).
Сформулированы количественные критерии дефицита витамина D3 [10, 15]:
– адекватные уровни витамина D определяются при концентрации 25(ОН)D в сыворотке крови более 30 нг/мл (75 нмоль/л);
– недостаточность витамина D – при уровнях 20–30 нг/мл (50–75 нмоль/л);
– дефицит витамина D – при уровне менее 20 нг/мл (50 нмоль/л).
Рекомендуемые целевые значения 25(ОН)D при коррекции дефицита витамина D составляют 30–60 нг/мл (75–150 нмоль/л) [10, 15].
Оценка статуса витамина D должна проводиться путем определения уровней 25(ОН)D в сыворотке крови надежным методом. Рекомендуется проверка надежности используемого в клинической практике метода определения 25(ОН)D относительно международных стандартов (DEQAS, NIST). При определении уровней в динамике рекомендуется использование одного и того же метода. Определение 25(OH)D после применения препаратов нативного витамина D в лечебных дозах рекомендуется проводить как минимум через три дня с момента последнего приема препарата [15].
Измерение уровня 1,25(ОН)2D в сыворотке крови для оценки статуса витамина D не рекомендуется, но применимо с одновременным определением 25(ОН)D при некоторых заболеваниях, связанных с врожденными и приобретенными нарушениями метаболизма витамина D и фосфатов, экстраренальной активностью фермента 1α-гидроксилазы [15].
Результаты эпидемиологических исследований, изучавших состояние витамина D среди 7564 постменопаузальных женщин, свидетельствуют о высокой частоте сниженных показателей 25(ОН) D (рис. 3) [16].
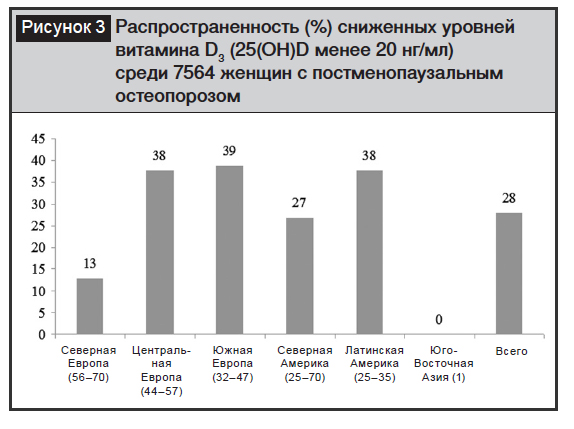
Снижение продукции витамина D ведет также к нарушению нормального функционирования нервно-мышечного аппарата, так как проведение импульсов с двигательных нервов на поперечнополосатую мускулатуру и сократимость последней является кальцийзависимыми процессами. Исходя из этого, дефицит витамина D вносит свою лепту в нарушение двигательной активности пожилых пациентов, координацию движений и как следствие – повышает риск падений [6, 8, 9, 12, 17].
Клинические проявления дефицита витамина D в зависимости от степени снижения уровня кальцидиола представлены в табл. 4 [15].
Таблица 4. Интерпретация концентраций 25(OH)D, принимаемая Российской aссоциацией эндокринологов
|
Классификация
|
Уровни 25(ОН) D в крови нг/мл (нмоль/л)
|
Клинические проявления
|
|
Выраженный дефицит витамина D
|
<10 нг/мл (<25 нмоль/л)
|
Повышенный риск рахита, остеомаляции, вторичного гиперпаратиреоза, миопатии, падений и переломов
|
|
Дефицит витамина D
|
<20 нг/мл
(<50 нмоль/л)
|
Повышенный риск потери костной ткани, вторичного гиперпаратиреоза, падений и переломов
|
|
Недостаточность
витамина D
|
≥20 и <30 нг/мл (≥50 и <75 нмоль/л)
|
Низкий риск потери костной ткани и вторичного гиперпаратиреоза, нейтральный эффект на падение и переломы
|
|
Адекватные уровни витамина D
|
≥30 нг/мл ≥75 нмоль/л
|
Оптимальное подавление ПТГ
и потери костной ткани, снижение падения
и переломов на 20%
|
|
Уровни витамина D
с возможным
проявлением токсичности
|
>150 нг/мл
(>375 нмоль/л)
|
Гиперкальциемия, гиперкальциурия,
нефрокальциноз, кальцифилаксия
|
Синтез витамина D осуществляется под влиянием ультрафиолетовых лучей и зависит от кожной пигментации, широты расположения региона (рис. 4), продолжительности дня, времени года, погодных условий и площади кожного покрова, не прикрытого одеждой [8, 9, 11, 15].
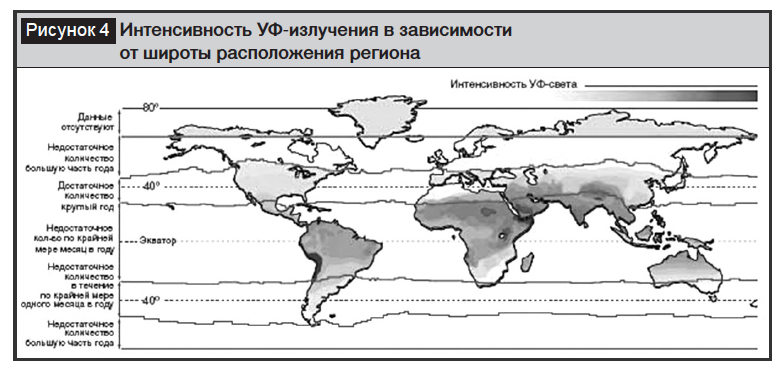
Зимой в странах, расположенных на северных широтах (выше 40°), большая часть ультрафиолетового излучения поглощается атмосферой, и в период с октября по март синтез витамина D практически отсутствует.
Другой важный источник витамина D – пищевые продукты. Особенно богата им жирная рыба, такая как сельдь, скумбрия, лосось, в то время как молочные продукты, яйца содержат небольшое количество витамина (табл. 5) [15].
Таблица 5. Содержание витамина D в продуктах питания
|
Естественные пищевые источники
|
Витамин D (D2 или D3)
|
|
Дикий лосось
|
600–1000 МЕ на 100 г
|
|
Лосось, выращенный на ферме
|
100–250 МЕ на 100 г
|
|
Сельдь
|
294–1676 МЕ на 100 г
|
|
Сом
|
500 МЕ на 100 г
|
|
Консервированные сардины
|
300–600 МЕ на 100 г
|
|
Консервированная макрель
|
250 МЕ на 100 г
|
|
Консервированный тунец
|
236 МЕ на 100 г
|
|
Рыбий жир
|
400–1000 МЕ на 1 ст. ложку
|
|
Грибы, облученные УФ
|
446 МЕ на 100 г
|
|
Грибы, не облученные УФ
|
10–100 МЕ на 100 г
|
|
Сливочное масло
|
52 МЕ на 100 г
|
|
Молоко
|
2 МЕ на 100 г
|
|
Молоко, обогащенное витамином D
|
80–100 МЕ на стакан
|
|
Сметана
|
50 МЕ на 100 г
|
Дефицит витамина D чрезвычайно распространен среди пожилых людей, живущих севернее 40° широты. В частности, данные исследования в Уральском регионе подтвердили наличие дефицита витамина D различной степени выраженности у 180 обследованных пациентов (средний возраст – 69 лет) в период конец зимы – начало весны. Среди обследованных наиболее тяжелый дефицит выявлен в группе пациентов, перенесших перелом шейки бедра, также отмечено достоверное снижение уровня витамина D по мере увеличения возраста [1, 4].
Таблица 6. Нативные препараты витамина D, применяемые в Республике Беларусь
|
Название ЛC витамина D
|
Форма выпуска
|
Содержание препарата
в одной капле
(таблетке)
|
|
Девит (колекальциферол)
LAMYRA (Великобритания)
|
Таблетки, покрытые пленочной оболочкой 750 000 МЕ в упаковке 15 таблеток 1 таблетка 50 000 МЕ
|
50 000 МЕ витамина D3 (эквивалентно 1,25 мг холекальциферола) 500 мг
|
|
Аквадетрим
(колекальциферол)
Medana Pharma TERPOL
Group J.S.Co (Польша)
|
Водный раствор 150 000 МЕ во флаконе-капельнице 10 мл (15 000 МЕ (375 мкг) в 1мл)
|
Около 500 МЕ
|
|
Вигантол (колекальциферол)
MerK KGaA (Германия)
|
Масляный раствор 200 000 МЕ во флаконе-капельнице 10 мл (20 000 МЕ (500 мкг) в 1 мл)
|
Около 500 МЕ
|
В Республике Беларусь результаты современных исследований по определению содержания витамина D свидетельствуют об аналогичных тенденциях. Так, в работе Э.В. Руденко и соавт. [18] в период с августа по сентябрь 2011 г. проведена оценка содержания кальцидиола у 148 женщин в возрасте 49–80 лет (средний возраст – 62,00±8,74 года), проживающих в различных городах Беларуси: Минске (центральная часть страны), Могилеве (юго-восточный регион) и Бресте (южный регион). В обследованной выборке у 75% постменопаузальных женщин выявлен дефицит витамина D (содержание 25(ОН)D в крови менее 20 нг/мл), при этом были получены статистически значимые различия этого показателя в зависимости от региона проживания: наиболее высокие его значения были зафиксированы у лиц, проживающих в юго-восточном регионе страны, содержание кальцидиола в крови было достоверно выше у лиц, регулярно принимавших препараты витамина D в течение 6 месяцев перед включением в исследование в дозе не менее 400 МЕ в сутки. Также были выявлены статистически значимые различия антропометрических данных и показателей минеральной плотности кости (МПК) у постменопаузальных женщин, перенесших и не переносивших низкоэнергетические переломы [18].
Нами проведено исследование содержания витамина D у постменопаузальных женщин с СД 2-го типа (n=76) и соответствующей группе контроля (n=53). Отмечена достоверно (?2=31,5; р<0,001 и F=0,05; р=0,01) более высокая частота встречаемости сниженных показателей витамина D (менее 50 нмоль/л и менее 75 нмоль/л) у пациенток с СД 2-го типа в сравнении с женщинами без диабета (рис. 5) [19].
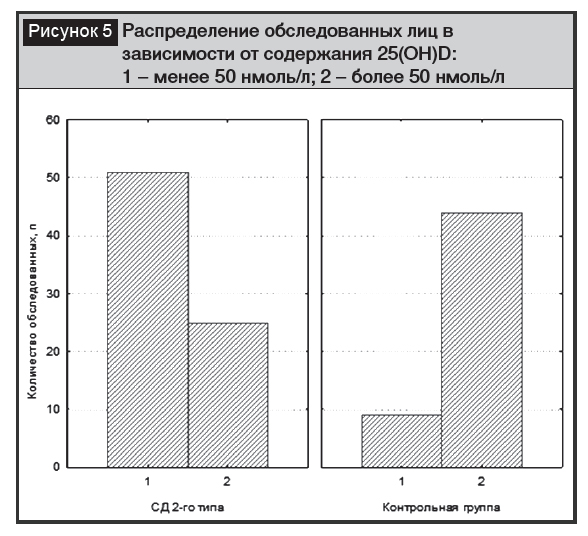
Полученные данные согласуются с результатами других исследований, изучавших содержание витамина D у пациен-тов с СД 2-го типа [20–22], которые в целом отмечают наличие сниженных уровней витамина при СД 2-го типа.
Подходы к профилактике дефицита витамина D. Современные возможности профилактики и лечения состояний и заболеваний, ассоциированных с дефицитом витамина D стандартизированы экспертами Российской Ассоциации Эндокринологов (РАЭ) в 2015 г. в рамках клинических рекомендаций «Дефицит витамина D у взрослых: диагностика, лечение и профилактика» [15].
Рекомендуемыми препаратами для профилактики дефицита витамина D являются колекальциферол (D3) и эргокальциферол (D2).
Рекомендация потребления не менее 600 МЕ витамина D для общей популяции практически здоровых лиц 18–50 лет была определена Институтом медицины США, одобрена большинством клинических рекомендаций, в том числе РАЭ, поскольку позволяет достичь уровней 25(OH)D более 20 нг/мл у 97% индивидуумов данной возрастной группы. Менее четко определена доза витамина D для достижения большинством лиц концентрации более 30 нг/мл, для чего может потребоваться прием 1500–2000 МЕ в сутки [15, 23].
Лицам старше 50 лет для профилактики дефицита рекомендуется получать не менее 800–1000 МЕ витамина D в сутки.
Беременным и кормящим женщинам рекомендуется получать не менее 800–1200 МЕ витамина D в сутки.
Для поддержания уровня 25(ОН) D более 30 нг/мл может потребоваться потребление не менее 1500–2000 МЕ витамина D в сутки
При заболеваниях/состояниях, сопровождающихся нарушением всасывания/метаболизма витамина D (см. табл. 3), рекомендуется прием витамина D в дозах, в 2–3 раза превышающих суточную потребность для данной возрастной группы.
Без медицинского наблюдения и контроля 25(ОН)D в крови не рекомендуется назначение доз витамина D более 10 000 МЕ в сутки на длительный период (более 6 месяцев) [15].
Подходы к лечению установленного дефицита витамина D. Рекомендуемым препаратом для лечения дефицита витамина D является колекальциферол (D3). Предпочтением отдается форме D3, поскольку она обладает сравнительно большей эффективностью в достижении и сохранении целевых значений 25(OH)D в сыворотке крови [15].
В Республике Беларусь в 2016 г. расширено количество лекарственных средств колекальциферола (табл. 6) [15], официальную регистрацию получили таблетки с высоким содержанием витамина D (50 000 МЕ), которые широко применяются за рубежом.
Лечение дефицита витамина D (уровень 25(ОН)D в сыворотке крови менее 20 нг/мл у взрослых рекомендуется начинать с суммарной насыщающей дозы колекальциферола 400 000 МЕ с использованием одной из предлагаемых схем, с дальнейшим переходом на поддерживающие дозы (табл. 7) [15].
Таблица 7. Схемы лечения дефицита и недостаточности витамина D
|
|
|
Доза
колекальциферола
|
Примеры схем лечения
|
|
|
Коррекция дефицита витамина D (при уровне 25(ОН)D менее 20 нг/мл)
|
|
1
|
|
50 000 МЕ еженедельно в течение 8 недель внутрь
|
Вигантол: 100 капель в неделю или по 50 капель 2 раза в неделю
Аквадетрим: 100 капель в неделю или по 50 капель 2 раза
в неделю
Девит: 1 таблетка 1 раз в неделю независимо от приема пищи
|
|
2
|
|
200 000 МЕ еженедельно в течение 8 недель внутрь
|
Вигантол: 10 мл (1 флакон) внутрь 1 раз в месяц – 2 месяца Девит: 4 таблетки внутрь 1 раз в месяц – 2 месяца
|
|
3
|
|
150 000 МЕ ежемесячно в течение 3 месяцев внутрь
|
Аквадетрим: 10 мл (1 флакон) внутрь 1 раз в месяц – 3 месяца
Девит: 3 таблетки 1 раз в месяц – 3 месяца
|
|
4
|
|
7000 МЕ в день в течение 8 недель внутрь
|
Вигантол: 14 капель внутрь в день – 8 недель
Аквадетрим: 14 капель внутрь – 8 недель
Девит: 1 таблетка 1 раз в 2 недели – 8 недель
|
|
|
Коррекция недостатка витамина D (при уровне 25(ОН)D 20–29 нг/мл)
|
|
1
|
|
50 000 МЕ еженедельно в течение 4 недель внутрь
|
Вигантол: 100 капель в недель или по 50 капель 2 раза в неделю
Аквадетрим: 100 капель в недель или по 50 капель 2 раза в неделю
Девит: 1 таблетка 1 раз в неделю независимо от приема пищи
|
|
2
|
|
200 000 МЕ
однократно внутрь
|
Вигантол: 10мл (1 флакон) внутрь
Девит: 4 таблетки внутрь
|
|
3
|
|
150 000 МЕ однократно внутрь
|
Аквадетрим: 10 мл (1 флакон) внутрь
Девит: 3 таблетки внутрь однократно
|
|
4
|
|
7000 МЕ в день в течение 4 недель внутрь
|
Вигантол: 14 капель внутрь в день – 4 недели
Аквадетрим: 14 капель внутрь – 4 недели
Девит: 1 таблетка 1 раз в 2 недели – 4 недели
|
|
|
Поддержание уровней витамина D более 30 нг/мл
|
|
1
|
|
1000–2000 МЕ
ежедневно внутрь
|
Вигантол, Аквадентрим: 2–4 капли в сутки
Девит: 1 таблетка 1 раз в 2–3 недели
|
|
2
|
|
6000–14 000 МЕ однократно
в неделю внутрь
|
Вигантол, Аквадентрим: 15–30 капель в неделю
Девит: 1 таблетка 1 раз в 2–3 недели
|
Коррекция недостаточности витамина D (уровень 25(ОН)D в сыворотке крови 20–29 нг/мл) у пациентов из групп риска костной патологии рекомендуется с использованием половинной суммарной насыщающей дозы колекальциферола равной 200 000 МЕ с дальнейшим переходом на поддерживающие дозы согласно табл. 7 [15].
Учитывая данные экспериментальных и клинических исследований, опыт применения боллюсных доз витамина D, важно подчеркнуть эффективность и безопасность их применения в рутинной практике. Интоксикация витамином D – одно из редчайших состояний и является причиной приема очень высоких доз в течение длительного времени. Как правило, интоксикация витамином D не развивается при содержании кальцидиола в сыворотке крови менее 200 нг/мл. В тоже время следует отметить, что клинико-лабораторными проявлениями интоксикации являются гиперкальциемия, гиперфосфатемия, подавление ПТГ, что ассоциировано с развитием нефрокальциноза и кальцификации мягких тканей, в особенности кровеносных сосудов [8, 9, 23].
Затраты на лечение нативными препаратами витамина D и риск передозировки при применении рекомендуемых доз признаются минимальными и экономически эффективными как при лечении заболеваний скелета, так и для потенциальной возможности профилактики внекостной патологии, связанной с дефицитом витамина D [15, 23].
В заключение следует подчеркнуть необходимость более широкого применения витамина D в клинической практике с учетом высокой распространенности различной степени дефицита витамина D и его доказанной роли в развитии широкого спектра заболеваний.
Л И Т Е Р А Т У Р А
1. Руководство по остеопорозу / Л.И. Алексеева [и др.]; под общ. ред. Л.И. Беневоленской. – М., 2003. – 524 с.
2. Руденко Э.В. Остеопороз. Диагностика, лечение и профилактика / Э.В. Руденко. – Минск, 2001. – 153 с.
3. Kanis J.A. Оn behalf of the World Health Organization Scientific Group (2007). Assessment of osteoporosis at the primary health care level. Technical Report. World Health Organization Collaborating Center for Metabolic Bone Diseases, University of Sheffield, UK. – Printed by the University of Sheffield, 2007. – 287 p.
4. Клинические рекомендации. Остеопороз. Диагностика, профилактика и лечение / Л.И. Беневоленская [и др.]; под общ. ред. Л.И. Беневоленской, О.М. Лесняк. – М., 2005. – 176 с.
5. Холодова Е.А. Эндокринные остеопатии: особенности патогенеза, диагностики и лечения. Практич. рук-во для врачей / Е.А. Холодова, А.П. Шепелькевич, З.В. Забаровская. – Минск, 2006. – 88 с.
6. Шепелькевич А.П. Монография / А.П. Шепелькевич. – 2013. – №2. – С.98–101.
7. Риггз Б.Л. Остеопороз. Этиология, диагностика, лечение / Б.Л. Риггз, III Л.Дж. Мелтон / Пер с анг. – М. – СПб., 2000. – 560 с.
8. Дамбахер М.А. Остеопороз и активные метаболиты витамина D: Мысли, которые приходят в голову / М.А. Дамбахер, Е. Шахт. – М., 1994 – 140 c.
9. Шварц Г.Я. Витамин D и D-гормон / Г.Я. Шварц. – М., 2005. – 152 с.
10. Dawson-Hughes B. et al. // Osteoporos. Int. – 2010. – N21. – P.1151–1154.
11. Holick M.F. et al. // J. Clin. Endocrinol. Metab. – 2011. – N96 (Suppl. 7). – P.1911–1930.
12. Zitterman A. // Br. J. Nutr. – 2003. – N89. – P.552–572.
13. Mohr S.B. et al. // Diabetologia. – 2008. – N51. – P.1391–1398.
14. Vitamin D and adult bone health in Australia and New Zealand: a position statement. Working Group of the Australian and New Zealand Bone and Mineral Society, Endocrine Society of Australia and Osteoporosis Australia – M.J.A. – 2005. – Vol.6, N182 – P.281–285.
15. Клинические рекомендации. Дефицит витамина D у взрослых: диагностика, лечение и профилактика. Российская ассоциация эндокринологов, 2015 г. // http://specialist.endocrincentr.ru. – Дата доступа: 15.05.2016.
16. Lips P. et al. // J. Clin. Endocrinol. Metab. – 2001. – Vol.86, N3 – P.1212–1221.
17. Flicker L. et al. // J. Am. Geriatr. Soc. – 2003. – N51. – P.1533–1538.
18. РуденкоЭ.В., РомановГ.Н., СамоховецО.Ю., СердюченкоН.С., РуденкоЕ.В. // Боль. Суставы. Позвоночник. – 2012. – №3 // http://www.mif-ua.com. – Дата доступа: 10.05.2016.
19. Шепелькевич А.П. // Военная медицина. – 2013. – №3. – С.106–112.
20. Chagas C.E.A. et al. // Nutrients. – 2012. – №4. – P.52–67.
21. Re Yu J. et al. // Chonnam. Med. J. – 2012. – №48. – Р.108–115.
22. Kim Y.J. et al. // www. J-STAGE as advance publication. – Дата доступа: 15.05.2016.
23. Wacker M., Holick M.F. // Dermatoendocrinol. – 2013. – №1. – P.51–108.
Медицинские новости. – 2016. – №6. – С. 11-17.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.