Khalimova Kh.M., Rakhmatullaeva G.K., Babaev A.T., Karimov H.Y.
Tashkent Medical Academy, Uzbekistan
Clinical and neurological and molecular genetic features of migraine with
and without abnormalities of cerebral vessels
Резюме. Мигрень может развиться на фоне аномалий сосудов головного мозга. При этом у пациентов, кроме характерных для мигрени признаков, наблюдаются симптомы, характерные для неспецифической дисплазии соединительной ткани (нДСТ), а также мутации в генах металлопротеиназ ММР3, ММР9, гена васкулоэндотелиального фактора роста А (VEGF -A), гена коллагена Col 4a1, отвечающего за патологию коллагена в базальной мембране. Была выявлена высокая встречаемость незамкнутости Виллизиева круга, а также патологических деформаций в ВСА. Клиника мигрени характеризовалась наличием признаков нДСТ, выраженной неврологической симптоматикой и наличием мутаций в генах ММР3, ММР9, VEGF G-634C, Col 4a1 с повышением риска сосудистых аномалий у пациентов с мигренью.
Ключевые слова: мигрень, аномалии сосудов головного мозга, неспецифическая дисплазия соединительной ткани, гены ММР3, ММР9, VEGF G-634C, Col 4a1.
Медицинские новости. – 2016. – №6. – С. 82–84.
Summary. Migraine may develop on the background of the anomalies of cerebral vessels. Thus, in patients, other than typical migraine symptoms observed symptoms characteristic nonspecific dysplasia, connective tissue, as well as mutations in genes metalloproteinase MMP3, MMP9 gene vaskuloendotelialnogo growth VEGF-A, gene collagen Col 4a1, responsible for the pathology of collagen in basal membrane. It was found a high incidence of no closed circle of Willis as well as pathological deformations in the BCA. Clinic migraine characterized by the presence of signs NDCTD, severe neurological symptoms and the presence of mutations in the genes MMR3, MMR9, VEGF G-634C, Col 4a1 with an increased risk of vascular abnormalities in patients with migraine.
Keywords: migraine, abnormalities of the brain vessels, non-specific connective tissue dysplasia, gene MMR3, MMR9, VEGF G-634C, Col 4a1.
Meditsinskie novosti. – 2016. – N6. – P. 82–84.
Мигрень – это первичная эпизодическая форма головной боли, проявляющаяся интенсивными, чаще односторонними приступообразными головными болями, а также неврологическими, желудочно-кишечными, вегетативными нарушениями. Учитывая продолжительность от 4 до 72 часов, мигрень стоит на 7-м месте среди 10 болезней, приводящих к дезадаптации в момент приступов головной боли. Актуальность проблемы обусловлена не только широким распространением заболевания, но и резким ограничением качества жизни пациентов, а также с нанесением огромного социального и экономического урона семьям больных и обществу в целом [1, 5, 6].
Несмотря на то, что существует несколько теорий, объясняющих развитие данного заболевания, этиопатогенез заболевания не получил объяснения. В последнее время в качестве этиопатогенетических механизмов мигрени рассматривают прецеребральные ангиодисплазии и патологические деформации сосудов головного мозга. Важная роль в развитии прецеребральных ангио-дисплазий и патологических деформаций сосудов головного мозга принадлежит наследственным факторам [2].
Целью исследования было изучение клинико-неврологических и молекулярно-генетических особенностей мигрени с аномалиями сосудов головного мозга. Обследованы 198 больных с мигренью с аномалиями сосудов головного мозга и без них. Все больные получали амбулаторное либо стационарное лечение в Республиканской клинической больнице №1.
Материалы и методы
Под нашим наблюдением находились 52 (26,3%) пациента (49 женщин и 3 мужчины) с мигренью без аномалий сосудов головного мозга (1-я группа) и 146 (73,7%) пациентов (102 женщины и 44 мужчины) с мигренью на фоне аномалии сосудов головного мозга (2-я группа). Возраст обследованных варьировал от 16 до 55 лет. Диагноз устанавливали на основании клинико-неврологических, нейровизуали-зационных исследований: КТ головного мозга с ангиографией или МРТ головного мозга с ангиорежимом, дуплексное сканирование брахиоцефальных артерий (ДС БЦА). Молекулярно-генетическое исследование полиморфизмов генов ММР3, ММР9, VEGF G-634C и Col 4a1.
Геномную ДНК из образцов периферической крови (Vacutainer Becton Dickinson International с ЭДТА) выделяли с использованием наборов «QIAamp DNA BloodMiniKit» (Qiagen, Германия) в соответствии с инструкцией. Концентрация и чистота ДНК оценивались на спектрофотометре NanoDrop 2000 «ThermoScientific» (США). Амплификацию проводили с помощью термоциклера GeneAmp PCR-system 2720 (Applied Biosystems, США) с использованием коммерческого набора фирмы ООО НПФ «Литех» (Москва, Россия) согласно инструкции производителя.
Результаты и обсуждение
У больных с мигренью аномалии были представлены прецеребральными ангиодисплазиями и патологическими извитостями. Среди прецеребральных ангиодисплазий чаще всего встречается незамкнутость Виллизиева круга – 66,4%, что коррелирует с данными литературы [3, 4]. Гипоплазия ПА – в 17,1%, реже гипоплазия ВСА – в 13%, у 5,5% пациентов обнаружена задняя трифуркация, то есть отхождение задней мозговой артерии от ВСА, а не от основной, при этом одноименная задняя соединительная артерия редуцировалась. Интересно отметить, что у 1 больной была обнаружена фенестрация ПА, при которой левая ПА удваивалась на протяжении 4,8 см и далее снова соединялась. Среди патологических деформаций чаще встречались деформации ВСА – 58,9%, чем ПА – 21,2%. Сочетанные деформации имели место в 32,2% случаев.
Клинико-неврологическая симптоматика зависит от типа аномалий сосудов головного мозга. Так, в 1-й группе больных мы не наблюдали признаков неспецифической дисплазии соединительной ткани, во 2-й группе пациентов данные признаки достигали 87,9%. Также у больных 2-й группы отмечалась высокая частота транзиторной ишемической атаки – 75,3%, дроп-атак – 15,2%, кохлеовестибулярных нарушений – 42,5% и двигательных нарушений (рис. 1).
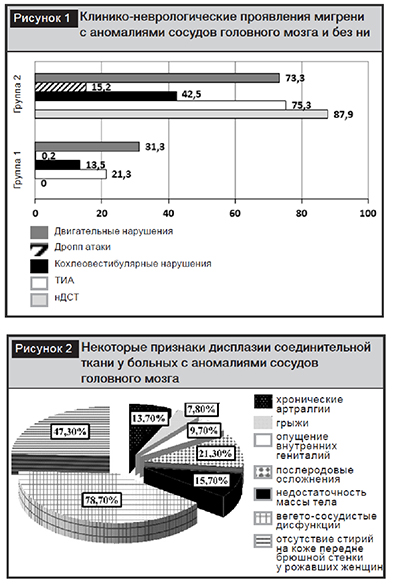
К признакам нДСТ относились хронические артралгии – 13,7%, грыжи – 7,8%, опущение гениталий – 9,7%, недостаточность массы тела – 15,7%, вегето-сосудистые дисфункции – 78,7%, отсутствие стрий на коже переднебрюшной стенки у женщин, имевших в анамнезе роды, – 47,3% (рис. 2).
Мы проанализировали частоту распределения генотипов полиморфизма генов ММР3, ММР9, VEGF G-634C, Col 4a1. Молекулярно-генетический анализ частоты распределения генотипов полиморфизма гена VEGF G-634C, показал, что гетерозиготный генотип С/G больше встречался у больных во 2-й группе – 51,1% (в 1-й группе – 2,4%). Как видно, у больных 2-й группы ?2=24,2; р<0,05; OR=3,8; 95% CI 2,20–6,58, данный генотип почти в 4 раза повышает риск развития аномалий сосудов головного мозга. Мутационный генотип G/G в 11,9% случаев наблюдали у пациентов 2-й группы, в 1-й группе он не встречался, при этом у больных 2-й группы ?2=10,4; р=0,001; OR=5,7; 95% CI 1,762–18,46, что свидетельствовало о повышении риска развития с аномалий почти в 6 раза при наличии данного генотипа, а сочетание генотипов C/G +G/G повышало риск сосудистых аномалий 5,4 раза у пациентов 2-й группы ?2=39,3; р<0,05; OR=5,4; 95% CI 3,146–9,445.
Анализ выявленного полиморфизма гена ММР3 показал, гетерозиготный генотип 6а/5а, чаще встречался у больных 2-й группы – 41,3% (в 1-й группе – 19,5%). Как видно, у пациентов 2-й группы ?2=20,0; р<0,05; OR=3,6; 95% CI 2,02–6,46, данный генотип почти в 4 раза повышает риск развития патологических деформаций сосудов головного мозга. Мутационный гомозиготный генотип 5а/5аG в 14,1% случаев наблюдали у пациентов 2-й группы, в 1-й группе он имел место в 7,3%, при этом у больных 2-й группы ?2=2,9; р=0,1; OR=2,0; 95% CI 0,891–4,54, что свидетельствовало о повышении риска в 2 раза при наличии данного генотипа, а сочетание генотипов 6a/5a+5a/5a повышало риск в 4 раза у пациентов 2-й группы ?2=26,4; р<0,05; OR=4,0; 95% CI 2,31–6,82. При этом анализ частоты распределения генотипов полиморфизма гена ММР9 показал наименьшую разницу распределения у пациентов 1-й и 2-й групп.
Продолжая анализ, выявили, что A/A генотип больше встречался у пациентов 2-й группы – 46,7% (в 1-й – 39%), ?2=3,5; р=0,06; OR=0,6; 95% CI 0,37–1,027, что свидетельствовало о благоприятном типе данного генотипа. Генотип A/G больше был представлен в 1-й группе – 48,8%, во 2-й – 32,6%, при??2=0,002; р=0,9; OR=0,97; 95% CI 0,56–1,67, что было признаком благоприятности данного генотипа. Генотип G/G в 20,6% случаев имел место во 2-й группе и лишь в 12,2% в 1-й группе, ?2=7,5; р=0,006; OR=2,9; 95% CI 1,396–6,181. Как видно, этот генотип повышает риск развития патологических изменений в сосудах головного мозга почти в 3 раза. Сочетание А/G+G/G генотипов ?2=3,0; р=0,08; OR=1,6; 95% CI 0,973–2,699 дает более низкий риск, чем генотип G/G. Интересные данные выявлены в ходе анализа частоты распределения генотипов полиморфизма гена Col 4a1. Гомозиготный генотип G/G чаще был представлен в 1-й группе – 63,4%, во 2-й группе – 46,7%, при этом ?2=16,6; р<0,05; OR=0,3; 95% CI 0,2004–0,575, что свидетельствует о крайне низком риске. Генотип G/A меньше встречался в 1-й группе – 31,7%, во 2-й – 41,3% ?2=8,7; р=0,003; OR=2,2; 95% CI 1,306–3,871, при этом риск развития нДСТ и как следствие деформаций сосудов головного мозга повышается в 2,2 раза. Генотип A/A больше встречался во 2-й группе – 12%, в 1-й группе – 4,9% ?2=5,9; р=0,01; OR=3,2; 95% CI 1,196–8,56, с повышением риска в 3,2 раза.
Таким образом, мигрень, развившаяся на фоне аномалий сосудов головного мозга, имеет клинико-неврологические и молекулярно-генетические особенности. Так, выявлена высокая встречаемость незамкнутости Виллизиева круга, а также патологических деформаций в ВСА. Клиника мигрени на фоне аномалий сосудов головного мозга, в частности патологических деформаций, характеризовалась наличием признаков нДСТ, выраженной неврологической симптоматикой и мутациями в генах ММР3, ММР9, VEGF G-634C, Col 4a1, достоверно повышающих риск развития сосудистых аномалий головного мозга.
Л И Т Е Р А Т У Р А
1. Гафуров Б.Г. // Человек и лекарство. – 2013. – №2. – С.55–58.
2. Клеменов А.В. Недифференцированная дисплазия соединительной ткани. – М., 2006. – 120 с.
3. Крылов В.В., Ткачев В.В., Добровольский Г.Ф. Микрохирургия аневризм Виллизиева круга многоугольника. – М., 2004. – 160 с.
4. Смяловский В.Э., Илюхин А.С. и др. Комплексное использование магнитно-резонансной ангиографии и транскраниальной допплерографии в исследовании сосудов Виллизиева круга. Тезисы докладов 5-го съезда Российской ассоциации специалистов ультразвуковой диагностики в медицине. – М., 2007. – С.236.
5. Steiner T.J., Stovner L.J., Birbeck G.L. // The Journal of Headache and Pain. – 2013. – Vol.14. – P.1.
6. Stovner L., Andree C. // The Journal of Headache and Pain. – 2010. – Vol.11. – P.289–299.
Медицинские новости. – 2016. – №5. – С. 82-84.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.