Mishchenko O.N.1, Kopchak A.V.2, Krishchuk N.G.3, Skiba I.A.4, Chernogorsky D.M.2
1Zaporozhye State Medical University, Ukraine
2National Medical University named after AA. Bogomolets, Institute for Post-Graduate Education, Kiev, Ukraine
3Kiev Polytechnic Institute named after Igor Sikorsky, Mechanical Engineering Institute, Ukraine
4Institute of Metal Physics named after G.V. Kurdyumov National Academy of Sciences of Ukraine, Kiev
Computer simulation of the stress-strain state of the “bone – implant” system when
the implants made from zirconium alloys
Резюме. Поиск новых материалов для имплантации с улучшенными биологическими и физико-механическими свойствами сегодня остается актуальной проблемой стоматологии, биомедицинской техники и материаловедения. Одним из перспективных направлений совершенствования свойств имплантологических материалов является создание низкомодульных сплавов на основе циркония и совершенствование технологии их обработки. На основе модельного численного эксперимента авторы исследования определили закономерности напряженно-деформированного состояния биомеханических систем «кость – имплантат» в зависимости от физико-механических свойств костной ткани и дентальных имплантатов, изготовленных из материалов с различным модулем упругости. Представлены результаты изучения механизма передачи нагрузки от имплантата на костную ткань челюсти человека и определены предельные параметры биомеханического состояния системы при силовой нагрузке имплантатов из циркониевых сплавов в зависимости от архитектоники и типа костной ткани.
Ключевые слова: компьютерное моделирование, напряжения, деформация, система «кость – имплантат», циркониевый сплав.
Современнаястоматология. – 2017. – №2. – С. 62–68.
Summary.The search for new materials for implantation with improved biological and physicomechanical properties today remains an urgent problem of dentistry, biomedical engineering and materials science. One of the promising areas for improving the properties of implant materials is the creation of low-modulus zirconium-based alloys and the improvement of their processing technology. Based on a model numerical experiment, the authors of the study determined the patterns of the stress-strain state of biomechanical systems “bone – implant” depending on the physic-mechanical properties of bone tissue and dental implants made from materials with a different modulus of elasticity. The results of studying the mechanism of transfer of the load from the implant to the bone tissue of the human jaw are presented and the limiting parameters of the biomechanical state of the system are determined for force loading of implants from zirconium alloys depending on the architectonics and the type of bone tissue.
Keywords:computer modeling, stress, deformation, “bone – implant” system, zirconium alloy.
Sovremennayastomatologiya. – 2017. – N2. – P. 62–68.
Научные основы современной стоматологической имплантации были заложены P.I. Branemark [1, 2], который, используя титановую камеру для исследования кровотока кости кролика, обнаружил высокую биосовместимость титана и его способность непосредственно контактировать с новообразованной костной тканью без формирования соединительнотканной капсулы. Для определения этого явления ученый предложил термин «остеоинтеграция», и сегодня его открытие рассматривается как одно из революционных достижений в области стоматологии ХХ века.
При остеоинтеграции существует непосредственный контакт и функциональная связь поверхности имплантата и окружающей кости, которые определяют особые отношения между искусственным материалом и живой тканью [3]. Достижение остео-интеграции возможно при применении материалов с биоинертными или биоактивными свойствами, среди которых наиболее распространенными являются титан и его сплавы. Однако, несмотря на многочисленные преимущества имплантатов из титана, их использование ассоциировано с рядом негативных местных и системных эффектов, связанных с выделением ионов металла или миграцией в ткани продуктов микротрения, которое резко повышается при функциональной нагрузке [4].
В традиционные титановые сплавы для изготовления дентальных имплантатов включают ванадий и алюминий. Ионы ванадия влияют на липидный обмен, имеют цитотоксическое воздействие на ткани и способствуют разрушению некоторых ферментов. Ионы алюминия подавляют синтез АТФ, поэтому повышенное его содержание может существенно снизить метаболическую активность костной ткани и замедлить минерализацию [5]. Главным недостатком титановых имплантатов ряд ученых считают несоответствие модуля упругости титана и костной ткани, который отличается на порядок. В частности, это вызывает эффект экранирования напряжений (стресс-шилдинг эффект), искажает естественное распределение напряжений и деформаций в костной ткани. Как следствие, в процессе ремоделирования кости вокруг имплантата фиброзная ткань начинает превалировать над костной, а качество последней уменьшается [6].
Поиск новых материалов для имплантации с улучшенными биологическими и физико-механическими свойствами остается актуальной проблемой стоматологии, биомедицинской техники и материаловедения. Одним из перспективных направлений совершенствования свойств имплантологических материалов является создание низкомодульных сплавов на основе циркония и совершенствование технологии их обработки [7]. Цирконий и его сплавы отличаются биоинертностью, высокой способностью к механической обработке, хорошо свариваются, подвергаются всем видам горячей и холодной обработки давлением, а также имеют высокую прочность и коррозионную стойкость (выше, чем у титана). Циркониевые сплавы характеризуются меньшим значением величин отрицательного потенциала поверхности и высокой энергией Гиббса, определяющей способность к самопроизвольной адгезии биомолекул на поверхности имплантата. В отличие от традиционных титановых сплавов для них свойственно отсутствие токсичных химических примесей, меньшая склонность к поглощению водорода и охрупчуванию в процессе изготовления, способность образовывать защитную оксидную пленку с остеокондуктивными свойствами.
В Институте металлофизики им. Г.В. Курдюмова Национальной академии наук Украины был разработан метод создания новых Smart-материалов, основанный на том, что механическое поведение циркониевых и титановых сплавов существенно зависит от соотношения металлической и ковалентной составляющих атомной связи. Ослабление ковалентной составляющей, которая приводит к уменьшению модулей упругости, может быть достигнуто целенаправленными изменениями, как атомного, так и электронного строения. На основе применения даного метода создан новый ?-циркониевый сплав 51Zr31Ti18Nb, жесткость которого в 2,3 раза меньше, чем в традиционных титановых сплавах, а прочность в условиях циклических нагрузок оказывается больше почти в 1,5 раза [8, 9]. Материал характеризуется высокой биоинертностью, однако особенности его биомеханического поведения при установке имплантатов в костную ткань с разным «качеством» являются практически неизученными.
Цель исследования – на основе модельного численного эксперимента определить закономерности напряженно-деформированного состояния (НДС) биомеханических систем «кость – имплантат» в зависимости от физико-механических свойств костной ткани и дентальных имплантатов, изготовленных из материалов с различным модулем упругости; изучить механизм передачи нагрузки от имплантата на костную ткань челюсти человека и определить предельные параметры биомеханического состояния системы при силовой нагрузке имплантатов из циркониевых сплавов в зависимости от архитектоники и типа костной ткани.
Материалы и методы
Поставленная задача решалась с применением методов геометрического моделирования и визуализации, механики твердого деформируемого тела, вычислительной математики для решения контактных задач теории упругости и информационных технологий для имитационного моделирования методом конечных элементов (МКЭ) в СAD/CAE системах [10–13]. Объектом исследования в данной работе была многокомпонентная имитационная компьютерная модель биомеханической системы «кость – имплантат», созданная из четырех объемных структурных элементов (кортикальный слой сегмента нижней челюсти, губчатый слой сегмента нижней челюсти, имплантат, керамическая коронка), которые имели изотропные упругие характеристики механических свойств неоднородных материалов. В процессе математического моделирования переменными параметрами биомеханической системы выступали толщина кортикального слоя челюсти, биомеханические свойства, определяющие архитектонику и тип кости, физико-механические свойства материала имплантата, а также условия силовой нагрузки имплантата. Всего было создано и рассчитано 54 имитационных компьютерных модели НДС биомеханической системы «кость – имплантат» с различными параметрами (табл. 1).
Таблица1 Параметры биомеханической системы «кость – имплантат», которые изменялись при создании различных имитационных компьютерных моделей
|
Толщина кортикального слоя
|
Физико-механические свойства кортикального слоя
|
Материал имплантата
|
Условия силового нагружения
|
|
1 мм
|
Низкоминерализованная кость
|
Титан
|
Вертикальная нагрузка
|
|
2 мм
|
Свойства, приближенные к средней анатомической норме
|
КТЦ-125
|
Горизонтальная нагрузка
|
|
3 мм
|
Высокоминерализованная плотная кость
|
?-Zr-Ti-Nb
сплав
|
Для воспроизведения геометрии имплантатов применяли классические методы геометрического моделирования в CAD системах. В имитационной модели была воспроизведена форма винтового имплантата производства Zircon Prior. На базе стандартного абатмента была смоделирована коронка, которая отвечала по форме коронке нижнего резца. Для воспроизведения неоднородной структуры челюстей был применен полуавтоматический алгоритм построения модели на основе данных спиральной компьютерной томографии пациента с нормально сформированным лицевым черепом, без видимых дефектов зубных рядов и признаков костной патологии. Данные компьютерной томограммы в виде серии файлов формата DICOM импортировали в программную среду SimPlant (Materialize, Бельгия), где проводили дальнейший анализ и обработку томографических изображений.
После сегментации изображения с созданием «масок» в диапазоне, соответствующем рентгенологической плотности кости кортикального и губчатого слоя, применяя инструменты для работы с «маской» и булевые операции, проводили отделение сегмента нижней челюсти в области фронтальных зубов. Осуществляли виртуальное удаление зубов, а образовавшееся пространство «заполняли» костной тканью. После редактирования «масок» и устранения артефактов осуществляли построение 3D-моделей сегмента челюсти, кортикального и губчатого слоя кости в заданной области. Созданные трехмерные модели представляли в виде полигональной поверхности или набора полилиний, которые сохраняли в формате STL и IGS. Сформированные наборы данных импортировали в программную среду Solidworks, где осуществляли дальнейшие этапы создания твердотельных виртуальных моделей и совмещение неоднородных моделей кости с предварительно созданными моделями дентальных имплантатов в режиме сборки. Толщину кортикального слоя кости на участке альвеолярного отростка изменяли, воспроизводя различные типы ее архитектоники [14–16]. В разных моделях она составляла 1, 2 или 3 мм.
Созданные модели импортировали в программную среду Ansys (Swanson Ansys Inc., США). Для формирования объемной сетки твердотельной модели биомеханической системы были применены 10-узловые тетраэдрические конечные элементы с квадратичной аппроксимацией функций, которые являются оптимальными для отображения объектов неправильной формы со сложной геометрией [17]. При этом на участках, где предполагали наличие концентрации напряжений и в зонах со сложной геометрией, прибегали к сгущению сетки (рис. 1).
Физико-механические свойства материалов в моделях изменяли, воспроизводя различные клинические ситуации и разные типы имплантатов. Это позволяло определить особенности биомеханического поведения имплантатов, изготовленных из разных сплавов и установленных в кость с разной архитектоникой и минеральной насыщенностью.
Так, вариацию биомеханических характеристик кортикального слоя проводили для трех типов биологических тканей: 1) высокоминерализированная плотная кортикальная кость, 2) нормальная кортикальная кость с умеренной минеральной насыщенностью, 3) низкоминерализованная кортикальная кость [11].
Механические свойства материала, из которого были изготовлены имплантаты, отвечали характеристикам титана марки Grade-4 (чаще всего используется для изготовления традиционных остеоинтегрированных дентальных имлантатов, так как является биосовместимым и не оказывает токсического действия на ткани челюсти), КТЦ-125 и бета-титан-циркон-ниобиевого (?-Zr-Ti-Nb) сплава. Абатменту придавали физико-механические свойства титана, а свойства коронки отвечали традиционной медицинской керамике, которая используется в зубном протезировании [8, 9, 19] (табл. 2).
Таблица 2. Физико-механические свойства материалов воспроизведены в моделях биомеханических систем «кость – имплантат»
|
Тип
материала
|
Модуль
упругости, МПа
|
Коэффициент
Пуассона
|
Статическая прочность, МПа
|
Прочность при
циклических нагрузках, МПа
|
|
Титан
|
110000
|
0,34
|
800
|
400–550
|
|
КТЦ-125
|
88000
|
0,33
|
1000
|
600–700
|
|
?-Zr-Ti-Nb сплав
|
55000
|
0,39
|
1400
|
1000–1200
|
|
Керамическая коронка
|
330000
|
0,22
|
На растяжение – 48,8
На сжатие – 162,9
|
–
|
|
Низкоминерализованная кортикальная кость
|
5000
|
0,25
|
50–70*
|
In vivo не исследовалась
|
|
Умеренноминерализованная кортикальная кость
|
8000
|
0,25
|
80–100*
|
|
Высокоминерализованная кортикальная кость
|
12000
|
0,25
|
100–120*
|
|
Губчатая кость
|
800
|
0,27
|
3–15
|
Примечание: * – предел упругости, который является предельно допустимым для кортикальной кости
С целью анализа закономерностей НДС смоделированных биомеханических систем «кость – имплантат» к режущему краю коронки имплантата прикладывали статические усилия: 1) вертикальное, направленное вниз вдоль продольной оси имплантата, с величиной 60 Н; 2) горизонтальное, направленное в вестибуло-оральном направлении перпендикулярно продольной оси имплантатов с величиной 30 Н. Величину внешней нагрузки определяли, исходя из экспериментальных данных о максимальных/ предельных нагрузках, развивающихся на поверхности фронтальных зубов нижней челюсти в процессе пережевывания пищи [19].
Результаты численных экспериментов по определению НДС имитационных моделей биомеханических систем разного типа представляли в виде цветных карт полей исследуемых функций или векторной графики, применяя специальные инструменты программного комплекса ANSYS, и определяли максимальные значения локальных напряжений и деформаций в зонах их максимальной концентрации.
В ходе анализа полученных данных оценивали жесткостные характеристики каждого типа биомеханической системы по величине максимальных перемещений узлов конечноэлементной модели при воспроизводимых условиях ее силового нагружения, качественно описывали характер распределения напряжений и деформаций, определяли их градиенты, оценивали вид НДС по параметру Надаи-Лоде [11].
Результаты и обсуждение
Анализ результатов численных расчетов жесткостных характеристик и НДС биомеханических систем «кость – имплантат» с различными типами имплантатов позволил установить следующее.
При вертикальной нагрузке с величиной 60 Н, что соответствует откусыванию и разжевыванию жесткой пищи или произвольному сжатию зубов с наибольшим усилием, максимальная деформация системы колебалась от 0,0022 до 0,005 мм, в зависимости от механических свойств костной ткани и материала, из которого был изготовлен имплантат. Эти величины значительно меньше естественной микроподвижности здоровых зубов, которую определяют на уровне 0,1–0,25 мм (экспериментально определенная величина перемещения коронковой части зуба при нагрузке). Увеличение толщины кортикального слоя с 1 до 3 мм приводило к повышению жесткости биомеханической системы на 20–31%. При этом зависимость между деформациями и толщиной кортикального слоя была нелинейной: увеличение толщины кортекса с 1 до 2 мм существенно уменьшало деформационную способность системы для всех типов имплантатов и при разной плотности кости. Дальнейшее увеличение толщины кортекса практически не сказывалось на деформационной способности имплантатов, расположенных в плотной кости, и лишь незначительно влияло на имплантаты, расположенные в низкоминерализованной кости. Таким образом, уменьшение деформационной способности биомеханической системы при увеличении толщины кортикального слоя оказывалось более выраженным при меньшей плотности костной ткани и имело большее значение для имплантатов с большей жесткостью.
Увеличение минеральной насыщенности костной ткани приводило к уменьшению деформационной способности системы на 27–48%. При применении титановых имплантатов изменение минеральной насыщенности влияло на деформационную способность системы в меньшей степени, чем при установке имплантатов из циркониевых сплавов. При применении последних деформационная способность системы возрастала, приближаясь к деформационным свойствам естественных зубов. Наименьшую жесткость система проявляла при установлении имплантатов из ?-Zr-Ti-Nb сплава, она была на 12–25% меньше, чем при установке титановых имплантатов. Влияние материала, из которого изготовлен имплантат, было более выраженным при увеличении толщины кортикального слоя.
Нагрузка от имплантата передавалась и распределялась в основном за счет кортикального слоя кости. Наибольшую концентрацию напряжений отмечали в кортикальной кости вокруг первых 2–3 витков резьбы имплантата. При этом величина напряжений с язычной стороны оказывалась больше, чем с вестибулярной. Другой участок концентрации напряжений отмечали в кортикальном слое челюсти, приближенном к апикальной части имплантата. Возникновение напряжений в этой зоне обусловлено особенностями установки имплантата при имеющихся топографо-анатомических особенностях воспроизводимого сегмента челюсти. В модели отдельные витки резьбы имплантата в его нижней трети контактировали с кортикальным слоем или погружались в него. Это существенно влияло на особенности распределения напряжений в системе при воссозданных условиях вертикальной нагрузки. Величина напряжений на апикальном участке была сопоставима с величиной напряжений в пришеечной зоне, а в отдельных моделях даже превышала ее (рис. 2, 3).


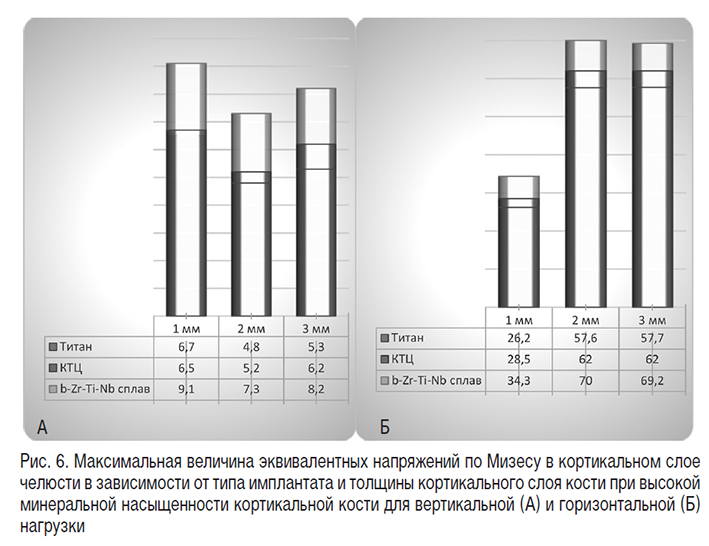
Как видно из представленных на рисунках 4–6 данных, величина эквивалентных напряжений по Мизесу в кортикальном слое челюсти во всех случаях оказывалась значительно меньше, чем предельно допустимое значение. При применении жестких титановых имплантатов отмечалась четкая тенденция к уменьшению максимальной величины напряжений в костной ткани при увеличении толщины кортикального слоя с 1 до 2 мм (на 28–41%). А при дальнейшем увеличении толщины кортикального слоя напряжения снова возрастали. Для циркониевых сплавов закономерность была подобной, но изменение величины напряжений при увеличении толщины кортикального слоя с 1 до 2 мм было меньшим. При увеличении толщины кортикального слоя до 3 мм напряжения возрастали практически до исходного уровня. Также напряжения возрастали и при увеличении минеральной насыщенности кости (более чем в 1,5 раза для титановых имплантатов и более чем в 2 раза для имплантатов из ?-Zr-Ti-Nb сплава).

Применение имплантатов из циркониевых сплавов в общем характеризовалось увеличением величины напряжений в костной ткани на 2,5–35,5% со значительной вариативностью в зависимости от свойств и архитектоники кости.
При горизонтальной нагрузке с силой в 30 Н, что соответствует максимальной величине горизонтального компонента жевательной нагрузки на фронтальную группу зубов, величина деформаций и напряжений в системе резко возрастала, а вид НДС качественно менялся.
Биомеханические условия горизонтальной нагрузки оказывались менее благоприятными, чем условия вертикальной нагрузки: способность системы противодействовать деформациям в этих условиях уменьшалась на порядок. Максимальная деформация системы колебалась от 0,017 до 0,042 мм, в зависимости от механических свойств костной ткани и материала, из которого был изготовлен имплантат. В целом, максимальная деформация системы увеличивалась при уменьшении толщины кортикального слоя, снижении его минеральной насыщенности и уменьшении модуля упругости имплантата. Эти изменения были непропорциональными. Так, увеличение толщины кортикального слоя с 2 до 3 мм практически не сказывалось на общей деформации системы, но уменьшение с 2 до 1 мм повышало деформацию на 13,5–17%. Более чем двукратное изменение модуля упругости кортикального слоя кости приводило к значительному уменьшению жесткости биомеханической системы и, соответственно, увеличению деформаций на 37–39%. Уменьшение модуля упругости имплантата приводило к увеличению величины деформации до 25%, то есть на 5–7 мкм, что не является клинически значимым.
Величина деформации биомеханической системы «кость – имплантат» оказывалась при любых условиях, воспроизведенных в имитационной модели, меньше физиологической подвижности зубов более чем в 2 раза.
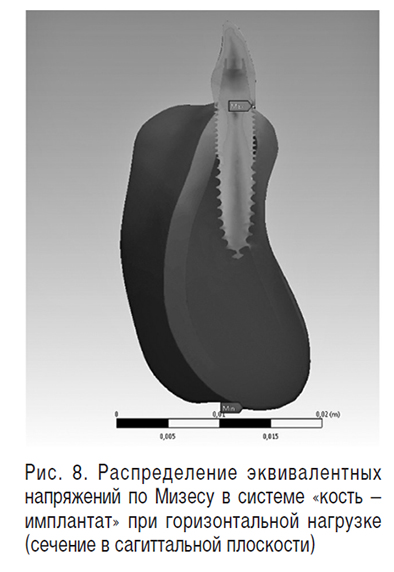
НДС системы при горизонтальной нагрузке характеризовалось преобладанием деформаций изгиба и сдвига (рис. 7). Величина напряжений в кортикальном слое кости при горизонтальной нагрузке оказывалась в несколько раз больше, чем при вертикальной, за счет появления участков их значительной концентрации и неравномерного распределения градиентов напряжений (рис. 8). Величины напряжений росли при увеличении толщины кортикального слоя, увеличении его минеральной плотности и уменьшении модуля упругости имплантата. Так, напряжения в костной ткани вокруг имплантатов из ?-Zr-Ti-Nb сплава были в 1,2–1,5 раза больше, чем при применении титановых имплантатов.
Полученные данные по распределению напряжений и деформаций в костной ткани вокруг имплантатов приобретают особое значение в связи с тем, что остеоинтеграция достигается и поддерживается в процессе регенерации и постоянного ремоделирования костной ткани, вследствие чего биомеханические параметры системы «кость – имплантат» меняются во времени [18].

Ремоделирование костной ткани происходит за счет двух разнонаправленных процессов – ее резорбции и формирования [10, 20].
Эти процессы взаимосвязаны в пространстве и времени, подвержены сложной регуляции и реализуются клетками костной ткани – остеобластами и остеокластами. Баланс процессов резорбции и формирования костной ткани в норме обеспечивается сложными механизмами регуляции, среди которых важную роль играют гормоны, местные паракринные факторы, и, особенно, механические напряжения и деформации. Считается, что при деформациях в структурных элементах костного матрикса возникают пьезоэлектрические заряды, величина и распределение которых оказывают влияние на мембраны остеоцитов и остеобластов и определяют интенсивность биосинтетических процессов в этих клетках. Клетки кости секретируют паракринные факторы, такие как инсулиноподобный фактор роста I (IGF?-I) в ответ на действие механических сил [21]. Таким образом, костная ткань образует структуру, наиболее приспособленную к действию внешних нагрузок (закон Вольфа). При изменении вида НДС и условий внешней нагрузки соответственно меняются градиенты напряжений и деформаций в кости. В ответ на это происходит адаптация внутренней структуры кости за счет изменения плотности, формы, размеров и расположения трабекул и остеонов [10, 11, 13]. Однако в отдельных случаях, при протезировании с опорой на дентальные имплантаты, в условиях длительной циклической нагрузки в костной ткани возникает чрезмерная концентрация напряжений, что превышает ее адаптивные возможности, нарушает течение регенераторных процессов и приводит к патологической перестройке кости [11, 22].
В изученных нами моделях ни в одном случае напряжения не превышали предельно допустимых величин, но при установке циркониевых имплантатов в костную ткань челюсти с толстым кортикальным слоем напряжения существенно приближались к предельной величине, что свидетельствовало об определенных ограничениях к применению этих имплантатов при I типе кости по Leckholm и Zarb [14, 15, 19]. В то же время при малой толщине кортикального слоя и его низкой минеральной насыщенности применение имплантатов из циркониевых сплавов может способствовать более интенсивной перестройке кости в сторону увеличения плотности, за счет возрастания величины напряжений в костной ткани в пределах физиологического диапазона.
Выводы:
1. Распределение напряжений и деформаций в системе «кость – имплантат» существенно зависит от физико-механических свойств имплантата, минеральной насыщенности кости и ее архитектоники. Напряжения в костной ткани нелинейно возрастали при увеличении толщины кортикального слоя, его минеральной плотности и при уменьшении модуля упругости имплантата. Деформационная способность биомеханической системы «кость – имплантат» возрастала при уменьшении толщины и минеральной насыщенности кортикального слоя, модуля упругости имплантата, а при вертикальной нагрузке была на порядок меньше естественной подвижности зубов.
2. При применении имплантатов из циркониевых сплавов деформационная способность биомеханической системы оказывалась больше на 12–25%, чем при использовании титановых имплантатов, и была ближе к естественным зубам. Напряжения в костной ткани вокруг имплантатов из циркониевых сплавов возрастали на 20–50% за счет уменьшения эффекта «экранирования» напряжений, но ни в одном наблюдении не превышали предельно допустимых значений, что создает оптимальные условия для адаптивной перестройки и ремоделирования кости вокруг имплантата в направлении ее укрепления и увеличения плотности.
3. Выявленные особенности биомеханического поведения циркониевых имплантатов с пониженным модулем упругости свидетельствуют о целесообразности их установки в костной ткани III и IV типа по Leckholm и Zarb, поскольку это будет способствовать более интенсивной адаптивной перестройке кости. В костной ткани I типа существуют ограничения к применению циркониевых имплантатов, обусловленные значительным ростом напряжений в зонах их локальной концентрации, особенно выраженные при их горизонтальной силовой нагрузке.
Л И Т Е Р А Т У Р А
1. Albrektsson T., Branemark P.I., Hansson H.A., Lindstrom J. // Acta Orthop. Scand. – 1981. – Vol.52. – P.155.
2. Buser D., Schenk R.K., Steinemann S., Fiorellini J.P., Fox C.H., Stich H. // J. Biomed. Mater. Res. – 1991. – Vol.25. – P.889–902.
3. Koh J.W., Kim Y.S., Yang J.H., Yeo I.S. // Int. J. Oral Maxillofac. Implants. – 2013. – Vol.28. – P.790–797.
4. Principles of Craniofacial Surgery and the Management of Complications Maxillofacial Surgery / T.A. Turvey, B. Golden, R.L. Ruiz. – 2017. – Vol.2. – P.835–844.
5. Toxicity of Metals Released from Implanted Medical Devices. Handbook on the Toxicology of Metals / R.P. Brown, B.A. Fowler, S. Fustinoni, M. Nordberg. – 2015. – Vol.1. – P.113–122.
6. Introduction to Surface Coating and Modification of Metallic Biomaterials / A. Nouri, C. Wen. – 2015. – P.3–60.
7. Niinom M. // Journal of the Mechanical Behavior of Biomedical Materials. – 2008. – Vol.1. – Р.30–42.
8. Влияние легирования гафнием на фазовый состав и модуль упругости сплава IMP-BAZALM / Гриб С.В., Илларионов А.Г., Марковский П.Е., Попов А.А., Ивасишин О.М.: сб. трудов XII Международной научно-технической Уральской школы-семинара металловедов. – Екатеринбург, 2011. – С.250–252.
9. Влияние термической обработки и пластической деформации на структуру и модуль упругости биосовместимого сплава на основе циркония и титана / Попов А.А., Ивасишин О.М., Илларионов А.Г., Марковский П.Е. – 2012. – Т.113, №4. – С.404–412.
10. Бруско А.Т., Рой І.В., Мазур І.П. // Імплантологія. Остеологія. Пародонтологія. – 2009. – №4. – С.18–21.
11. Маланчук В.О. Імітаційне комп’ютерне моделювання в щелепно-лицевій хірургії / В.О. Маланчук, М.Г. Крищук, А.В.Копчак. – Киев, 2013. – 231 с.
12. Патент 102455 UА, МПК А61L27/00, А61F2/02, C22C16/00, B82B3/00. Біосумісний сплав із низьким модулем пружності на основі системи цирконій-титан // Івасишин О.М., Скиба І.М., Красевска О.П., Марковский П.Є.; Інститут металофізики імені Г.В. Курдюмова НАН України, опубл. 10.07.2013 г., бюл. №13.
13. Чуйко А.Н. Биомеханика в стоматологии / А.Н. Чуйко, И.А. Шинчуковский. – Харьков, 2010. – 466 с.
14. Histologic studies of failed dental implants: A retrieval analysis of four different oral implant designs / T. Albrektsson, P. Åstrand, W. Becker, A.R. Eriksson, U. Lekholm, J. Malmquist, L. Sennerby // Original Research Article Clinical Materials. – 1992. – Vol.10, Is.4. – P.225–232.
15. Clinical procedures for treatment with osseointegrated dental implants. Original Research Article / U. Lekholm. – The Journal of Prosthetic Dentistry. – 1983. – Vol.50, Is.1. – P.116–120.
16. Crestal bone loss proximal to oral implants in older and younger adults Original Research Article / S.R. Bryant, G.A. Zarb. // The Journal of Prosthetic Dentistry. – 2003. – Vol.89, Is.6. – P.589–597.
17. Басов К.А. ANSYS: Справочник для пользователя / Басов К.А. – М., 2005. – 640 с.
18. Параскевич В.Л., Максименко Л.Л. // Новое в стоматологии. – 2000. – №8. – С.38–45.
19. Misch C.E., Qu Z., Bidez M.W. // J. Oral Maxillofac. Surg. – 1999. – Vol.57, N6. – P.700–706.
20. Siddiqui J.A., Partridge N.C. // Physiology (Bethesda) – 2016. – Vol.31. N3. – P.233–245.
21. Mechanotransduction activates ?5?1 integrin and PI3K/Akt signaling pathways in mandibular osteoblasts / Original Research Article / H. Watabe, T. Furuhama, N. Tani-Ishii, Y. Mikuni-Takagaki // Experimental Cell Research. – 2011. – Vol.317, Is.18. – P.2642–2649.
22. Florencio-Silva R., Sasso G.R., Sasso-Cerri E., Simoes M.J., Cerri P.S. // Biomed. Res. Int. – 2015. – Vol.42. – P.17–46.
Современная стоматология. – 2017. – №2. – С. 62-68.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.