Внимание! Статья адресована врачам-специалистам
Mokhort T.V.
Belarusian State Medical University, Minsk
The problem of choosing the pathogenetic therapy of diabetic peripheral neuropathy
Резюме. Диабетическая периферическая невропатия (ДПН) является наиболее распространенным осложнением сахарного диабета, приводящим к ампутациям и существенно ограничивающим качество жизни. Проведен анализ потенциальных терапевтических подходов к лечению ДПН с позиций использования фармакологических подходов, модифицирующих заболевание. Определено, что при выборе терапии необходимо ориентироваться на доказательства нейропротективного эффекта. Изложены результаты использования альфа-липоевой кислоты, витаминов группы В, депротеинизированного гемодеривата (Актовегин®), нуклеотидов (Келтикан® комплекс). Обоснована целесообразность проведения длительной сочетанной терапии с назначением препаратов, модифицирующих метаболические нарушения в нервных волокнах. При выборе тактики каузальной (патогенетической) терапии ДПН из широкого спектра альтернативных препаратов следует учитывать удобство применения, наличие коморбидной патологии, благоприятный профиль безопасности, возможность комбинирования с другими лекарственными средствами и хорошее соотношение стоимость/эффективность.
Ключевые слова: диабетическая периферическая невропатия, патогенетическое лечение, альфа-липоевая кислота, витамины группы В, актовегин, нуклеотиды (уридин, цитидин), комбинированная терапия.
Медицинские новости. – 2017. – №8. – С. 11–17.
Summary. The peripheral diabetic neuropathy (DPN) is the most common and debilitating complication of a diabetes mellitus, leading to amputations, and significantly limiting quality of life. The analysis of potential therapeutic approaches to the pharmacological treatment of DPN from the position of using the approach of modifying the disease. It was determined that in the selection of therapy should focus on the evidence of a neuroprotective effect. Results of use of alpha-lipoic acid, vitamins of group B, Actovegin®, Keltican® complex (nucleotides) are explained. Expediency prolonged combination therapy with the appointment of agents that modify the metabolic abnormalities in the nerve fibers. It is noted that at the choice of tactics of causal (pathogenetic) therapy of DPN from a wide range of the alternate medicines, it is necessary to consider convenience of application, existence of comorbid pathology, the favorable profile of safety, a possibility of a combination with other medicines and a good ratio cost/effectiveness.
Keywords: diabetic peripheral neuropathy, pathogenetic therapy alpha-lipoic acid, vitamins B, Actovegin®, nucleotides (uridine, cytidine), combination therapy.
Meditsinskie novosti. – 2017. – N8. – P. 11–17.
Прогрессирующий рост количества пациентов с сахарным диабетом (СД) в мире, регистрирующийся на протяжении последних 40 лет, ставит перед клиницистами ряд проблем. В конце 2016 года была подписана Берлинская декларация, определяющая значимость проблемы СД. По данным этого документа, с 2015 по 2040 год ожидается увеличение числа лиц с СД в возрасте 20–79 лет с 415 до 642 млн, с предиабетом – с 6,7 до 7,8% от общей популяции и затрат на СД с 673 до 802 млрд долларов США [46].
Одной из актуальных проблем является ведение диабетической периферической невропатии (ДПН) – наиболее часто выявляемого специфического осложнения СД. Актуальность ДПН обусловлена следующими факторами.
· Распространенность среди пациентов с СД достигает 50–60%, в отдельных популяциях – до 90%.
· Выявление ДПН в 8–10% случаев при установлении диагноза СД.
· Частота ампутаций вследствие ДПН – более 60% нетравматических ампутаций проводятся для лечения гангрен, обусловленных развитием ДПН.
· ДПН, приводящая к ампутациям и существенно ограничивающая качество жизни, – одно из самых финансово затратных осложнений СД.
Очевидно, что ситуация в Республике Беларусь повторяет мировые тенденции. Регистрируется неуклонный рост заболеваемости СД: если в 1995 году первичная заболеваемость СД составила 69,6 на 100 000 населения, то в 2015-м первичная заболеваемость СД 2-го типа (без СД 2-го типа и специфических форм) достигла 285,24 на 100 000 населения. К сожалению, национальные данные медицинской статистики по учету ДПН не отражают реальную картину. При оценке результатов работы эндокринологической службы показатель зарегистрированных случаев ДПН указывается 16,28% в общей когорте пациентов с СД, в то время как, по результатам кросс-национального исследования оценки вибрационной чувствительности пациентов с недавно (до 2 лет) диагностированным СД 2-го типа, патология была выявлена у 24,1% [39]. Очевидно, что длительное течение СД должно увеличивать этот показатель.
Дополнительным фактором, определяющим актуальность ДПН, является отсутствие четких рекомендаций по лечению, несмотря на наличие стандартных общепринятых диагностических мероприятий. В различных рекомендациях экспертов, включая последние Стандарты оказания помощи при СД Американской диабетологической ассоциации, изданные в 2017 году, усилия в лечении пациентов с ДПН концентрируются на уменьшении выраженности болевого синдрома, минимизации симптоматики (проявлений неврологического дефицита) периферической ДПН и автономной невропатии, улучшении качества жизни этих пациентов.
Изданные последние рекомендации Американской диабетологической ассоциации ведения пациентов с ДПН:
– определяют новые классификационные подходы, выделяя ДПН мелких и крупных волокон, смешанную форму ДПН;
– указывают на факт частого сочетания ДПН с другими формами невропатий и установление ДНП как диагноза исключения;
– утверждают об общности патогенетических подходов, направленных на модификацию заболевания, то есть поражения нервных волокон, в лечении невропатий различного генеза;
– определяют тактику лечения болевых форм ДПН;
– не рассматривают возможности лечения ДПН, основанного на модификации заболевания [38].
При анализе подходов, определяющих достижение указанных целей, традиционно для ведения микрососудистых осложнений рекомендуется достижение и поддержание стойкой компенсации СД. При наличии бесспорных доказательств эффективности жесткого контроля гликемии для предупреждения развития и прогрессии ДПН при СД 1-го типа, влияние жесткого (НвА1с 6,4 vs 8,5%) контроля гликемии на развитие ДПН при СД 2-го типа не имеет бесспорных доказательств (рис. 1, 2) [11, 17, 46]. При этом для СД 1-го типа имеет принципиальное значение жесткий контроль гликемии с момента манифестации заболевания, что подтверждается сохранением снижения доли пациентов с ДПН за счет «гликемической памяти» даже в условиях последующих нарушений компенсации (рис. 3) [4]. Среди причин – комплексное поражение нервов при СД 2-го типа, включающее комплексное воздействие не только гипергликемии, но также влияние эндотелиальной дисфункции, развивающейся задолго до манифестации СД 2-го типа, наличие сопутствующей патологии (хронические заболевания почек, печени, аутоиммунные заболевания), токсических влияний (алкоголь, различные лекарственные средства, токсиканты), а- и гиповитаминозы, компрессионные и травматические поражения нервов, демиелинизирующие заболевания. Тем не менее более чем 30 лет исследований по ДПН свидетельствуют о том, что только контроль гликемии остается единственной терапией, модифицирующей заболевание [28, 50].

Лечебные подходы основаны на понимании патогенетических особенностей развития невропатии. Несмотря на то, что достижение компенсации углеводного обмена не обеспечивает предупреждение развития невропатии, в основе развития ДПН лежит именно гипергликемия и дефицит (абсолютный или относительный) инсулина, модифицирующий метаболизм глюкозы. Системная гипергликемия приводит к развитию гипергликемии в нервных клетках и клетках эндотелия, что определяет повреждение нерва (рис. 4). Основные метаболические нарушения включают:
– активацию полиолового (сорбитолового) пути, что результируется в избыточное образование сорбитола и развитие эдоневрального отека;
– блокаду гексозаминового пути метаболизма глюкозы и нарушение функции митохондрий супероксидом, вызывающее увеличение внутриклеточного образования конечных продуктов гликирования (КПГ) (Advanced Glycation End products – AGEs) и активацию протеинкиназы С.
Кроме того гипергликемия приводит к повышению уровня свободных радикалов и развитию оксидативного стресса с недостаточной эффективностью антиоксидантной системы. Оксидативный стресс вызывает повреждение митохондриальной ДНК, в ответ активизируются регенеративные полимеразы (PARP), что приводит к блокаде обмена глюкозы с накоплением промежуточных продуктов обмена и формированием КПГ. Рецепторы КПГ (RAGEs) уже на стадии нарушения толерантности к глюкозе вызывают активацию ядерного фактора – NF -kB и значительно ухудшают эндоневральный кровоток, а также стимулируют транскрипцию и экспрессию провоспалительных цитокинов. Накопление в нейронах и эндотелиоцитах продуктов нарушенного метаболизма глюкозы лежит в основе повреждения нерва. При этом в нервной ткани происходит:
· демиелинизация, в основе которой неферментативное и ферментативное гликозилирование белков (миелина и тубулина) с нарушением нервной проводимости;
· гликозилирование белков базальной мембраны капилляров приводит к нарушению кровоснабжения нерва;
· интраневральный отек, обусловленный накоплением сорбитола;
· усиление окислительного стресса, обусловленного накоплением свободных радикалов, оказывающих прямое цитотоксическое действие;
· выработка аутоиммунных комплексов с угнетением факторов роста нервов и атрофия нервных волокон;
· снижение уровня миоинозитола с уменьшением синтеза фосфоинозитола.
Перечисленные патологические процессы наряду с демиелинизацией вызывают изменения внутриклеточного матрикса и снижение активности нейротрофинов, приводят к развитию валлеровой дегенерации, разрушению аксонов и нарушениям аксонального транспорта.
Ингибиторы альдозы редуктазы блокируют активацию полиолового пути метаболизма глюкозы и снижают осмотическое напряжение в основном в хрусталике и нервных волокнах. Связь развития ДПН с высокой степенью с экспрессии гена альдозы редуктазы AKR1B1 наряду с «биохимическим» эффектом позволяла планировать использование этого класса препаратов в лечении ДПН (Sorbinil, Ponalrestat, Zopolrestat, Zenarestat, Epalrestat), но, к сожалению, их эффективность не подтвердилась, и препараты не получили широкого распространения [6, 22].
Гексозаминовый путь реализуется в образование уридин-дифосфата-N-ацетилглюкозамина (UDP GlcNAc), который модулирует транскрипционные факторы, вызывает гиперпродукцию NF -kB, стимулирует транскрипцию и экспрессию провоспалительных цитокинов и вызывает повреждение нервов и сосудов. Прямые блокаторы гексозаминового пути не разработаны, но существуют подходы, основанные на механизме переключения метаболизма глюкозы, активируя действие транскетолазы. Способностью ингибировать гексозаминовый путь обладают витамин В1 и его жирорастворимая форма бенфотиамин, а также уридин [20].
Для ингибирования образования протеинкиназы С разработан препарат Ruboxistaurin, который является конкурентоспособным ингибитором ?-изоформы протеинкиназы С, но препарат при подтверждении влияния на ретинопатию не продемонстрировал клинически значимого уменьшения проявлений ДПН [51].
Активация образования КПГ определяет возможность использования 2 различных подходов – предотвращения формирования КПГ и блокаду их рецепторов, но их реальная эффективность в клинической практике спорна. Аспирин (ацетилсалициловая кислота) замедляет процессы гликозилирования in vitro и в эксперименте, но не в клинической практике. Несмотря на ранние многообещающие результаты использования второго альтернативного препарата – аминогуанедина по предотвращению гликирования белков, этот препарат не используется в связи с невозможностью его назначения в адекватных дозировках из-за выраженности побочных эффектов [8, 9]. Фенацил тиазолинум бромид (Phenacyl thiazolium bromide) способствует нарушению комплексирования КПГ с белком и коллагеном в эксперименте. Для использования в клинической практике отрабатываются молекулы, обладающие достаточной стабильностью (alagebriumchloride – ALT-711), но исследований по эффективному лечению ДПН к настоящему времени нет [30]. Рецепторы КПГ могут быть блокированы растворимым рецептором (sRAGE), который является внеклеточной связанной лигандом областью рецептора КПГ или при помощи специфических антител. К сожалению, данное направление пока не вышло за рамки экспериментальных исследований [5].
Ингибиторы Poly (ADP-ribose) polymerase (PARP) способствуют улучшению функции нейронов и уменьшению активности маркеров воспаления. Ингибиторы PARP (1,5-isoquinolinediol и 3-aminobenzamide, никотинамид) продемонстрировали эффективность в экспериментальных исследованиях [42]. При этом наиболее привлекательным является никотинамид, что обусловлено отсутствием побочных эффектов, поэтому инициировано исследование по комбинированной терапии ДПН с включением в комплексную терапию никотинамида.
Оксидативный стресс, сопровождающийся снижением антиоксидантной защиты, – известный механизм, приводящий к развитию ДПН, поэтому логически обосновано использование антиоксидантов. Антиоксиданты широко используются в лечении ДПН. При этом спектр потенциальных препаратов включает никотинамид, таурин, витамины С и Е, кверцетин, меланотонин, рутин, ацетинцистеин, карнитин и др. Наиболее используемым антиоксидантом с доказанным терапевтическим эффектом при ДПН является альфа-липоевая кислота [52].
Ингибиторы ангиотензинпревращающего фермента (иАПФ) хорошо известны как гипотензивные препараты, кардио-, нефро- и ретинопротекторы. К сожалению, не проведены крупные рандомизированные исследования, включающие оценку эффективности использования этого класса препаратов для профилактики и лечения ДПН. В ограниченном клиническом исследовании иАПФ трандалоприл продемонстрировал существенное улучшение ДПН [32]. Также бесспорно доказана обоснованность использования иАПФ в лечении кардиальной формы диабетической автономной невропатии, но не ДПН. Данный факт представляет интерес с позиций комплексного ведения пациента с СД.
Повреждающее действие при ДПН является исходом потери нейротрофической поддержки, обычно оказываемой инсулином, что подтверждается наличием рецепторов инсулина в шванновских клетках, сенсорных нейронах и патологическими уровнями экспрессии факторов роста. В доклинических исследованиях у диабетических крыс показано уменьшение проявлений ДПН при терапии инсулиновым фактором роста-1 (IGF) [12, 23]. Однако клиническое использование IGF лимитировано возможными системными эффектами соматомединов. Альтернативой является возможность использования нейротрофинов – фактор роста нерва (NGF), нейротрофический фактор (BDNF) и нейротрофины-3, -6. На уровне доклинических исследований определено, что различные формы нейротрофинов и различные методики их введения демонстрируют положительное влияние на миелинизацию и структуру нерва. Клинические исследования ограничены возможностью использования в связи с сложностью способа введения (под оболочку нерва) и побочными эффектами [13, 33].
Развитие ДПН не только снижает качество жизни за счет появления жалоб на боли и нарушения чувствительности, но является важным фактором риска (увеличение частоты ампутаций в 1,7 раза). Осложненные формы ДПН и развитие синдрома диабетической стопы увеличивают этот риск при наличии деформации стопы до 12 раз, в случае присоединения трофической язвы – до 36 раз. При этом формирование язвенного дефекта стопы является следствием комплексных изменений, обусловленных вовлечением в патологический процесс различных нервных волокон с развитием моторных (мышечная слабость, атрофии мышц и деформация стопы), сенсорных и автономных (нарушение потоотделения, сухость кожи, трещины, каллусы) нарушений. Кроме того, существующие изменения магистрального кровотока и микроциркуляторные нарушения усугубляют развитие патологии. При полном понимании фактов и роли ухода за стопами, использования адекватной обуви и различных методов разгрузки стопы, очевидно, что большая доля пациентов не следует рекомендациям [47].
Учитывая комплексность процессов, лежащих в основе развития ДПН, при выборе лечебной тактики обосновано использование различных препаратов с комплексным нейрометаболическим действием и эффектами на микроциркуляторное русло и эндотелий. Несмотря на то, что в клинической практике широко используются различные терапевтические подходы, четкая схема выбора альтернативных препаратов предложена только для ведения невропатической боли. Наряду с лечением боли в ведении пациентов с ДПН сформировалась концепция «каузальной» терапии, основанной на патогенетических воздействиях, модифицирующих развитие заболевания. С учетом того факта, что ДПН чаще характеризуется превалирующими нарушениями чувствительности, моторной и автономной иннервации, следует понимать, что «безболевые» формы ДПН, несущие угрозу формирования язвы и риска ампутации, не менее опасны. Какие же возможности используются в реальной клинической практике?
Альфа-липоевая кислота – мощный антиоксидант, способствует улучшению метаболизма в нейронах, повышению эндоневрального кровотока скорости проведения нервного импульса, улучшению различных видов чувствительности и моторных расстройств [40]. Завершенные рандомизированные исследования по эффективности альфа-липоевой кислоты свидетельствуют о ее эффективности при ДПН по уменьшению проявлений неврологического дефицита и улучшении самочувствия пациентов, что подтверждается данными мета-анализа наиболее значимых клинических исследований [53]. В дополнение к свойствам прямого антиоксиданта, по мнению исследователей, альфа-липоевая кислота способна предотвращать гликозилирование белков, следовательно, развитие осложнений диабета [36].
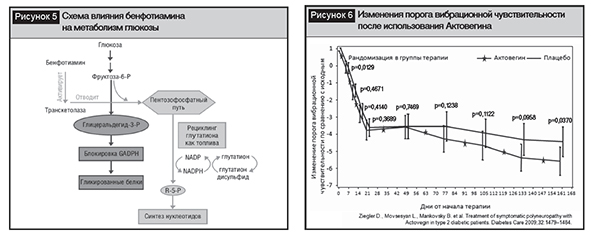
Вариантом выбора лечения ДПН является использование сывороточных гемодериватов, которые оказывают метаболические, антиоксидантные и нейропротективные влияния. Из различных форм сывороточных гемодериватов доказательная база по использованию при ДПН имеется только для Актовегина, получаемого методом ультрафильтрации из крови телят, который усиливает окислительное фосфорилирование глюкозы, повышая уровень АТФ, увеличивая утилизацию кислорода, что ведет к повышению выживаемости клеток в условиях ишемии за счет снижения продукции лактата [21]. Доказанным фармакологическим эффектом Актовегина является способность улучшать перенос глюкозы внутрь клетки путем активации ее транспортеров (GluT), что происходит за счет действия олигосахаридов, содержащихся в препарате, а не через инсулиновые рецепторы, то есть действие Актовегина является инсулинонезависимым, что имеет большое клиническое значение при наличии у пациента инсулинорезистентности. Антиоксидантный эффект Актовегина ассоциирован с уменьшением образования активных форм кислорода, снижением уровня каспазы-3 и активности PARP, модуляции активности ядерного фактора NF -kB, что приводит к замедлению процессов апоптоза и защите нейронов от гибели в условиях оксидативного стресса. Антиапоптотический и антиоксидантный эффекты определяют нейропротективные влияния в эксперименте [16] и в клинической практике [1, 24, 54]. Последнее многоцентровое, двойное слепое, плацебоконтролируемое, рандомизированное клиническое исследование в параллельных группах по оценке эффективности и безопасности Актовегина у пациентов с СД 2-го типа и клиническими проявлениями ДПН продемонстрировало улучшение состояния ДПН по шкале «Общий балл симптомов» (TSS, Total Symptom Score) с сравнительной оценкой 4-х отдельных симптомов: стреляющей боли, жгучей боли, парестезии и онемения; порога вибрационной чувствительности и улучшения качества жизни при хорошей переносимости препарата (рис. 6). Важно отметить, что снижение порога вибрационной чувствительности является прогностическим фактором будущего риска развития диабетических язв стопы, а повышение порога вибрационной чувствительности на 1 единицу увеличивает риск развития первой язвы стопы на 5,6% [3]. В исследовании D. Ziegler и соавт. порог вибрационной чувствительности снизился на 3,5 балла по оценке с использованием биотензиометра, что при пересчете позволяет утверждать, что терапия Актовегином снижает риск развития язв стопы на 17,5%.
Поражения стоп у пациентов с СД нередко сопровождаются возникновением язвенных дефектов, заживление которых связано с большими трудностями вследствие смешанного характера повреждений (нейропатический и ишемический). Включение Актовегина в комплексную терапию в виде различных лекарственных форм (парентеральное введение и местная терапия с использованием геля) больных с синдромом диабетической стопы и язвенными дефектами приводило к ускорению сроков регенерации и достижению восстановления функционального состояния тканей. Российские авторы выявили снижение среднесуточного уровня гликемии с первых суток применения Актовегина и, как следствие, – снижение суточной потребности в инсулине; отмечена быстрая ликвидация болевого синдрома (на 2–3-е сутки); усиление процессов грануляции и эпителизации ран с уменьшением площади язвенного дефекта, заживление последних в среднем на 7–8-е сутки [2].
В ряде крупномасштабных исследований показано, что у больных СД повышен риск развития когнитивных нарушений. Так, когнитивные нарушения при СД 2-го типа регистрируются у 20–40% пациентов в более молодом возрасте по сравнению с лицами без СД. Когнитивные нарушения при СД являются результатом взаимодействия различных патогенетических факторов – метаболических, сосудистых, включая поражение микроциркуляторного русла, эндокринных и неврологических. Получены доказательства наличия микроваскулярной патологии при развитии деменции: по данным магнитно-резонансной томографии выявляются характерные изменения (лейкоареоз, лакунарные инфаркты, микрогеморрагии, церебральная атрофия, в том числе атрофия корковых структур и т.д.), утолщение базальных мембран капилляров, что приводит к снижению церебрального кровотока. Учитывая многофакторный характер нарушений, определяющий возникновение и развитие когнитивного дефицита при СД, в лечении обосновано использование таких средств, которые имеют наибольшее количество точек приложения. Одним из препаратов для лечения подобных нарушений может быть Актовегин, который обеспечивает улучшение микроциркуляции, обусловленное увеличением кислородного насыщения, нормализацией эндотелийзависимых реакций и снижением периферического сосудистого сопротивления, минимизацией проявлений оксидативного стресса, мобилизацией поступления кислорода в клетки головного мозга и церебральных сосудов, улучшением реологических свойств крови. Дополнительные нейропротективные свойства (поддержание жизнеспособности нейронов, уменьшение апоптоза, увеличение общего числа синаптических связей и снижение выраженности окислительного стресса) обосновывают его применение при постишемических когнитивных нарушениях [16, 31]. Недавно завершившееся рандомизированное клиническое исследование ARTEMIDA (A Randomized Trial of Efficacy, 12 Months International Double-blind Actovegin) продемонстрировало улучшение когнитивных функций у пациентов после перенесенного ишемического инсульта [19].
Значимое место в патогенетической терапии ДПН занимает применение витаминов группы В, обладающих нейротропным эффектом. Использование препаратов витаминов группы В обосновывается подтвержденным дефицитом тиамина и других витаминов этой группы при СД [48].
Доказано, что витамины группы В (тиамин, пиридоксин, фолиевая кислота, цианокобаламин) оказывают метаболические эффекты, включающие и уменьшение болевого синдрома. Биологическое значение тиамина (витамин B1) обусловлено действием его производного тиаминдифосфата (ТДФ), являющегося коферментом ряда ферментов, играющих значительную роль в углеводном обмене, и блокирующего несколько альтернативных путей метаболизма глюкозы, принимающих участие в формировании гипергликемических нарушений. Тиамин активирует транскетолазу, способствуя утилизации глюкозы через более безопасный пентозофосфатный цикл, ингибируя полиоловый (сорбитоловый), гексозаминовый пути, активацию протеинкиназы C и формирование КПГ [55]. В итоге активации пентозофосфатного цикла увеличивается синтез пиримидиновых нуклеотидов, которые играют важную роль в синтезе фосфолипидов, сфинголипидов (сфингомиелина) и гликопротеидов (рис. 5). Существующие формы витамина В1 включают возможности использования тиамина и бенфотиамина, который по способности проникать в клетку через липофильные мембраны превосходит водорастворимые формы, что определяет его терапевтические преимущества.
Физиологически активная форма пиридоксина (витамин В6) – пиридоксальфосфат, являясь коферментом более чем 100 ферментов, регулирует реакции декарбоксилирования и трансаминирования аминокислот в нервной и других тканях, обеспечивает нормализацию белкового обмена и препятствует накоплению избыточных количеств нейротоксичного аммиака, что приводит к оптимизации деятельности нервной ткани.
Фолиевая кислота (витамин В9) осуществляет перенос одноуглеродных групп (метильных и формильных), посредством чего принимает участие в биосинтезе нейротрансмиттеров, фосфолипидов, гемоглобина посредством влияния на синтез пурина и пиримидина, ДНК и отдельных аминокислот.
Витамин В12 (цианокобаламин) активирует синтез фолиевой кислоты, а его активный метаболит – метилкобаламин – восстанавливает структуру миелиновой оболочки посредством активации реакции трансметилирования, в результате которой синтезируется метионин – предшественник протеинов и фосфатидилхолина мембраны нервных клеток. Цианокобаламин также обладает выраженным анальгезирующим эффектом и уменьшает болевые ощущения, связанные с поражением периферической нервной системы.
Использование отдельных витаминов группы В имеет ряд ограничений, связанных со сложностью многокомпонентного лечения и комплаентностью пациентов, отсутствием синергизма.
Результаты использования витаминов свидетельствуют о снижении болевых ощущений, улучшении вибрационной чувствительности и возрастании скорости нейронального проведения через 3–6 недель от начала лечения [44]. Исследование BEDIP (Benfotiamine in the Treatment of Diabetic Polyneuropathy study) доказало эффективность использования бенфотиамина в течение 3 недель при ДПН: отмечено снижение счета по NDS (Neuropahy Disability Score), улучшение вибрационной чувствительности и «общего состояния» по сравнению с плацебо [43].
Несмотря на наличие различных препаратов, действие которых основывается на различных механизмах, проблема ДПН не решена до настоящего времени. В указанных выше стандартах ведения СД в 2017 году при детальном анализе сроков и методов обследования для диагностики ДПН указывается, что цель лечения сводится к устранению боли и улучшению качества жизни, а вопросы патогенетического лечения не рассматриваются вовсе. Тем не менее, потребность в лечении ДПН с различными проявлениями неврологического дефицита сохраняется.
В качестве варианта выбора рассматриваются нуклеотиды, в частности пиримидиновые нуклеотиды уридин и цитидин, обладающие способностью оказывать влияние на процессы нейрорегенерации (рис. 7). При регенерации элементов мембраны и аксонов возникает высокая потребность в синтезе или утилизации липидов и белков, что может быть обеспечено нуклеотидами, которые играют важную роль в синтезе фосфолипидов, сфинголипидов (сфингомиелина и гликолипидов) и гликопротеинов. В то же время нуклеотиды являются главными составляющими ДНК и РНК, а активная транскрипция и трансляция (синтез ДНК/РНК) способствуют делению клеток и клеточному метаболизму, а также регенерации периферического нерва. Наконец, нуклеотиды необходимы для регулировки сложного процесса миграции/присоединения шванновских клеток к аксонам требуется активация внутриклеточных и внеклеточных сигналов. Кроме того, нуклеотиды, точнее, уридин, выступает в качестве эндогенного сигнала к индукции быстрого заживления раны в случае механического повреждения периферического нерва.

В многочисленных клинических исследованиях была показана эффективность нуклеотидов (уридин, цитидин) при различных метаболических (диабетической, алкогольной) полинейропатиях, костно-суставных (при межпозвонковых радикулопатиях) и инфекционных (вирусных) поражениях нервов. Подавляющее большинство исследований было проведено с препаратами, содержащими комбинацию уридина и цитидина (Нуклео® ЦМФ форте), некоторые – с препаратами, содержащими только уридин, или комбинация уридина с витамином B12 и В9 (Келтикан® комплекс). Несмотря на различную степень фосфорилирования уридина или цитидина в составе препаратов, их эффективность базируется на наличии и количестве уридина, поскольку экзогенные нуклеотиды быстро дефосфорилируются после приема внутрь и различные соли (уридинтрифосфат, уридиндифосфат, уридинмонофосфат), а также цитидин превращаются в уридин, который оказывает нейротропное влияние, а витамины В9 и В12 только усиливают эффективность препарата.
Применение уридина в фармакологической терапии периферических осложнений СД было предложено и запатентовано М. Матерацци, В. Полити, Дж. Ди Стацио, Дж. Де Лука (Италия) в 1993 году в США. По результатам двойного слепого исследования, в группе пациентов с СД, получавших терапию уридином в течение 6 месяцев, отмечено уменьшение выраженности симптоматики ДПН. Для обоснования формулы патента проведено исследование на 40 пациентах с СД в возрасте 48,5±3,4 года с манифестными проявлениями ДПН (замедление двигательной и чувствительной проводимости по крайней мере по одному периферическому нерву); персистирующая боль в нижних конечностях; снижение порога вибрационной чувствительности. Клиническое и нейрофизиологическое обследование продемонстрировали увеличение скорости двигательной и чувствительной проводимости, которые становились значимыми на 120-й день терапии и сохранялись до окончания (180 дней) исследования и в течение 90 дней после его окончания (таблица) [18]. Аналогичные результаты были получены и в других исследованиях [34, 37].
Таблица. Среднее значение ППДВ?СО (м/c) общего малоберцового и СПЧВ?СО (м/c) икроножного нерва у пациентов с сахарным диабетом, получавших уридин (1) или плацебо (2)
|
Показатель
|
ППДВ?СО, м/c
|
СПЧВ?СО, м/c
|
|
1
|
2
|
3
|
1
|
2
|
3
|
|
На этапе отбора пациентов
|
38±1,8
|
38,4±2,3
|
р=Н.Д.
|
32,6±3,0
|
32,7±3,2
|
р=Н.Д.
|
|
Исходно
|
37,4±2,3
|
38,0±21,7
|
р=Н.Д.
|
32,8±8,2
|
33,0±2,5
|
р=Н.Д.
|
|
60-й день
|
37,7±2,2
|
38,1±2,4
|
р=Н.Д.
|
34,0±2,3*
|
32,9±2,0
|
р<0,05
|
|
120-й день
|
40,9±2,4
|
38,2±2,4
|
р<0,05
|
37,2±2,2*
|
33,4±2,6
|
р<0,005
|
|
180-й день
|
43,5±1,9
|
38,6±2,4
|
р<0,001
|
41,1±2,2*
|
33,0±2,3
|
р<0,0001
|
|
По окончании периода
наблюдения (90-й день
после окончания лечения)
|
43,0±1,4
|
38,4±2,5
|
р<0,005
|
40,1±1,7*
|
33,2±2,2
|
р<0,0005
|
Примечания: *р<0,00001 при сравнении с помощью дисперсионного анализа ANONA; 3 – статистическая значимость различий между двумя группами при сравнении с помощью t-критерия Стьюдента; Н.Д. – не достоверно.
L. Bouna Seck и соавт. при использовании комбинации нуклеотидов (цитидин-5’-монофосфат двунатриевый и уридин-5’-трифосфат тринатриевый) в 3-месячном исследовании 75 пациентов с ДПН с оценкой динамики по общепринятым шкалам и электоромиографии отметили уменьшение сенсорных нарушений (увеличилась сенсорная скорость проводимости в правом срединном нерве и левом седалищном нерве c 37,39 м/с до лечения до 40,10 м/с после лечения) при прекрасной переносимости [10].
Препараты, содержащие уридин, применяются в лечении патологии периферической нервной системы более 40 лет, однако интерес к ним не снижается. Это обусловлено уникальностью механизма действия препарата, так как по результатам исследований in vitro и in vivo были сделаны выводы о том, что нуклеотиды стимулируют синтез фосфолипидов и сфинголипидов, это подтверждает способность препарата защищать и содействовать регенерации нервных клеток. Исследования, касающиеся использования уридина, посвященные различным формам невропатий, демонстрируют уменьшение выраженности болевого синдрома при люмбаго, компрессионных невропатиях, алкогольной невропатии, мононейропатии подмышечного нерва, синдроме растяжения плечевого сплетения, неврите зрительного нерва, различных мононейропатиях и других заболеваниях периферической нервной системы [14, 15, 26, 27, 29, 35].
Отдельно следует отметить, что комплексные препараты, содержащие уридин, имеют в составе витамин В9 и В12. Актуальность включения в комплекс этих витаминов подтверждается доказательством снижения уровня витамина В12 у пациентов с СД 1-го и 2-го типов [25]. При СД 1-го типа отмечена ассоциация дефицита витамина В12 с выраженностью аутоиммунного процесса, а при СД 2-го типа – с приемом самого часто назначаемого антигипергликемического препарата – метформина. Доказано, что долгосрочный прием метформина сопровождается снижением уровня витамина В12, при этом в когорте с низким уровнем чаще регистрируются анемия и ДПН [49].
К настоящему времени не разработаны интернациональные подходы к выбору патогенетической терапии ДПН, поэтому наличие альтернативных препаратов, действие которых основано на воздействии на принципиально различные звенья патогенеза ДПН, позволяет клиницисту планировать комплексную терапию с учетом индивидуальных особенностей пациента и достигнутого терапевтического эффекта. В разных странах особенности регистрации препаратов приводят к различиям в статусе препарата. Одна и та же молекула может быть зарегистрирована как лекарственное средство или биологически активная добавка. Так, например, препараты нуклеотидов в странах Евросоюза и Украине зарегистрированы как лекарственное средство, а в Беларуси и России – как биологически активная добавка. Аналогичная ситуация сложилась и c бенфотиамином, который в США зарегистрирован как биологически активная добавка. Очевидно, что статус регистрации не влияет на свойства препаратов, которые используются в лечении различной патологии и ДПН в частности. Одной из причин, не позволяющей определить лечебные подходы для ДПН, является отличие в тактике ведения этой категории пациентов от других микроангиопатий, заключающееся в курсовой терапии против постоянной. Логично предположить, что нейротоксические влияния не подавляются полностью при курсовой терапии, а инициация терапии «по жалобам» является запоздалой и не обеспечивает обратного развития повреждения нервов. Единичные работы свидетельствуют о высокой доле невропатии при установлении диагноза СД [7] и эффективности коррекции образа жизни для уменьшения нарушений плотности внутрикожных нервных волокон, характеризующих развитие ДПН [41]. Очевидно, что инициированные в настоящее время исследования по использованию патогенетически обоснованной терапии ДПН в качестве гипотезы используют именно длительное назначение препаратов, модифицирующих метаболические нарушения в нервных волокнах (Preventative Approaches for Neuropathy in Diabetes with Alpha-lipoic Acid (PANDA Study)). Что же делать в настоящее время? При выборе тактики каузальной (патогенетической) терапии ДПН из широкого спектра альтернативных препаратов следует учитывать удобство применения, наличие коморбидной патологии, благоприятный профиль безопасности, возможность комбинирования с другими лекарственными средствами и хорошее соотношение стоимость/эффективность и продолжительность эффекта после окончания терапии.
Л И Т Е Р А Т У Р А
1. Каракулова Ю.В., Кайгородова Н.Б., Батуева Е.А. // Неврология, нейропсихиатрия, психосоматика. – 2013. – №3. – С.13–17.
2. Оболенский В.Н., Кальсин Г.А., Лаберко Л.А. Использование инфузий Актовегина в комплексном лечении больных с синдромом диабетической стопы. – М., 2002. –ё С.23.
3. Abbott C.A., Vileikyte L., Williamson S. // Diabetes Care. – 1998. – Vol.21, N7. – P.1071–1075.
4. Albers J.W., Herman W.H., Pop-Busui R., et al. // Diabetes Care. – 2010. – Vol.33, N5. – P.1090–1096.
5. Bierhaus A., Haslbeck K.M., Humpert P.M. // The Journal of Сlinical Investigation. – 2004. – Vol.114, N12. – P.1741–1751.
6. Birrell A.M., Heffernan S.J., Ansselin A.D. // Diabetologia. – 2000. – Vol.43, N1. – P.110–116.
7. Bongaerts B.W., Rathmann W., Kowall B. // Diabetes Care. – 2012. – Vol.35, N9. – P.1891–1893.
8. Boulton A.J. // Diabetologia. – 2004. – Vol.47, N8. – P.1343–1353.
9. Boulton A.J., Kirsner R.S., Vileikyte L. // NEJM. – 2004. – Vol.351, N1. – P.48–55.
10. Bouna Seck L., Basse А., Hachim Cissé El. // International Journal of Medicine and Medical. – 2015. – Vol.5, N8. – P.284–287.
11. Boussageon R., Bejan-Angoulvant T., Saadatian-Elahi M. // BMJ. – 2011. – P.343.
12. Brussee V., Cunningham F.A., Zochodne D.W. // Diabetes. – 2004. – Vol.53, N7. – P.1824–1830.
13. Calcutt N.A., Jolivalt C.G., Fernyhough P. // Current drug targets. – 2008. – Vol.9, N1. – P.47–59.
14. Cartier L., Castillo J.L., Verdugo R. // Rev. Med. Chil. – 1996. – Vol.124, N5. – P.583–587.
15. Dzjak L.A., Mizyakina E.V., Khaitov P.A. // Ukraine Medicine. – 2007. – Vol.112. – P.11–14.
16. Elmlinger M.W., Kliebel M., Zigler D. // Neuro Molecular Medicine. – 2011. – Vol.13, N. – P.266–274.4
17. Gaede P., Vedel P., Larsen N. // N. Engl. J. Med. – 2003. – Vol. 348. – P.383–393.
18. Gallai V., Mazzotta G., Montesi S. // Acta Neurol. Scand. – 1992. – Vol.86, N1. – P.3–7.
19. Guekht A., Skoog I., Korczyn A.D. // Dement. Geriatr. Cogn. Disord. Extra. – 2013. – Vol.3. – P.459–467.
20. Hammes H.P., Du X., Edelstein D., Taguchi T. // Nature medicine. – 2003. – Vol.9, N3. – P.294–299.
21. Herrschafi H., Kunze U., Gleim F. Die // Med. Welt. – 1977. – Vol.28. – P.339–345.
22. Hotta N., Akanuma Y., Kawamori R. // Diabetes Care. – 2006. – Vol.29, N7. – P.1538–1544.
23. Ishii D.N., Lupien S.B. // Exp. Diab. Res. – 2003. – Vol.4, N4. – P.257–269.
24. Jansen W., Beck E. // Med. Welt. – 1987. – N38. – P.838–841.
25. Kibirige D., Mwebaze R. // J. Diabetes Metab. Disord. – 2013. – Vol.12. – P.17.
26. Klein K.G. // Biometrischer Bericht, 1990.
27. Kretschmar S., Kaumeier W. // Fortschritte der Medizin. – 1996. – Vol.114, N32. – P.439–443.
28. Leinninger G.M., Edwards J.L., Lipshaw M.J. // Nature Clinical Practice. – 2006. – Vol.2, N11. – P.620–628.
29. Liebau C., Koch H., Merk H.R. // Orthopädische Praxis. – 2003. – Vol.39, N5. – P.320–324.
30. Little W.C., Zile M.R., Kitzman D.W. // Journal of Cardiac Failure. – 2005. – Vol.11, N3. – P.191–195.
31. Machicao F., Muresanu D.F., Hundsberger H., et al. // J. Neurol. Sci. – 2012. – Vol.322. – P.222–227.
32. Malik R.A. // Annals of Medicine. – 2000. – Vol.32, N1. – P.1–5.
33. Mizisin A.P., DiStefano P.S., Liu X. // Neuroscience Letters. – 1999. – Vol.263, N2–3. – P.149–152.
34. Muller D. // MMW Fortschr. Med. – 2002. – Vol.144, N46. – P.61.
35. Okada M., Nakagawa T., Minami M. // J. Pharmacol. Exp. Ther. – 2002. – Vol.303, N1. – P.66–73.
36. Packer L., Kraemer K., Rimbach G. // Nutrition. – 2001. – Vol.17, N10. – P.888–895.
37. Pankiv V.I. // Int. J. Endocrinol. – 2008. – Vol.6, N18. – P.23–25.
38. Pop-Busui R., Boulton A.J.M., Feldman E.L. // Diabetes Care. – 2017. – Vol.40. – P.136–154.
39. Shepelkevich A., Bilodid I., Grigorovich A., et al. // EASD Annual Meeting, Stockholm, 2015.
40. Singh U., Jialal I. // Nutr. Rev. – 2008. – Vol.66, N11. – P.646–657.
41. Smith A.G., Russell J., Feldman E.L. // Diabetes Care. – 2006. – Vol.29, N6. – P.1294–1299.
42. Stevens M.J., Li F., Drel V.R., Abatan O.I. // The Journal of Pharmacology and Experimental Therapeutics. – 2007. – Vol.320, N1. – P.458–464.
43. Stracke H., Gaus W., Achenbach U., Federlin K. // Exp. Clin. Endocrinol. Diabetes. – 2008. – Vol.116, N10. – P.600–605.
44. Stracke H., Lindemann A., Federlin K. // Exp. Clin. Endocrinol. Diab. – 1996. – Vol.104. – P.311–316.
45. The Berlin Declaration. International Diabetes Fede-ration. – 2016 // http://www.idf.org/sites/default/files/Berlin-Declaration-Final.pdf.
46. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus //Eng. J. Med. – 1993. – Vol.329. – P.977–986.
47. The IWGDF Guidance on the management and prevention of foot problems in diabetes. – 2015.
48. Thornalley P.J., Babaei-Jadidi R., Al Ali H., et al. // Diabetologia. – 2007. – Vol.50. – P.2164–2170.
49. Vanita R., Aroda M.D. // JCEM. – 2016. DOI: http://dx.doi.org/10.1210/jc.2015-3754.
50. Vincent A.M., Edwards J.L., Sadidi M. // Current drug targets. – 2008. – Vol.9, N1. – P.94–100.
51. Vinik A.I, Bril V., Kempler P. // Clinical Therapeutics. – 2005. – Vol.27, N8. – P.1164–1180.
52. Ziegler D. // Annals of the New York Academy of Sciences. – 2006. – Vol.1084. – P.250–266.
53. Ziegler D. // Treat. Endocrinol. – 2004. – Vol.3. – P.173–189.
54. Ziegler D., Movsesyan L., Mankovsky B.,. – 2009. – Vol.32, N8. – P.1479–1484. et al. // Diabetes Care
55. Ziegler D., Strom A., Landgraf R., et al. // PROTECT Study. – Bucharest, 2016.
Медицинские новости. – 2017. – №8. – С. 11-17.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.