Внимание! Статья адресована врачам-специалистам
Vdovichenko V.P.1, Goncharuk V.V.1, Korshak T.A.1, Bronskaya G.M.2
1Grodno State Medical University, Belarus
2Gomel State Medical University, Belarus
ACE inhibitors: unity in diversity
Резюме. Все длительно действующие ингибиторы ангиотензинпревращающего фермента (АПФ) обладают сходной клинической эффективностью при сердечно-сосудистых заболеваниях, поэтому приоритет в назначении целесообразно отдавать наиболее изученным, упоминаемых в международных рекомендациях представителям этого класса, – эналаприлу и лизиноприлу. Лизиноприл способен обеспечить наилучшую, чем любые другие ингибиторы АПФ, комплаентность пациентов вследствие всегда однократного ежедневного приема.
Ключевые слова: ингибиторы АПФ, сердечно-сосудистые заболевания, лизиноприл, комплаентность пациентов.
Медицинские новости. – 2018. – №1. – С. 73–76.
Summary. All long-acting ACE inhibitors have similar clinical efficacy in cardiovascular diseases. As a consequence, priority in the appointment should be given to the most studied, mentioned in the international recommendations, representatives of this class – enalapril and lisinopril. Lizinopril is able to provide the best, than any other ACE inhibitors, patient compliance, due to always a single daily intake.
Keywords:ACE inhibitors, cardiovascular diseases, lisinopril, patient compliance.
Meditsinskie novosti. – 2018. – N1. – P. 73–76.
Группа ингибиторов ангиотензинпревращающего фермента (АПФ) представлена на фармацевтическом рынке разных стран мира следующими веществами: каптоприл, эналаприл, лизиноприл, фозиноприл, квинаприл, рамиприл, периндоприл, трандолаприл, спираприл, беназеприл, цилазаприл, моэксиприл, зофеноприл. Из них сегодня в Беларуси зарегистрированы эналаприл, лизиноприл, фозиноприл, рамиприл, периндоприл, трандолаприл, зофеноприл. Этот класс лекарственных средств является одним из лидеров фармакотерапии в кардиологии многих стран мира, включая и нашу республику [1]. Естественно, такое разнообразие порождает закономерный вопрос: какой (или какие) представитель этого класса лучше/хуже? Причем, ответ имеет важное практическое значение, так как обеспечение наиболее качественного лечения является, по сути, целью практической медицины. Анализ фармакологических свойств, а также результатов контролируемых клинических испытаний различных ингибиторов АПФ позволит ответить на поставленный вопрос (каптоприл как вещество кратковременного действия с фармакокинетическим профилем, отличным от остальных длительно действующих представителей данного класса лекарственных средств, в данном обзоре рассматриваться не будет).
Обзор фармакологических свойств ингибиторов АПФ
Как известно, основное действие этих веществ на систему ренин-ангиотензин – это ингибирование превращения ангиотензина I в ангиотензин II. Таким образом, их основные фармакологические и терапевтические эффекты связаны с подавлением синтеза эндогенного вазопрессорного вещества – ангиотензина II [2, 3]. Следует также принимать во внимание, что АПФ взаимодействует со многими субстратами, поэтому ингибирование АПФ вызывает и другие эффекты: повышение в организме уровня брадикинина, который стимулирует биосинтез простагландинов. Брадикинин и/или простагландины могут усиливать фармакологическое действие ингибиторов АПФ [2, 3].
Ингибиторы АПФ отличаются по трем свойствам:
1) по силе действия;
2) по тому, является ли ингибирование АПФ эффектом самого вещества или его активного метаболита;
3) по фармакокинетическим различиям отдельных веществ (по степени их всасывания из желудочно-кишечного тракта, по влиянию пищи на степень их всасывания, по плазменному периоду полувыведения (ТЅ), по особенностям распределения в тканях и механизмах элиминации) [2, 3].
Среди всех ингибиторов АПФ только лизиноприл является активным лекарством, не подвергается метаболизму и выводится с мочой в неизмененном виде. Все другие ингибиторы АПФ представляют собой пролекарства, которые становятся активными путем гидролиза эфирной связи в печени [4]. Пролекарства, как таковые, могут иметь замедленное начало действия и быть подвержены индивидуальному генетическому полиморфизму, что влияет на метаболизм данного средства. Что касается конкретно ингибиторов АПФ, пролекарства могут иметь несколько замедленный пик (4–6 часов) ингибирования АПФ и время снижения артериального давления (АД) после их приема [5, 6].
Отличительная особенность лизиноприла – длительный период полувыведения (12,6 часа), что позволяет назначать его всегда 1 раз в сутки. Ингибиторы АПФ заметно различаются особенностями распределения в тканях. Лизиноприл – единственный гидрофильный ингибитор АПФ. Он не связывается с белками плазмы. За исключением фозиноприла и спираприла, которые элиминируются в равной степени и через почки, и через печень, все остальные ингибиторы АПФ элиминируются через почки. Таким образом, при тяжелой почечной недостаточности выведение вышеуказанных веществ снижается, что требует соответствующего уменьшения их дозы [2].
При артериальной гипертензии (АГ) ингибиторы АПФ в оптимальных дозах и интервалах дозирования не имеют существенных клинических различий в эффективности [3]. При хронической сердечной недостаточности (ХСН) для замедления прогрессирования дисфункции левого желудочка, прогрессирования ХСН и уменьшения смертности с сопоставимой эффективностью могут применяться любые ингибиторы АПФ [3]. Было обнаружено, что при ХСН в миокарде повышается локальная активность ангиотензина II, вероятно, обусловленная повышенной активностью АПФ и даунрегуляцией ангиотензин II-рецепторов [7]. В связи с этим возникла гипотеза: липофильные ингибиторы АПФ с высоким сродством к АПФ (периндоприл 8 мг/день и квинаприл 40 мг/день) будут вызывать более выраженную блокаду ангиотензина II в сердце и продукцию альдостерона, чем гидрофильный ингибитор АПФ с низким сродством к АПФ (лизиноприл 20 мг/день). Когда было обнаружено, что в коронарном синусе и корне аорты уровни ангиотензина II и альдостерона не отличались в обеих группах, то исследование закончили досрочно, поскольку стало ясно, что гипотеза не подтвердилась. Таким образом, гидрофильный ингибитор АПФ лизиноприл так же эффективен в блокаде ренин-ангиотензин-альдостероновой системы в сердце, как и липофильные периндоприл и квинаприл [8].
Результаты контролируемых клинических испытаний различных ингибиторов АПФ
Прямых сравнений (Head-to-head clinical trials) ингибиторов АПФ, которые могли бы убедительно доказать преимущество одного или нескольких представителей этого класса лекарственных средств над другими при АГ и ХСН, нет [9]. Контролируемые исследования эффективности ингибиторов АПФ при АГ и ХСН отличаются друг от друга по дизайну, разнородны по характеристикам пациентов, а при АГ включают в себя лекарственные препараты других классов антигипертензивных средств [9]. Поэтому делать выводы о превосходстве одного или нескольких ингибиторов АПФ над другими нет оснований, хотя ряд публикаций постулируют обратную точку зрения. Ниже, в качестве примера, приведен анализ некоторых наиболее известных контролируемых исследований.
В сравнительном исследовании периндоприл и эналаприл назначались в виде монотерапии или комбинировались с другими гипотензивными средствами (диуретики, ,бета-адреноблокаторы, антагонисты кальция, средства центрального действия) или назначались вместо любого ингибитора АПФ или блокатора рецепторов ангиотензина II [10]. Понятно, что при этом не могли быть сформированы однородные группы сравнения периндоприл – эналаприл. Прослеживается и другая неоднородность в подходах к лечению, например, указано, что «в группе периндоприла диуретик был добавлен через 4 недели лечения у 49,9% (курсив авторов) и через 8 недель – у 55,4% больных; в группе эналаприла через 4 недели – только у 1,3% (продолжали титрование дозы эналаприла) и через 8 недель – у 59,2%» [10]. Абсолютно закономерно, что при таком подходе к комбинированию с диуретиками снижение АД было «более быстрое и более выраженное на фоне приема периндоприла» [10].
Косвенным свидетельством терапевтических различий отдельных представителей класса ингибиторов АПФ могли бы служить результаты контролируемых исследований их применения при ИБС. Однако полученные данные противоречивы.
В плацебо-контролируемом мультицентровом исследовании HOPE изучалось влияние рамиприла на заболеваемость и смертность у пациентов с высоким риском развития сердечно-сосудистых событий, как на всю популяцию пациентов в целом, так и на обширную диабетическую подгруппу [11]. Исследование было прекращено досрочно через 4,5 года из-за убедительных доказательств эффективности лечения рамиприлом в предупреждении смерти от сердечно-сосудистых заболеваний, нефатального инфаркта миокарда (ИМ) и нефатального инсульта (14% против 17,8% – рамиприл и плацебо соответственно, относительное снижение риска – 22%, р<0,001). Это включало снижение риска на 32% для инсульта, 20% – для ИМ, 26% – для смерти от сердечно-сосудистых заболеваний и 16% – для смертности от всех причин, а также снижение риска нескольких других конечных точек, включая сердечную недостаточность. Результаты среди 3577 пациентов с диабетом были еще более поразительными, с сокращением риска развития сердечно-сосудистых событий на 25% [11]. Однако доказательств, что исследование HOPE отражает именно уникальные особенности рамиприла, а не класс-эффект всех ингибиторов АПФ, нет [12]. Тем более, что другое исследование рамиприла (DREAM), где его назначали пациентам в течение 3 лет для предупреждения сахарного диабета и снижения смертности, не дало позитивных результатов, хотя и статистически достоверно повышало вероятность достижения нормогликемии [13].
В обширном (13 655 пациентов) и длительном (октябрь 1997 г. – июнь 2000 г., с последующим наблюдением пациентов 4,2 года) исследовании EUROPA изучалось влияние периндоприла на сердечные исходы (смертность от сердечно-сосудистых причин, инфаркт миокарда, остановка сердца) у лиц со стабильной ИБС и не имеющих при этом ХСН [14]. Пациенты принимали и иные лекарственные средства: антиагреганты (92%), бета-адреноблокаторы (62%) и гиполипидемические средства (58%). При этом сделан вывод, что периндоприл достоверно (95% ДИ 9–29, p=0,0003) снижал относительный риск неблагоприятных исходов на 20% [14].
Результаты исследования PEACE резко диссонируют с результатами HOPE и EUROPA. В рандомизированном двойном слепом плацебо-контролируемом исследовании, в котором 8290 пациентам назначали либо трандолаприл, либо плацебо, проверялась гипотеза о том, что лица со стабильной ИБС и нормальной или слегка уменьшенной функцией левого желудочка могут извлечь выгоду из добавления ингибиторов АПФ к традиционной терапии. После наблюдения за пациентами в течение 4,8 года обнаружено, что частота наступления сердечно-сосудистой смертности, нефатального инфаркта миокарда и коронарной реваскуляризации в группе трандолаприла почти не отличалась от таковой в группе плацебо [15].
В исследовании QUIET проверялась гипотеза, что квинаприл может снижать частоту возникновения ишемических событий (частоту смертности от сердечно-сосудистых причин, остановку сердца с последующими реанимационными мероприятиями, нефатальный инфаркт миокарда, коронарную ангиопластику и шунтирование, госпитализацию по поводу стенокардии) и ангиографически подтвержденное прогрессирование поражения коронарных сосудов у пациентов без дисфункции левого желудочка. К сожалению, эта гипотеза не подтвердилась – квинаприл существенно не влиял, ни на вышеперечисленные сердечно-сосудистые исходы, ни на прогрессирование поражения коронарных сосудов [16].
Попытки найти преимущества иных ингибиторов АПФ над «классическими» (эналаприл и лизиноприл) при их сравнении в монотерапии сердечно-сосудистой патологии также оказались безуспешными. В качестве примера приведем мета-анализ сравнения эффективности периндоприла и эналаприла в лечении систолической сердечной недостаточности. Для мета-анализа были отобраны три исследования со 116 пациентами и сделаны вполне однозначные выводы о якобы превосходстве периндоприла: «У пациентов с систолической сердечной недостаточностью периндоприл, по сравнению с эналаприлом, значительно улучшает активность сердечной симпатической нервной активности, уровень натрийуретического пептида мозга и функциональный класс, согласно критериям New York Heart Association. Кроме того, когда пациентов переводили с эналаприла на периндоприл, фракция выброса левого желудочка через 6 месяцев была значительно больше» [17]. Однако ниже авторы сообщают, что для анализа не использовались «твердые» точки, принятые в кардиологии (показатель смертности от сердечно-сосудистых причин и др.), а лишь «суррогатная» точка (фракция выброса левого желудочка). Как данная «суррогатная» точка влияет на исходы лечения, неясно. В работе также отмечено, что число пациентов было недостаточно большим. Поэтому авторы пишут, что необходимы более обширные и длительные исследования для окончательного и бесспорного подтверждения этих выводов [17]. Получается, что вывод о превосходстве периндоприла над эналаприлом сделан необоснованно.
Исходя из вышеизложенного, при анализе фармакологических особенностей ингибиторов АПФ и их клинической эффективности, нет оснований утверждать, что иные представители этого класса (в частности, периндоприл и рамиприл) в чем-либо превосходят «классические» (эналаприл и лизиноприл). Во всяком случае, бесспорных доказательств на этот счет к настоящему времени нет. Это подтверждается также тем, что наиболее авторитетные руководства по клинической фармакологии и фармакотерапии не приводят различий отдельных длительно действующих ингибиторов АПФ, а характеризуют их свойства, как класс – эффект [2, 18, 19]. В рекомендациях «Основные принципы лечения высокого кровяного давления у взрослых, основанных на данных доказательной медицины», разработанных членами группы экспертов, выбранными Восьмым Объединенным национальным комитетом США (JNC 8) 2014 года из ингибиторов АПФ упоминаются каптоприл и два длительно действующих («классических») ингибитора АПФ: эналаприл (5–10 мг в день за 1–2 приема) и лизиноприл (10–40 мг в день за 1 прием). Очевидно, что таким образом они де-факто рассматриваются как основные, базовые представители этого класса антигипертензивных лекарственных средств, на которые и должны ориентироваться практические врачи [20].
По применению эналаприла и лизиноприла существует солидная база клинических исследований. В качестве примера в связи с ограниченностью объема статьи можно привести лишь некоторые. В контролируемом многоцентровом рандомизированном проспективном исследовании гипотензивного эффекта при монотерапии лизиноприлом (диротоном) в суточной дозе 10 или 20 мг выявлено, что его назначение позволяет полностью нормализовать среднесуточные значения АД у 52,3% мужчин и 46,6% женщин [21]. Хотя гипотензивная эффективность лизиноприла в целом не зависит от времени приема препарата, однако его назначение вечером позволяет существенно уменьшить число пациентов с типом night picker, преимущественно у женщин [21]. При этом эффективность монотерапии в нормализации АД лизиноприлом (диротоном) была аналогична результатам, полученным в международных исследованиях иных ингибиторов АПФ: фозиноприла (исследование FАСЕТ – у 55% пациентов) и квинаприла (исследование EUREKA – у 55% пациентов) [21–23]. Сердечно-сосудистые заболевания, которые лечатся ингибиторами АПФ, нередко сочетаются у пожилых пациентов с болезнями опорно-двигательного аппарата, что вынуждает принимать также и нестероидные противовоспалительные средства (НПВС) [24]. При этом эффективность ингибиторов АПФ снижается, так как НПВС блокируют вызванную брадикининами вазодилятацию, которая, по крайней мере частично, опосредуется простагландинами [18]. Поэтому представляет практический интерес изучение влияния НПВС (ибупрофен, индометацин) на антигипертензивную активность различных представителей ингибиторов АПФ: эналаприла – пролекарственной формы препарата, требующего первичной биотрансформации в печени, и лизиноприла – активного препарата, не требующего метаболической активации [24]. Обнаружено, что лечение лизиноприлом сопровождается меньшим риском НПВС-индуцированного снижения антигипертензивного эффекта, чем лечение эналаприлом, что делает предпочтительным применение лизиноприла при необходимости сочетания ингибитора АПФ и НПВС [24].
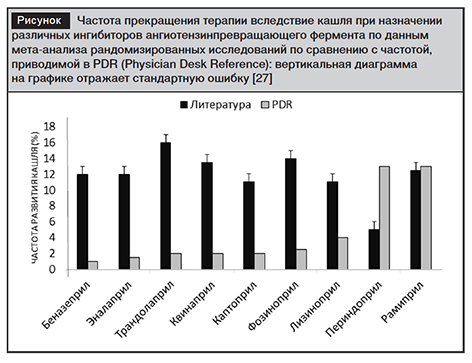
Немаловажный практический интерес представляет вероятность типичного побочного эффекта ингибиторов АПФ – сухого кашля, вызываемого при назначении различных представителей этого класса веществ. Если судить по данным частоты прекращения терапии вследствие кашля по результатам мета-анализа рандомизированных исследований, то может сложиться мнение, что существенные отличия в выраженности кашля между отдельными представителями этого класса веществ несомненны (рисунок) [25]. Однако авторы данного исследования делают иное заключение: «любое прямое сравнение чревато ошибками, связанными с гетерогенностью в когортах пациентов, размере групп, длительности терапии и способах сообщения о наличии кашля (заполняют ли пациенты специальный опросник или же сами сообщают о наличии кашля). Поэтому лучший способ оценки – проведение рандомизированного сравнения отдельных ингибиторов АПФ» [25]. Как указывалось выше, таких сравнений, к сожалению, пока нет.
J.B. Kostis отметил, что вместо того, чтобы «анализировать различия между ингибиторами АПФ по биохимическим и физиологическим свойствам, результатам опытов на животных и промежуточным точкам исследования, практика должна руководствоваться результатами рандомизированных контролируемых клинических испытаний, указывающих на полученный терапевтический эффект и дозировки ингибитора АПФ, при которых он достигается» [9].
По всем вышеупомянутым причинам при отсутствии доказанных различий при сравнении ингибиторов АПФ как по эффективности, так и риску возникновения кашля, приоритет в назначении следует отдавать «классическим», то есть наиболее изученным, упоминаемым в международных рекомендациях, представителям этого класса – эналаприлу и лизиноприлу. Следует также принимать во внимание, что, поскольку АГ лечится пожизненно, то приверженность к лечению (комплаентность) пациентов является важнейшим фактором экономической эффективности длительной терапии, так как при ее неэффективности резко увеличиваются затраты на лечение осложнений АГ и на госпитализацию больных [26]. Комплаентность при лечении АГ в значительной степени определяется простотой дозирования конкретного лекарства и выраженностью его побочных реакций [26]. В этой связи лизиноприл более предпочтителен, поскольку назначается всегда 1 раз в день вне зависимости от приема пищи [27].
Выводы:
1. Все длительно действующие ингибиторы АПФ обладают сходной клинической эффективностью при различных сердечно-сосудистых заболеваниях.
2. Приоритет в назначении следует отдавать «классическим», то есть наиболее изученным, упоминаемым в международных рекомендациях, представителям этого класса – эналаприлу и лизиноприлу.
3. Лизиноприл способен обеспечить наилучшую, чем любые другие ингибиторы АПФ, комплаентность пациентов, так как только он принимается строго 1 раз в день.
Л И Т Е Р А Т У Р А
1. Вдовиченко В.П. Фармакоэпидемиологическая и фармакоэкономическая оценка лечения артериальной гипертензии: Монография. – Гродно, 2012. – 344 с.
2. Brunton, L.L. The Pharmacological Basis of Therapeutics / L.L. Brunton, B.A. Chabner, B.C. Knollmann. – N. Y., 2011.
3. Kostis J.B. // Am. Heart J. – 1988. – Vol.116, N6. – P.1580–1591.
4. Reid J.L. // Eur. Heart J. – 1997. – Vol.18. – E14–E18.
5. Ulm E.H., Hichens M., Gomez H.J. // Br. J. Clin. Pharmacol. – 1982. – Vol.14. – P.357–362.
6. MacFadyen R.J., Lees K.R., Reid J.L. // Drugs. – 1990. – Vol.39. – P.49–63.
7. Dzau V.J. // Arch. Intern. Med. – 1993. – Vol.153. – P.937–942.
8. Ruzicka M., Coletta E., White R., et al. // Am. J. Hypertens. – 2010. – Vol.23, Is.11. – P.1156.
10. Карпов Ю.А., Деев А.Д. // Кардиология. – 2007. – №7. – С.35–40.
11. Sleight P. // J. Renin Angiotensin Aldosterone Syst. – 2000. – Vol.1, N1. – P.18–20.
12. Sica D.A. // Current Opinion in Nephrology and Hypertension. – 2001. – Vol.10, Is.5. – P.597–601.
13. Bosch J., et al. // N. Engl. J. Med. – 2006. – Vol.12, N355. – P.1551–1562.
14. Fox K.M., et al. // Lancet. – 2003. – Vol.6, N362. – P.782–788.
15. Braunwald E. // N. Engl. J. Med. – 2004. – Vol.11, N351. – P.2058–2068.
16. Pitt B., et al. // Am. J. Cardiol. – 2001. – Vol.1, N87. – P.1058–1063.
17. DiNicolantonio J.J., et al. // Ochsner J. – 2014. – Vol.14, N3. – P.350–358.
18. Katzung B.G. Basic & Clinical Pharmacology. – McGraw-Hill, 2018.
19. Tarascon Pharmacopoeia. Jones & Bartlett Learning, 2017. – P.121–123.
20. Paul A.J., et al. // JAMA. – 2014. – Vol.311, N5. – P.507–520.
21. Глезер М.Г. // Проблемы женского здоровья. – 2007. – №2(1). – С.5–14.
22. Tatti P., Pahor M., Buington R.P., et al. // Diabetes Care. – 1998. – Vol.21. – P.597–603.
23. Pueyo C., Diaz C., Sol J.M., Masramon X., Hernandez G. // Clin. Drug. Invest. – 2000. – Vol.20. – P.81–88.
24. Савенков М.П., Бродская С.А., Иванов С.Н., Судакова Н.И. // РМЖ. – Т.11, №19. – 2003. – С.1056–1059.
25. Sripal Bangalore, et al. // Артериальная гипертензия. – 2011. – №2(16). – С.51–65.
26. Flack J.M, Novicov S.V., Ferrario C.M. // Europ. Heart. J. – 1996. – Vol.17. – P.16–20.
27. Wijk B.L. // J. Hypertens. – 2004. – Vol.22, N9. – P.1831–1837.
Медицинские новости. – 2018. – №1. – С. 73-76.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.