Внимание! Статья адресована врачам-специалистам
Comparative evaluation of results
of serological investigations during Helicobacter pylori-associated gastritis
Резюме. Представлена сравнительная оценка результатов серологических исследований при Helicobacter pylori-ассоциированных гастритах. Были обследованы образцы крови и испражнения 108 больных гастритом (64 мужчины и 44 женщины). Антитела к H. pylori в сыворотке крови определялись стандартным иммуноферментным анализом (ИФА) и экспресс-методом, антигены в испражнениях – экспресс-методом. Методом ИФА антитела к H. pylori были выявлены в крови 56 (51,8%) пациентов, у 52 (48,2%) – был отрицательный результат. Таким образом, приблизительно у половины больных с гастритом в сыворотке крови выявляются антитела к H. pylori. Основную долю антител к патогену в сыворотке крови составляют иммуноглобулины класса IgG. Экспресс-тест на антитела в большинстве случаев подтверждает результаты ИФА. Экспресс-тест на определение антигенов H. pylori в испражнениях имеет низкую чувствительность.
Ключевые слова: Helicobacter pylori, иммуноферментный анализ, экспресс-тест на антитела, экспресс-тест на антигены.
Медицинские новости. – 2018. – №3. – С. 82–84.
Summary. Comparative evaluation of serological investigation in H.pylori-associated gastritis. Stool and blood samples of 108 patients (64 males and 44 females) were examined. Antibodies against H. pylori in serum were detected using standard enzyme immunoassay analysis (EIA) and express test while antigens in stool specimens – by express-test. Out of 108 patients in 56 (51.8%) were detected antibodies by EIA. Remaining 52 (48.2%) samples were negative. Thus, antibodies against H. pylori appears in plasma of approximately 50% patients. The majority of antibodies are IgG class antibodies. In majority of cases express-test confirms results of EIA. Express-test for antigen detection in stool specimens has low sensitivity.
Keywords: Helicobacter pylori, enzyme immunoassay, antigen express-test, antibody express-test.
Meditsinskie novosti. – 2018. – N3. – P. 82–84.
Helicobacter pylori в основном является причиной развития гастритов, а в 80% случаев – язв желудка и двенадцатиперстной кишки. Также установлена роль данной бактерии в этио-логии рака желудка [1, 2, 12].
Существует множество методов для диагностики заболеваний, вызванных H. pylori [4, 5, 6, 10]. Эти методы подразделяются на инвазивные и неинвазивные. К инвазивным относят гистологическое, микробиологическое исследование, ПЦР-исследование биоптатов и желудочного сока, взятых при эндоскопии, к неинвазивным – определение серологическим методом в сыворотке крови антител к H. pylori, дыхательный уреаза тест (ДУТ), определение антигенов H. pylori в крови, испражнениях и слюне [1, 2, 3, 11].
В настоящее время неинвазивные методы сохраняют свою актуальность. Однако определение в сыворотке крови антител не всегда дает информацию о характере гастродуоденальных инфекций, вызванных H. pylori. Кроме того, H. pylori длительное время может существовать в организме как комменсал, и титр антител в сыворотке остается повышенным длительное время после проведения антибактериальной терапии. Поэтому были предложены методы, лишенные данных недостатков и позволяющие определить антигены H. pylori в клинических материалах. В последнее время все больше используют тесты для определения антигенов H. pylori в испражнениях [7–9]. Эти тесты могут быть перспективными, учитывая их неинвазивность, простоту и возможность оценивать эффективность лечения H. pylori-инфекции.
Цель исследования – провести сравнительную оценку результатов серологических исследований при H. pylori-ассоциированных гастритах.
Материалы и методы
Были обследованы образцы крови и испражнения 108 больных гастритом (64 мужчины и 44 женщины). Антитела к H. pylori в сыворотке крови определяли стандартным иммуноферментным анализом (ИФА) и экспресс-методом, антигены в испражнениях – экспресс-методом.
С помощью ИФА определяли титры антител IgM и IgG. Для данной цели использовали наборы реактивов BC-1051 (BioCheck, Канада).
В качестве экспресс-теста на определение антител использовали GM-test (GM R-HPY Ab-1C, Голландия). При помощи этих тестов возможно в короткое время определить наличие или отсутствие антител к H. pylori. Перед проведением исследования образцы крови (сыворотка и плазма) и тесты оставляли на 15–20 минут при комнатной температуре. Тесты должны быть использованы не позднее чем через час после извлечения из пакетиков. Извлеченные из пакетиков тесты располагают на чистой и гладкой поверхности. В S-лунку добавляется 1 капля (примерно 50 мкл) сыворотки или плазмы крови, затем 1 капля буферного раствора и засекается время (таймер) (нужно следить, чтобы не было воздушных пузырьков в лунке). Результат оценивается через 10 минут. При положительном результате появляются две четко различаемые красные линии (на контрольной (C) и тест (T) зонах) (рис. 1). При негативном результате – красная линия появляется только в контрольной зоне (C). При недостоверном результате красная линия появляется только в зоне T.
Антигены H. pylori в образцах испражнений определяли с помощью экспресс-метода, когда возможно в короткое время определить наличие антигена в испражнениях. С этой целью использовали GM-test (GM R-HPY Ag-1C). Перед проведением исследований образец и тесты содержались при комнатной температуре. Взятый из нескольких частей образца материал смешивался с буферным раствором теста. Далее в S-лунку теста добавляется 3 капли (приблизительно 75 мкл) получившейся смеси и засекается время. Ожидается образование цветной линии, интерпретация результата осуществляется через 10 минут. При положительном результате появляются две четко различаемые розовые линии на зонах C и Т (рис. 2). При негативном результате линия появляется только в зоне C. При недостоверном результате линия не появляется ни в одной зоне. Такой результат бывает при допущении ошибок в технических процедурах или же по истечении срока годности реактивов.
Получены данные относительно чувствительности и специфичности используемых тестов. Чувствительность метода (ЧМ) – это соотношение числа подлинно-положительных результатов к общему числу положительных результатов.
ЧМ=ПП/ИП+ЛОx100%,
где ПП – число подлинно-положительных результатов, ЛО – число ложно-отрицательных результатов.
Следовательно с увеличением числа ложно-отрицательных результатов уменьшается чувствительность теста.
Специфичность метода (СМ) – процентное соотношение подлинно-отрицательных результатов к общему числу отрицательных результатов.
СМ=ПО/ПО+ЛПx100%,
где ПО – число подлинно-отрицательных результатов, ЛП – число ложно-положительных результатов.
Таким образом, с увеличением ложно-положительных результатов уменьшается специфичность теста [14].
Результаты и обсуждение
С помощьюметода ИФА антитела к H. pylori были выявлены в крови 56 (51,8%) больных, у 52 (48,2%) – был отрицательный результат (рис. 3). IgG был выявлен – у 49 (87,5%) пациентов, IgM – 2 (3,5%), IgG и IgM – 5 (8,9%) (рис. 4).
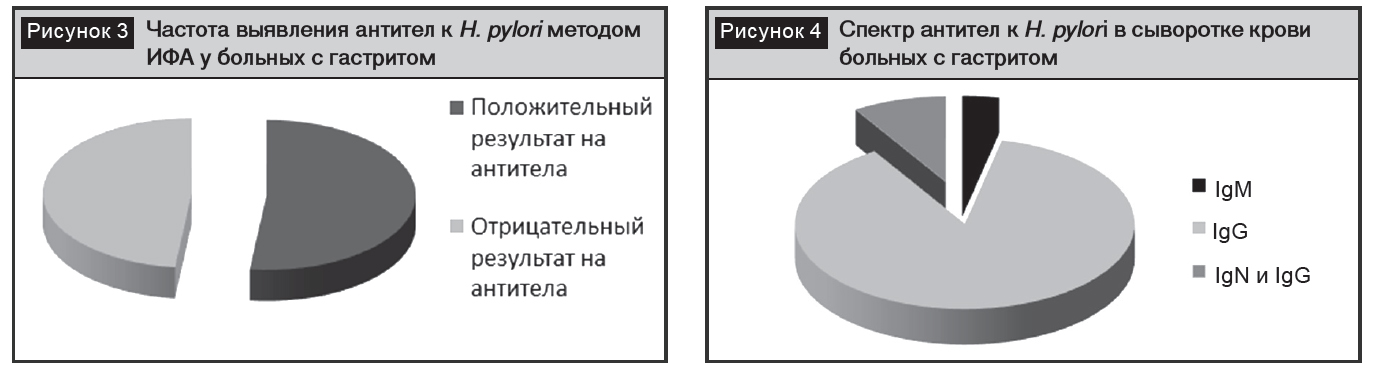
Экспресс-методом антитела к H. pylori были выявлены в крови 62 (57,5%) пациентов, у 46 (42,5%) – был отрицательный результат. Из 56 больных, у которых были выявлены антитела методом ИФА, у 48 – экспресс-тест был положительным. Иными словами, в 87,5% случаев результаты ИФА были подтверждены результатами экспресс-теста. В то же время только у 21 (37,5%) из 56 ИФА-положительных больных экспресс-тест на антигены был положительным (рис. 5).
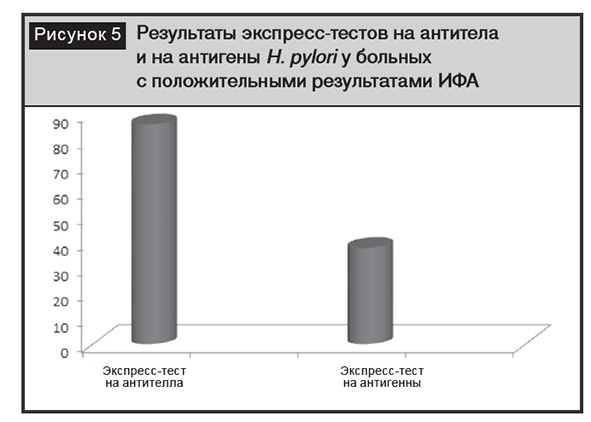
При применении экспресс-теста на антигены H. pylori в образцах испражнений положительный результат был у 26 (24%) больных, отрицательный – у 82 (75,9%). Из 62 пациентов с положительным результатом экспресс-теста на антитела только у 21 (33,9%) были выявлены антигены H. pylori в испражнениях.
В проведенных нами исследованиях специфичности ИФА и экспресс-метода на определение антител к H. pylori были 100%, чувствительности – 61,3% и 87,7% соответственно. Этот результат подтверждает данные ранее проведенного исследования, показавшего, что на ранних стадиях H. pylori-инфекции чувствительность ИФА достигает 100% [15].
Несмотря на то, что специфичность экспресс-теста на антигены H. pylori имела одинаковые с другими двумя тестами величины, чувствительность была очень низкая – 36,7%. Однако есть данные относительно высокой чувствительности (80,5%) антиген-теста у H. pylori-серопозитивных больных с хроническим атрофическим гастритом [16].
Выводы:
1. Приблизительно у половины больных с гастритом в сыворотке крови выявляются антитела к H. pylori.
2. Основную долю антител к H. pylori в сыворотке крови составляют иммуноглобулины класса G.
3. Экспресс-тест на антитела в большинстве случаев подтверждает результаты ИФА.
4. Экспресс-тест на определение антигенов H. pylori в испражнениях имеет низкую чувствительность.
Л И Т Е Р А Т У Р А
1. Qarayev Z.O., Qurbanov A.I. Tibbi mikrobiologiya v? immunologiya. – Baku, 2010. – 850 р.
2. Patrick R.Murray, Ellen Jo Baron, et al. // Manual of Clinical Microbiolgy. – 2007. – P.947–956.
3. Cemile Sonmez // Helicobacter pylori. – 2013. – P.318–327.
4. Saurabh Kumar Patel, Chandra Bhan Pratap, Ashok Kumar Jain, et al. // World J. Gastroenterol. – 2014. – Vol.20, N36. – P.12847–12859.
5. Bessède E., Arantes V., Mégraud F., Coelho L.G. // Helicobacter. – 2017. – Vol.9.
6. Yao-Kuang Wang, Fu-Chen Kuo, Chung-Jung Liu, et al. // World J. Gastroenterol. – 2015. – Vol.21, N40. – P.11221–11235.
7. Elvira Garza-González, Guillermo Ignacio Perez-Perez, Héctor Jesús Maldonado-Garza, et al. // World J Gastroenterol. – 2014. – Vol.20, N6. – P.1438–1449.
8. Stephanie A. Chisholm, Claire L. Watson, E. Louise Teare, et al. // Journal of Medical Microbiology. – 2004. – Vol.6. – P.623–627.
9. Zeki Calik, Murat Karamese, Osman Acar, Selina Aksak Karamese, et al. // Brazilian Journal of Microbiology. – 2016. – Vol.4, N7. – P.167–171.
10. Gregory Sharp // Pathology & Laboratory Medicine. – 2016. – Vol.4. – P.19.
11. Ramesh Rana, Sheng Lan Wang, Jing Li, et al. // Journal of Biomedicine. – 2017. – Vol.2. – P.12.
12. Wroblewski L.E., Peek R.M. Jr., Wilson K.T. // Clin. Microbiol. Rev. – 2010. – Vol.23, N4. – P.713–739.
13. Schwarzer A., Lottspeich C., Rüssmann H., et al. // Eur. J. Clin. Microbiol. Infect. Dis. – 2007. – Vol.26, N7. – P.475–480.
14. Diagnostic microbiology / Ed. By Ellen Jo B and Sydney M.F. – Toronto, 1991. – 861 p.
15. Pandya H.B., Patel J.S., Agravat H.H., et al. // J. Clin. Diagn. Res. – 2014. – Vol.8. – P.6.
16. Moon H.W., Lee S.Y., Hur M., et al. // Korean J. Intern. Med. – 2016. – Vol.3. – P.417–422.
Медицинские новости. – 2018. – №3. – С. 82-84.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.