Внимание! Статья адресована врачам-специалистам
Pateyuk I.V.
Belarusian State Medical University, Minsk
The potential of Candesartan in the treatment of hypertension
and chronic heart failure in comorbid patients
Резюме. Кандесартан – лекарственное средство группы блокаторов рецепторов ангиотензина II (БРА II), конкурентными преимуществами которого являются высокая селективность в отношении рецепторов первого типа к ангиотензину II, хорошая биодоступность и длительность антигипертензивного действия (в сравнении с лозартаном и рядом других БРА II). Кандесартан эффективен в лечении артериальной гипертензии и хронической сердечной недостаточности. Широкий спектр органопротективных эффектов и метаболическая нейтральность определяют целесообразность его применения у коморбидных пациентов.
Ключевые слова: блокаторы рецепторов ангиотензина II, кандесартан, артериальная гипертензия, хроническая сердечная недостаточность, коморбидность.
Медицинские новости. – 2018. – №6. – С. 43–47.
Summary. Candesartan is a drug of the angiotensin II receptor blocker group (ARB II), its competitive advantages are: high selectivity for the fist type receptors to angiotensin II, good bioavailability and duration of antihypertensive action (in comparison with losartan and a number of other ARB II). Candesartan is effective in the treatment of hypertension and chronic heart failure. A wide range of organoprotective effects and metabolic neutrality determine the feasibility of its use in comorbid patients.
Keywords: angiotensin II receptor blockers, candesartan, hypertension, chronic heart failure, comorbidity.
Meditsinskie novosti. – 2018. – N6. – P. 43–47.
Концепция «коморбидности» возникла в 70-х годах прошлого столетия. Согласно ей, в зависимости от возможности влиять на течение основного (индексного) заболевания, одному патологическому состоянию отводилось центральное положение, другим – второстепенное [1]. В действительности же коморбидные заболевания оказывают взаимное влияние, поэтому на современном этапе под коморбидностью понимают сочетание у пациента двух или более хронических заболеваний, этиопатогенетически взаимосвязанных между собой и/или совпадающих по времени появления вне зависимости от активности каждого из них. Таким образом, важный акцент ставится на сходстве этиологических факторов, единстве патогенетических механизмов коморбидных заболеваний; и в то же время не выделяется «привилегированность» положения основного заболевания, что в корне меняет подход к проблеме ведения пациента с коморбидностью [1, 2]. Высокая коморбидность характерна для лиц пожилого и старческого возраста, распространенность которой среди людей старше 65 лет достигает 60%, среди лиц старше 85 лет составляет более 80%. В структуре заболеваемости превалируют хронические неинфекционные заболевания, при этом у большинства пациентов имеет место сердечно-сосудистая коморбидность [2–5].
Последовательность развития сердечно-сосудистых заболеваний (ССЗ) может быть представлена в виде континуума – цепи событий, которые начинаются с реализации факторов риска и заканчиваются развитием ишемической болезни сердца, хронической сердечной недостаточности (ХСН), как исхода – смерти (рис. 1) [5–7].
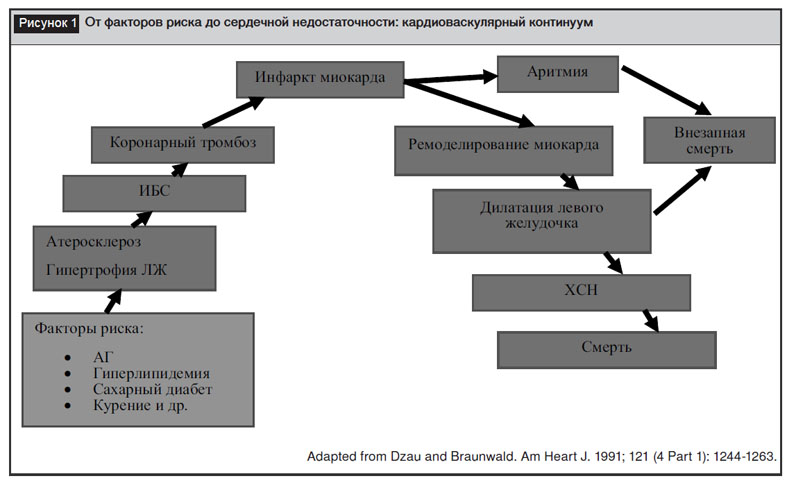
Повышение активности ренин-ангиотензин-альдостероновой системы (РААС) является не только звеном патогенеза артериальной гипертензии (АГ), а одним из патогенетических механизмов, лежащих в основе сердечно-сосудистой коморбидности. Роль РААС прослеживается на всех этапах кардиоваскулярного континуума, именно поэтому важным компонентом терапии является применение лекарственных средств, блокирующих активность системы. Ингибиторы ангиотензинпревращающего фермента (иАПФ) и блокаторы рецепторов ангиотензина II (БРА II) воздействуют на РААС через подавление эффектов ангиотензина II, с которым связывают не только повышение артериального давления, но и дисфункцию эндотелия, активацию процесса клеточного роста, сосудистого воспаления, свертывающей системы крови, оксидативного стресса [8, 9]. ИАПФ блокируют образование ангиотензина II и его эффекты, реализуемые как через рецепторы первого типа, так и второго типа; действие БРА II направлено на блокаду рецепторов первого типа к ангиотензину II, через которые и осуществляются все негативные эффекты этого биологического агента; при этом остается возможной стимуляция рецепторов второго типа, что приводит к благоприятным эффектам (антипролиферативному, вазодилатирующему), нет феномена «ускользания» [10]. Сравнению эффективности иАПФ и БРА II посвящено несколько крупных мета-анализов, результаты которых выявили сходные способности снижать повышенное артериальное давление и положительно влиять на частоту коронарных событий. Преимущества БРА II, прежде всего, были связаны с их лучшей переносимостью, более высокой приверженностью к терапии среди пациентов с АГ [11, 12].
Клиническая эффективность БРА II определяется фармакокинетическими особенностями: степенью селективности в отношении рецепторовпервого типа к ангиотензину II, биодоступностью и длительностью антигипертензивного эффекта. Бесспорными конкурентными преимуществами кандесартана являются высокая селективность в отношении рецепторов первого типа к ангиотензину II (сродство к этому типу рецепторов в 10 тысяч раз больше, чем к рецепторам второго типа); хорошая биодоступность, а также, что важно для реальной клинической практики, длительность его антигипертензивного действия [13–15]. Так, в исследовании J-TOP (JapanMorningSurge-TargetOrganProtection) было продемонстрировано одинаковое снижение уровня ночного артериального давления (АД) при назначении кандесартана в утренние и вечерние часы [16]. Известно, что риск развития инсульта у лиц с утренним повышением АД выше, чем у лиц с нормальным АД. При увеличении разницы между утренним и вечерним АД на 10 мм рт.ст. риск возникновения инсульта возрастает на 24% [17]. Кандесартан лучше, чем другие БРА II (телмисартан, валсартан, олмесартан или лозартан), предотвращает раннее утреннее повышение АД [18, 19].
О длительности антигипертензивного действия кандесартана свидетельствует исследование остаточного эффекта на фоне 48-часового пропуска приема лекарства. Перерыв в приеме препарата по данным суточного мониторирования не сопровождался значимым повышением АД [20]. В исследованиях CLAIM Iи CLAIM II при лечении кандесартаном (32 мг/сутки) было зарегистрировано более выраженное снижение систолического (САД) и диастолического (ДАД) артериального давления, чем при приеме лозартана (100 мг/сутки) [21, 22]. О большей антигипертензивной эффективности кандесартана свидетельствует мета-анализ данных 12 клинических исследований, в которых приняли участие 3644 пациента. Согласно полученным результатам, в сравнении с лозартаном кандесартан создавал дополнительное достоверное снижение САД и ДАД на 2,97 и 1,79 мм рт.ст. соответственно, кроме того отмечалась лучшая переносимость: было зарегистрировано меньше серьезных побочных эффектов(относительный риск ОР=0,48; 95% ДИ 0,25–0,92; p=0,03) [23].
Ключевой целью лечения ССЗ является продление жизни пациента; предотвратить или замедлить прогрессирование ССЗ возможно, если прервать цепь последовательных событий сердечно-сосудистого континуума. Именно поэтому требования к проводимой антигипертензивной терапии не ограничиваются только достижением целевых значений АД, желательно продемонстрировать доказанную эффективность в отношении снижения кардиоваскулярного риска. Кандесартан в исследованиях продемонстрировал не только антигипертензивную эффективность, но и снижение сердечно-сосудистого риска [14]. Так, в мета-анализе данных наблюдений за 690 463 пациентами установлено, что кандесартан превосходит валсартан и лозартан по способности предотвращать развитие неблагоприятных событий [24]. В проведенном в Швеции клиническом исследовании установлено, что риск возникновения основных неблагоприятных сердечно-сосудистых событий был на 14% ниже у пациентов, лечившихся кандесартаном, чем у лиц, получавших лозартан. Кроме того, у них оказался ниже риск развития сердечной недостаточности и атеросклероза (проанализированы данные наблюдения в течение 9 лет за 14 100 пациентами, из которых 7 329 получали кандесартан) [25]. В исследовании CASE-J (CandesartanAntihypertensiveSurvivalEvaluationinJapan) у пациентов с избыточной массой тела на фоне лечения кандесартаном отмечено достоверное снижение общей смертности по сравнению с показателем в группе лиц, получавших амлодипин [26].
Одним из важных критериев эффективности антигипертензивных средств являются их протективные свойства в отношении органов-мишеней [14]. Кардиопротективные свойства кандесартана продемонстрированы в исследовании SARA: регресс гипертрофии миокарда левого желудочка наблюдался у пациентов с АГ и метаболическим синдромом [27]. В многоцентровом проспективном рандомизированном двойном слепом исследовании CATCH (CandesartanAssessmentintheTreatmentofCardiacHypertrophy) целевые уровни систолического и диастолического АД были достигнуты в обеих группах, при этом нормализация массы миокарда левого желудочка отмечена у большего количества пациентов в группе кандесартана по сравнению с таковой в группе эналаприла (36,3% и 28,6% соответственно) [28]. Терапия кандесартаном позволяет увеличить толерантность пациентов с АГ с гипертрофией левого желудочка к физической нагрузке [29].
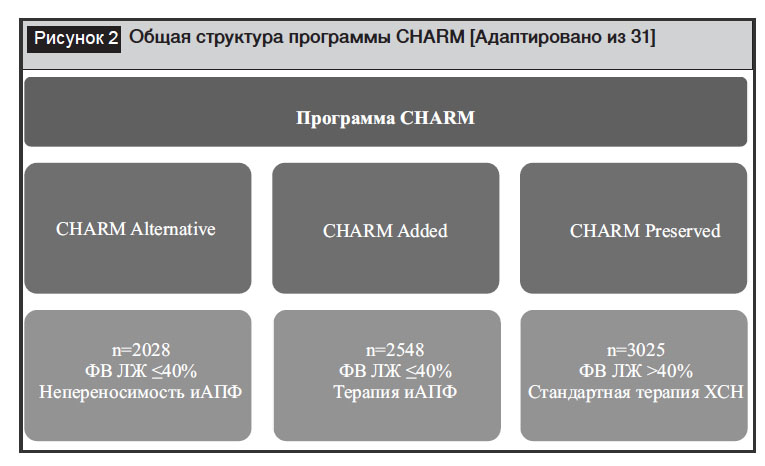
В патогенезе развития ХСН имеют значение нарушения нейрогуморального гомеостаза: активация РААС и симпатоадреналовой системы способствует развитию ремоделирования миокарда, нарушению систолической и диастолической функции левого желудочка. В связи с чем лечение ХСН направлено на нормализацию функционирования систем гомеостаза и защиту органов-мишеней. Преимущества действия БРА II заключаются в селективном подавлении РААС без воздействия на калликреин-кининовую и другие нейрогуморальные системы, играющие роль в патогенезе ХСН [30]. Эффективность и безопасность применения кандесартана изучалась более чем у 7,5 тысяч пациентов с ХСН в программе CHARM (Candesartan in Heart failure: Assessment of Reductionin Mortality and morbidity), которая состояла из трех независимых рандомизированных плацебо-контролируемых исследований (рис. 2) [31]. В исследование CHARM Аlternative были включены пациенты с систолической дисфункцией левого желудочка (ЛЖ), которые не переносят иАПФ. В исследовании CHARM Added приняли участие пациенты с симптомами ХСН со сниженной систолической функцией ЛЖ, уже получающие адекватные дозы иАПФ. Пациенты с сохранной фракцией выброса (ФВ) левого желудочка, имеющие симптомы ХСН и не получающие иАПФ, вошли в исследование CHARM Preserved.
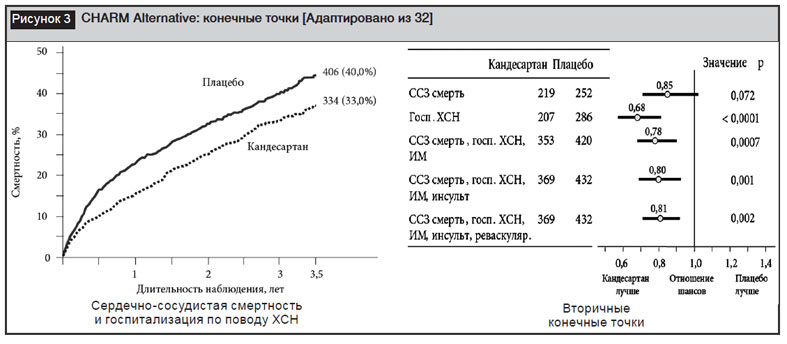
В исследовании CHARMAlternativeпациенты были рандомизированы в группы плацебо или кандесартана (целевая доза 32 мг/сутки). Выявлено достоверное снижение сердечно-сосудистой смерти и госпитализации по поводу ХСН (первичная конечная точка) в группе кандесартана по сравнению с плацебо (33% и 40% соответственно, отношение шансов 0,77; 95% ДИ 0,67–0,89; р=0,004). Благоприятные изменения были отмечены также для всех вторичных конечных точек (рис. 3) [32].
Первичная конечная точка в исследовании CHARM Added была такой же, как и в предыдущем проекте. Кандесартан достоверно уменьшал риск наступления сердечно-сосудистой смерти и госпитализаций по поводу ХСН (отношение шансов 0,85; 95% ДИ 0,75–0,96; р=0,011). На фоне приема кандесартана уменьшалось количество пациентов, перенесших инфаркт миокарда (р=0,012). Аналогичное благоприятное действие отмечалось в отношении всех вторичных точек (рис. 4) [31].

В исследовании CHARM Preserved отмечено снижение частоты госпитализаций по поводу ХСН и достоверное уменьшение числа новых случаев развития сахарного диабета на фоне использования кандесартана (отношение шансов 0,60; 95% ДИ 0,41–0,86; р=0,005) [33].
Результатом программы CHARM является доказанное для кандесартана снижение смертности у лиц с ХСН. Всего за период наблюдения от всех причин умерли 23,3% пациентов в группе кандесартана и 24,9% в группе плацебо (нескорректированное отношение шансов 0,91; 95% ДИ 0,83–1,00; р=0,055). Снижение смертности в группе кандесартана было обусловлено уменьшением частоты сердечно-сосудистой смертности (18,2% против 20,3% соответственно, отношение шансов 0,88; 95% ДИ 0,79–0,97; р=0,012). Число госпитализаций по поводу ХСН в группе кандесартана было меньше на 23%. В программе CHARM было также продемонстрировано: терапия кандесартаном приводит к уменьшению относительного риска развития фибрилляции предсердий на 19%, а у пациентов со сниженной фракцией выброса – на 22%[31, 34].
Связь между высоким АД и расстройствами когнитивных функций установлена в ряде эпидемиологических исследований (Framingham, EVA Gothenburg, Honolulu-Asia Aging Study) [30, 35–37]. Длительно протекающая АГ часто сопровождается нарушениями высших психических функций; развиваются расстройства в интеллектуальной сфере (нарушения памяти, способность сконцентрироваться, дефицит внимания), в эмоциональной области (колебания настроения, отсутствие заинтересованности и дружелюбия), неуравновешенность и другие неврологические симптомы, такие как головокружение, головная боль, ухудшение слуха, бессонница, тремор. Когнитивные нарушения могут приводить к дезадаптации пациентов, имеют серьезные социальные последствия [2]. В связи с тем, что развитию деменции предшествует малосимптомное поражение головного мозга, в реальной клинической практике врач констатирует его уже на этапе развития выраженных когнитивных нарушений, в том числе деменции [38]. Наличие связи между инсультом, деменцией и АГ очевидно, но роль антигипертензивной терапии в профилактике деменции стала изучаться относительно недавно: доказано, что, независимо от этиологии, снижение АД сопровождается уменьшением риска развития инсульта и деменции [39–41].
Первым крупным исследованием для оценки когнитивных функций стало международное многоцентровое плацебо-контролируемое исследование SCOPE (The Study of Cognition and Prognosis in Elderly Hypertensives), проведенное в 527 центрах в 15 странах с участием 4 964 пациентов в возрасте старше 70 лет с уровнем АД 160–179/90–99 мм рт.ст. и индексом деменции по шкале MMSE (Mini Mental State Examination) 24 и более. Длительность наблюдения составила 2,5 года. Пациенты были рандомизированы на две группы. Первая получала кандесартан 8–16 мг, вторая – плацебо. Сопутствующая антигипертензивная терапия не регламентировалась. Исследование показало снижение риска инсульта на 23,6% (р=0,056) и риска развития нефатального инсульта на 27,8%. В группе кандесартана, в подгруппе пациентов с изолированной систолической АГ достигнуто снижение риска инсульта на 42%. Кроме того, лечение кандесартаном позволяло замедлить развитие интеллектуально-мнестических нарушений – снижение внимания, кратковременной памяти. Отмечалась тенденция к увеличению скорости запоминания [42, 43]. Положительное влияние БРА II на головной мозг связано не только с их гипотензивным эффектом, но и с прямым воздействием на AT1-рецепторы в нейронах и эндотелии мозговых сосудов. Поэтому, по некоторым данным, БРА II эффективны и у нормотензивных пациентов с высоким сердечно-сосудистым риском [43].
В нескольких рандомизированных клинических исследованиях продемонстрировано нефропротективное действие кандесартана у пациентов с АГ, которое наиболее выражено при диабетической нефропатии [30, 44]. Способность уменьшать проявления протеинурии у лиц с СД впервые была показана в исследованиях CALM Iи CALM II [45]. Эффективность кандесартана у пациентов с пересаженной почкой была оценена в исследовании SECRET: в группах кандесартана и плацебо одинаковой оказалась частота серьезных сердечно-сосудистых событий. Снижение АД и уменьшение протеинурии отмечено в группе кандесартана [46].
В Республике Беларусь зарегистрированы следующие представители группы БРА II: лозартан, валсартан, телмисартан, ирбесартан, эпросартан и кандесартан. Применение кандесартана в дозе 4–32 мг/сутки при оказании медицинской помощи в амбулаторных и стационарных условиях обосновано в соответствии с постановлением Министерства здравоохранения Республики Беларусь №59 от 06.06.2017 г.: клинический протокол диагностики и лечения заболеваний, характеризующихся повышенным кровяным давлением; клинический протокол диагностики и лечения заболеваний, осложненных сердечной недостаточностью. Кандесартан включен в Республиканский формуляр лекарственных средств на 2018 год (постановление Министерства здравоохранения Республики Беларусь №33 от 03.04.2018 г.). Лекарственное средство «Канверс» (компания Sandoz) представлено таблетками 8 мг или 16 мг, а также фиксированными дозами комбинаций с гидрохлортиазидом («Канверс плюс» таблетки 8 мг / 12,5 мг и 16 мг / 12,5 мг), что дает возможность индивидуализировать терапию в каждой конкретной клинической ситуации, способствует повышению комплаентности пациентов.
Заключение
Лекарственные средства группы блокаторов рецепторов ангиотензина II снижают активность ренин-ангио-тензин-альдостероновой системы, являющейся единым патоморфологическим звеном сердечно-сосудистой коморбидности; имеют достаточную доказательную базу их эффективности и безопасности в лечении кардиоваскулярных заболеваний. Фармакокинетические свойства кандесартана определяют его преимущества, к которым можно отнести большую продолжительность действия, способность предотвращать утренний подъем артериального давления и широкий спектр органопротективных эффектов, а также снижение риска появления новых случаев сахарного диабета. Это определяет целесообразность его применения у коморбидных пациентов. Кандесартан эффективен в лечении лиц с хронической сердечной недостаточностью. Церебропротективные свойства кандесартана реализуются в снижении риска развития инсульта, инвалидизации после перенесенного нарушения мозгового кровообращения, деменции, а также улучшении когнитивных функций. Лекарственное средство «Канверс» представлено таблетками с дозировкой 8 мг или 16 мг, а также фиксированными дозами комбинаций с гидрохлортиазидом («Канверс плюс» таблетки 8 мг / 12,5 мг и 16 мг / 12,5 мг), что дает возможность индивидуализировать терапию в каждой конкретной клинической ситуации.
ЛИТЕРАТУРА
1. Feinstein A.R. // Journal Chronic Diseases. – 1970. – Vol.23, N7. – P.455–468.
2. Коморбидная патология в клинической практике. Клинические рекомендации. Кардиоваскулярная терапия и профилактика. – 2017. – Vol.16, N6. – P.5–56.
3. Estel С., Conti С.R. // Cardiovascular Innovations and Applications. – 2016. – Vol.1, N4. – P.369–377.
4. Митьковская Н.П. Кардиология и коморбидность. I Международный конгресс кардиологов и терапевтов: Сб. науч. тр. – 2016. – C.173–177.
5. Верткин А.Л., Скотников А.С. // Лечащий врач. – 2013. – №6. – С.66–69.
6. Dzau V., Braunwald E. // Am. Heart J. – 1991. – Vol.121, N4. – P.1244–1263.
7. Dzau V.J., Antman E.M., Black H.R., et al. // Circulation. – 2006. – Vol.114, N25. – P.2850–2870.
8. De Gasparo M. // Heart Fail Rev. – 2002. – Vol.7. – P.347–358.
9. Zhou M.S., Schulman I.H., Raij L. // Semin. Nephrol. – 2004. – Vol.24, N4. – P.366–378.
10. Burnier M. // Circulation. – 2001. – Vol.103, N6. – P.904–912.
11. Blood Pressure Lowering Treatment Trialists Collaboration. // J. Hypertens. – 2007. – Vol.25, N5. – P.951–958.
12. Matchar D.B., McCrory D.C., Orlando L.A., et al. // Ann. Intern Med. – 2008. – Vol.148, N1. – P.16–29.
13. Gleiter C.H., MÖrike K.E. // Clin. Pharmacokinet. – 2002. – Vol.41, N1. – P.7–17.
14. Минушкина, Л.О. // Системные гипертензии. – 2014. – 11 с.
15. Burgess E. // Blood Pressure. – 2000. – Vol.10. – P.117–120.
16. Shimizu M., Ishikawa J., Yano Y., et al. // J. Hypertens. – 2012. – Vol.30, N5. – P.1015–1021.
17. Kario K., Ishikawa J., Pickering T.J. // Hypertens Res. – 2006. – Vol.29, N8. – P.581–587.
18. Minatoguchi S., Aoyama T., Kawai N., et al. // Blood Press. – 2013. – Vol.22, Suppl.1. – P.29–37.
19. Hasegawa H., Takano H., Kameda Y., et al. // Clin. Exp. Hypertens. – 2012. – Vol.34, N2. – P.86–91.
20. Weisser B., Gerwe M., Braun M., Funken C. // Arzneimittelforschung. – 2005. – Vol.55, N9. – P.505–513.
21. Bakris G., Gradman A., Reif M., et al. // J. Clin. Hypertens. – 2001. – Vol.3. – P.16–21.
22. Vidt D.G., White W.B., Ridley E., et al. // J. Hum. Hypertens. – 2001. – Vol.15. – P.475–480.
23. Zheng Z., Shi H, Jia J., et al. // J. Renin Angiotensin Aldosterone Syst. – 2011. – Vol.12, N3. – P.365–374.
24. Lin J.W., Chang C.H., Caffrey J.L., et al. // Hypertension. – 2014. – Vol.11, N4. – P.75–80.
25. Russell D., StМlhammar J., Bodegard J., et al. // J. Clin. Hypertens (Greenwich). – 2011. – Vol.13, N3. – P.189–197.
26. Nakao K., Hirata M., Oba K., et al. // Hypertens. Res. – 2010. – Vol.33, N6. – P.600–606.
27. Escobar C., Barrios V., Calderуn A., et al. // J. Clin. Hypertens (Greenwich). – 2008. – Vol.10, N3. – P.208–214.
28. Cuspidi C., Muiesan M.L., Valagussa L., et al. // J. Hypertens. – 2011. – Р.2293–2300.
29. De Rosa M.L., Chiariello M. // J. Clin. Hypertens (Greenwich). – 2009. – Vol.11, N4. – P.192–200.
30. Павлова Т.В. // Кардиология. Новости. Мнения. Обучение. – 2017. – Т.3, №14. – P.70–74.
31. Young J.B., Dunlap M.E., Pfeiffer M.A., et al. // Circulation. – 2004. – Vol.110, N17. – P.2618–2626.
32. Granger C.B., McMurray J.J., Yusuf S., et al. // Lancet. – 2003. – Vol.362, N9386. – P.772–776.
33. Yusuf S., Pfeiffer M.A., Swedberg K., et al. // Lancet. – 2003. – Vol.362, N9386. – P.777–781.
34. Ducharme A., Swedberg K., Pfeiffer M.A., et al. // Am. Heart J. – Vol.152, N1. – P.86–92.
35. Knopman D.S., et al. // Neurology. – 2015. – Vol.85, N19. – P.1712–1721.
36. Petrovitch H., White L.R., Ross G.W., et al. // Neurology. – 2001. – Vol.57, N2. – P.226–234.
37. Jakobsson E., Gaston-Johansson F., Ohldn J., Bergh I. // Scand. J. PublicHealth. – 2008. – Vol.36, N2. – P.177–182.
38. Петрова М.М., Шнайдер О.В., Еремина Н.А. Когнитивные нарушения у больных артериальной гипертонией. – Красноярск, 2007. – 101 с.
39. PROGRESS Collaborative Group. // Lancet. – 2001. – Vol.358. – P.1033–1041.
40. Снежицкий В.А. // Медицинские новости. – 2007. – Vol.1. – P.15–20.
41. Ronnemaa E., Zethelius B., Lannfelt L., Kilander L. // Dement Geriatr Cogn Disord. – 2011. – Vol.31, N6. – P.460–466.
42. Saxby B.K., Harrington F., Wesnes K.A., et al. // Neurology. – 2008. – Vol.70, N19, Pt. 2. – P.1858–1866.
43. Lithell H., Hansson L., Elmfeldt D., et al. // J. Hypertens. – 2003. – Vol.21. – P.875–886.
44. Okura T., Kojima M., Machida H., et al. // J. Hum. Hypertens. – 2012. – Vol.26, N4. – P.214–219.
45. Andersen N.H., Poulsen P.L., Knudsen S.T., et al. // Diabetes Care. – 2005. – Vol.28, N2. – P.273–277.
46. Philipp T., Martinez F., Geiger H., et al. // Nephrol. Dial. Transplant. – 2010. – Vol.25, N3. – P.967–976.
Медицинские новости. – 2018. – №6. – С. 43-47.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.