Внимание! Статья адресована врачам-специалистам
Tsapaeva N.L.
Belarusian State Medical University, Minsk
Acetylsalicylic acid – the strategical partner
in the prevention of cardiovascular accident
Резюме. Представлены результаты многоцентровых исследований, посвященных механизму действия ацетилсалициловой кислоты, аспиринорезистентности, фармакодинамике различных форм препарата в аспекте эффективности и безопасности. Новые рекомендации Европейского кардиологического общества по применению ацетилсалициловой кислоты для первичной профилактики по результатам окончания исследований ASCEND и ARRIVE.
Ключевые слова: ацетилсалициловая кислота, фармакодинамика, резистентность.
Медицинские новости. – 2019. – №3. – С. 29–34.
Summary. The review presents the results of the multicentric trials, dedicated dissimilar impact of acetylsalicylic acid, aspirin-resistant, the pharmacodynamics of different type of acetylsalicylic acid in the aspect of efficiency and safety. The new ESC-recommendation concerning using of acetylsalicylic acid for the primary prevention according the consummation of the new data ASCEND and ARRIVE.
Keywords: acetylsalicylic acid, pharmacodynamics, resistance.
Meditsinskie novosti. – 2019. – N3. – P. 29–34.
В марте 2019 года исполнилось 120 лет препарату с уникальной историей «активного лекарственного долгожителя»: 6 марта 1899 года – дата патентования в Кайзеровском патентном ведомстве нового лекарственного средства Аспирин®. В основе торгового наименования лежит латинское название растения Spiraea – белая ива, таволга, из коры которой получили салицилаты для производства препарата.
Однако еще 2000–3000 лет назад на папирусах жрецов-целителей древнего Египта были найдены «рецепты» использования целебных свойств ивовой коры «при жаре и боли». Около тысячи лет спустя Гиппократ в своих «Наставлениях» рекомендовал использовать ивовую кору в виде отвара «при лихорадке и родовых муках». Феликс Хоффман, работавший на предприятии «Bayer», в 1897 году разработал метод получения ацетилированной формы салициловой кислоты – ацетилсалициловой кислоты (АСК), которая обладала необходимыми терапевтическими свойствами и хорошо переносилась больными. Это открытие определило дальнейший путь создания препарата Аспирин®. Последующие 70 лет врачи использовали АСК, не зная механизма ее действия. В 1971 году благодаря работам английского биохимика Джона Вейна был установлен механизм действия, а в 1982 году за это открытие Джон Вейн и его шведские коллеги Суне Бергстрем и Бенгт Самуэльсон получили Нобелевскую премию.
Механизм действия ацетилсалициловой кислоты
Достоверно известно [1], что АСК модулирует синтез простагландинов путем ингибирования циклооксигеназы (ЦОГ)-1 и в меньшей степени ЦОГ-2. Кроме синтеза простагландинов угнетается синтез тромбоксанов, особенно тромбоксана А2 (ТхА2), который повышает агрегацию тромбоцитов, вызывая выраженную вазоконстрикцию, и простациклинов, обладающих антиадгезивными и антиагрегантными свойствами. В результате такого блокирования проявляются четыре эффекта АСК: жаропонижающий, анальгезирующий, противовоспалительный и антитромботический. Проявление этих эффектов является дозозависимым: низкие дозы вызывают антитромботическое действие за счет преимущественного подавления синтеза тромбооксигеназы, высокие дозы обеспечивают анальгезирующий и противовоспалительный эффекты за счет подавления синтеза простагландинов и интерлейкинов (рис. 1) [2].
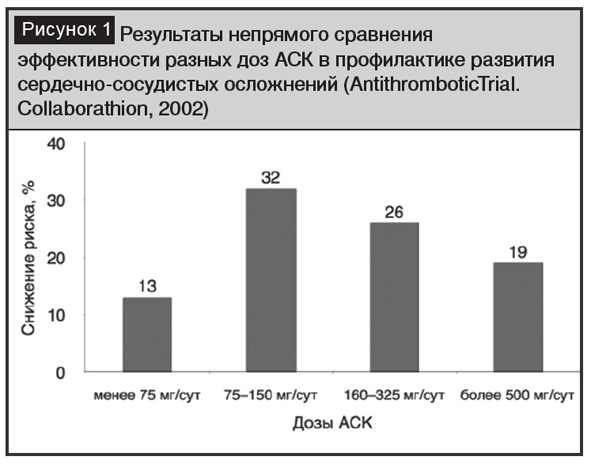
АСК – «протокольный»компонентсовременной антитромбоцитарной терапии (АТ) при ОКС, ОИМ, экстренной и плановой рентгенэндоваскулярной и хирургической реваскуляризации миокарда [3–5]. Механизм ее действия связан со снижением агрегации тромбоцитов в ответ на тромбогенные стимулы за счет необратимой блокады ЦОГ-1 в тромбоцитах и мегакариоцитах с последующим нарушением синтеза из арахидоновой кислоты индукторов агрегации тромбоцитов: простагландинов G2, H2 и одного из наиболее мощных вазоконстрикторов и проагрегантов – ТхА2 [6]. Существуют и другие механизмы действия, обусловливающие ее уникальность: АСК ингибирует влияние на образование фибрина через подавление синтеза тромбина и функционального состояния фибриногена (блокирует лизин в молекулах фибриногена); активирует фибринолиз через высвобождение активаторов плазминогена и «разрыхление» волокон фибрина; оказывает локальные и системные противовоспалительные эффекты [7]. Назначение АСК (250–300 мг на догоспитальном этапе и поддерживающая доза 75–150 мг в сутки неопределенно долго в качестве монотерапии или компонента двойной антитромбоцитарной терапии) является обязательным показанием при ОКС, ОИМ, проведении экстренного ЧКВ при отсутствии абсолютных противопоказаний: тяжелая аллергия в виде приступов бронхоспазма («аспириновая астма»); гемофилия и тромбоцитопения; активное кровотечение, в том числе кровоизлияния в сетчатку; эрозивно-язвенные процессы в ЖКТ в фазе обострения или наличие источников кровотечения из ЖКТ или мочевых путей (класс I, уровень А) [3].
На протяжении многих лет АСКпродолжает оставаться золотым стандартом профилактики осложнений сердечно-сосудистых заболеваний у лиц, представляющих группу повышенного риска, поскольку ключевую роль в их развитии играет тромбоз. Это определяет универсальность действия препарата, отличающего его от других профилактических лекарственных средств – статинов или ингибиторов АПФ, которые назначаются для контроля целевых уровней таких факторов риска, как дислипидемия и артериальная гипертензия. Антитромбоцитарная терапия оказывает воздействие на здоровье миллионов людей во всем мире, которые принимают средства этой группы для снижения риска развития или вторичной профилактики сердечно-сосудистых и цереброваскулярных заболеваний [8].
По данным международного комитета по анализу исследований, посвященных антитромбоцитарным препаратам, назначение АСК с целью вторичной профилактики сердечно-сосудистых эпизодов снижает риск развития ишемического инсульта, инфаркта миокарда (ИМ) и сердечно-сосудистой смерти в среднем на 25%. При анализе эффективности антитромбоцитарных препаратов в отношении отдельных конечных точек оказалось, что снижение риска развития нефатального инсульта при назначении антиагрегантов составляет 31%, нефатального ИМ – 35%, сосудистой смерти – 18% [9, 10]. Несмотря на высокую эффективность, подтвержденную в крупных клинических исследованиях с участием сотен тысяч пациентов по всему миру, рутинное применение препарата ограничивают побочные эффекты АСК [8].
Лекарственные формы ацетилсалициловой кислоты
Побочные эффекты выявляются в 0,8–5% случаев. Чаще всего речь идет об ульцерогенных осложнениях ЖКТ, сопровождающихся в ряде случаев кровотечениями. Частота их возникновения коррелирует с дозой препарата. По результатам крупного мета-анализа установлено, что частота больших кровотечений при дозах АСК 30–80 мг/сутки составила менее 1%; 100–200 мг/сутки – 1,56%, 283–1300 мг/сутки – 5% [8, 10]. Возникновение ульцерогенных осложнений обусловлено как локальным, так и системным воздействием АСК. Локальный эффект – прямое повреждающее действие препарата на слизистую оболочку желудка, особенно при осаждении на ней нерастворившихся крупинок препарата. Системный эффект связан с ингибированием ЦОГ-1 и последующей блокадой синтеза простагландинов Е2 и F2a, оказывающих защитное действие на слизистую оболочку [11, 12]. Безусловно, определяющую роль в их развитии принадлежит исходному состоянию слизистой оболочки желудка, уровню пепсина и соляной кислоты, а также развивающейся острой ишемии органов брюшной полости, при сердечно-сосудистых катастрофах или вследствие наличия хронической ишемии при мультифокальном атеросклерозе. Этому способствует тот факт, что на фоне приема АСК при снижении интрагастрального уровня рН<4 усиливается обратная диффузия ионов водорода в слизистую оболочку желудка [13–15].
С целью уменьшения ульцерогенного действия разработаны и в настоящее время используют защищенные формы АСК – буферные и кишечнорастворимые.
Кишечнорастворимые формы имеют защитную оболочку, и процесс всасывания АСК в тонком кишечнике должен устранять действие АСК на слизистую оболочку желудка, обеспечивая эффективность и безопасность препарата. Сравнительная эффективность обычной АСК и ее кишечнорастворимой формыизучалась в ряде исследований, в которых определялась биодоступность этих форм [16–18]. Простая АСК всасывается в желудке, где низкий рН предотвращает ее деацетилирование и сохраняет АСК в неионизированной форме, которая лучше всасывается. Концентрация АСК в плазме крови достигает пика через 30–40 минут после приема, а подавление функции тромбоцитов регистрируется через 1 час. Высвобождение АСК из препаратов с кишечнорастворимой оболочкой происходит в верхней части тонкой кишки, где уровень рН почти нейтральный, следовательно, инактивация АСК происходит быстрее. Поскольку всасывание кишечнорастворимых форм замедлено, то и концентрация АСК в плазме крови достигает пика лишь через 3–4 часа после приема, что определяет уменьшение ее биодоступности. В исследовании D. Coxи соавт. (2006) [17] представлены результаты сравнения биоэквивалентности различных препаратов АСК: три кишечнорастворимые формы разных производителей в дозировке 75 мг и простой АСК в дозе 75 мг (табл. 1).
Таблица 1. Результаты сравнительного изучения эффективности простой и кишечнорастворимых форм АСК (адаптирована по данным D. Cox и соавт., 2006)
|
Препарат АСК
|
Число
участников
|
Неэффективность лечения* (95% ДИ)
|
Неполное ингибирование** (95% ДИ)
|
|
Простая форма
|
50
|
0% (0; 13,3)
|
8% (2,1; 30,5)
|
|
Кишечнорастворимая
|
46
|
13% (7,8; 21)
|
54,3% (44,2; 66,9)
|
Примечание. Результаты представлены в виде % с доверительными интервалами (ДИ): * – неэффективность лечения (<95% ингибирования синтеза TxB2); ** – неполное ингибирование (<99% ингибирования синтеза TxB2).
Известно, что проведение фармакокинетических исследований низких доз АСК не представляется возможным в силу того, что препарат нестойкий и значительная часть ингибирования тромбоцитов происходит в микроциркуляторном русле [19]. Для анализа биоэквивалентности выполнили фармакодинамические исследования. В качестве первичной конечной точки рассматривали процент ингибирования ТхВ2 на 14-й день [19]. Этот анализ позволил оценить степень ингибирования ЦОГ тромбоцитов на фоне приема АСК. Терапию считали неэффективной при ингибировании ТхВ2 <95%; ингибирование ТхВ2 от 95% до 99% считали неполным; лечение рассматривали как успешное в случае ингибирования ТхВ2 >99%. Важным практическим выводом является установление факта, что биодоступность кишечнорастворимых форм в дозе 75 мг/сутки меньше и эквивалентна только 50 мг простой АСК, что необходимо учитывать при выборе формы и дозы АСК, при мониторинге антитромбоцитарной терапии, особенно у пациентов, подвергнутых рентгенэндоваскулярной или хирургической реваскуляризации миокарда для обеспечения эффективности двойной антиагрегантной терапии.
В аспекте безопасности: на протяжении многих лет, считалось, что кишечнорастворимая форма АСК надежно оберегает слизистую оболочку желудка и 12-перстной кишки и имеет существенные преимущества при длительном приеме препарата. С развитием эндоскопической техники и появлением капсульной эндоскопии появилась возможность оценить воздействие этой формы на слизистую оболочку тонкого кишечника [20]. Оказалось, что кишечнорастворимая оболочка не защищает в полной мере тонкий кишечник от неблагоприятного воздействия АСК [21].
Буферная форма представляет собой комбинацию АСК с невсасываю-щимся антацидом, выполняющим роль кислотного буфера. При приеме буферных форм всасывание АСК происходит в желудке. Большинство сравнительных исследований, касающихся эффективности и безопасности буферных форм, проведены с препаратом Кардиомагнил. Их результаты можно экстраполировать на другие препараты, где антацидным буфером является магния гидроксид. Примером отечественного препарата ацетилсалициловой кислоты в буферной форме, содержащего магния гидроксид является дженерик «Кардиомагнум» (СП ООО «Фармлэнд»). Выбор гидроксида магния в качестве кислотного буфера неслучаен, поскольку он обладает рядом преимуществ перед другими антацидами. Для гидроксида магния характерно быстрое начало действия, защитный эффект на протяжении всего времени воздействия АСК на слизистую оболочку, высокая способность к нейтрализации кислоты, отсутствие системных эффектов и воздействия на тонус сфинктеров ЖКТ. В отличие от солей алюминия гидроксид магния не оказывает влияние на обмен фосфора и, соответственно, не вызывает поражение почек и костной ткани. Представляются убедительными результаты исследования [22], продемонстрировавшие преимущества буферной формы АСК над простой и кишечнорастворимой (рис. 2) при анализе частоты случаев побочных эффектов со стороны ЖКТ. Частота желудочно-кишечных расстройств (тошнота, изжога, боли в эпигастральной области) оказалась самой высокой при использовании обычной АСК, а наименьшей – у больных, принимавших буферную форму АСК. В исследовании А.Л. Верткина и соавт. [23] участвовали 80 больных в возрасте 65–80 лет (в среднем – 72 года) со стабильной стенокардией или постинфарктным кардиосклерозом и наличием, как минимум, одного фактора риска развития гастропатии, ассоциированной с терапией АСК (язвенная болезнь в анамнезе, хроническая сердечная недостаточность II–III ФК по NYHA, стенозирующий атеросклероз периферических артерий, сахарный диабет 2-го типа). Всем больным выполняли эзофагогастродуоденоскопию и рН-метрию тела и антрального отдела желудка. При помощи аналоговой шкалы оценивали выраженность и длительность симптомов диспепсии. Средний балл тяжести диспепсических расстройств по аналоговой шкале через 12 недель лечения у принимавших буферную форму АСК и кишечнорастворимую форму составил 0,37 и 0,86, а длительность симптомов выраженной диспепсии – 22 и 37 дней соответственно. Как показало исследование H. Endo и соавт. [21], частота возникновения эрозий и язв в слизистой оболочке тонкого кишечника при приеме кишечнорастворимой формы АСК выше по сравнению с буферной формой в 1,6 и 5,7 раза соответственно (рис. 3).
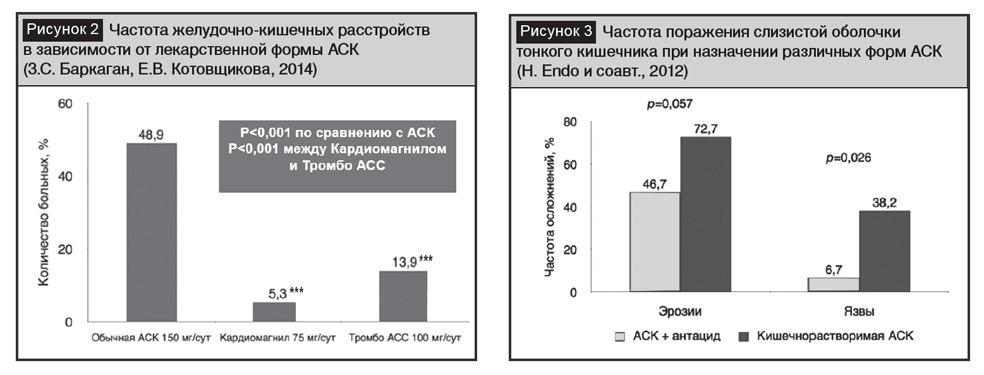
Таким образом, соединение АСК с гидроксидом магния позволяет сохранить преимущества «простой» АСК: быстрое и полное всасывание в желудке, быстрое начало действия, прогнозируемый антитромботический эффект, снижая при этом вероятность развития побочных явлений со стороны ЖКТ за счет протекторного действия гидроксида магния [24].
Резистентность к ацетилсалициловой кислоте
АСК необратимо ацетилирует молекулу серина 529, фермента ЦОГ-1, что приводит к подавлению образования тромбоксана А2 тромбоцитами и простациклина клетками эндотелия [25]. Так как тромбоциты не способны генерировать повторно ЦОГ-1 в достаточных количествах, вызванное АСК подавление активности ЦОГ-1, то есть блокада синтеза Тх АСК продолжается в течение всего периода жизни тромбоцита (7–10 дней). Эндотелиальные клетки сохраняют свою способность образовывать новую ЦОГ и восстанавливать нормальную функцию сразу после прекращения действия аспирина. Низкие и средние дозы АСК эффективно блокируют образование Тх, но минимально подавляют синтез простациклина. Это происходит как за счет возможности ресинтеза ЦОГ-1 в клетках эндотелия, так и вследствие более низкой чувствительности ЦОГ-2 к АСК. Несмотря на то, что АСК имеет «титул» золотого стандарта антитромбоцитарной терапии, многочисленные исследования показали, что такое лечение предупреждает развитие только 25% неблагоприятных сердечно-сосудистых событий [26–28]. Изучение данного феномена привело к появлению такого понятия, как «аспиринорезистентность». Резистентность к АСК – явление достаточно распространенное и встречается, по различным данным, с частотой от 5% до 48%. Однако проблема резистентности к АСК изучена недостаточно, до сих пор не существует единого общепринятого определения этого термина. Выделяют клиническую и биохимическую аспиринорезистентность [28, 29]. Под клинической резистентностью понимают неспособность препарата предотвратить тромботический эпизод у конкретного больного. Биохимическую резистентность определяют как недостаточное подавление функции тромбоцитов на фоне приема АСК, установленное по результатам различных лабораторных тестов. Согласно Меморандуму рабочей группы по изучению резистентности к АСК Международного общества по тромбозу и гемостазу [25], рассматриваются следующие механизмы формирования «резистентности» к АСК (табл. 2).
Таблица 2. Возможные механизмы «резистентности» к АСК
|
Показатель
|
Причины
|
|
Механизмы, обусловленные биодоступностью
|
Низкая приверженность к лечению (non-compliance), неадекватная доза.
Низкая абсорбция (АСК в энтеральной оболочке), лекарственное взаимодействие (одновременное применение НПВП)
|
|
Механизмы, обусловленные функциональным
состоянием тромбоцитов
|
Неполное подавление ТхА2; образование и поступление
в кровоток тромбоцитов, не подвергнутых действию АСК (turnover); стресс-индуцированная экспрессия ЦОГ-2; возрастающая чувствительность тромбоцитов к АДФ и коллагену
|
|
Механизмы, обусловленные единичными
нуклеотидными полиморфизмами
|
Рецепторы: гликопротеины IIb/IIIa, к коллагену, к тромбоксану и др.
Ферменты: ЦОГ-1, ЦОГ-2, тромбоксан А2 синтетаза и др.
|
|
Механизмы, обусловленные взаимодействием
тромбоцитов с другими клетками крови
|
Эндотелиальные клетки и моноциты способны обеспечить поступление в тромбоцит простагландина Н2 (в обход ЦОГ-1) и синтезировать собственный ТхА2
|
|
Механизмы, обусловленные другими факторами
|
Ожирение, курение, гиперхолестеринэмия, физическая нагрузка, стресс
|
В последнее время исследователи, изучающие эту проблему, все чаще склоняются к тому, что истинная фармакологическая резистентность к АСК, являющаяся результатом неполной блокады ЦОГ-1 и недостаточного подавления синтеза Тх, встречается крайне редко и обусловлена исключительно генетическими факторами. Установлено, что независимо от причины резистентности недостаточный «ответ» на прием АСК и прекращение приема препарата ассоциируется с увеличением риска сердечно-сосудистых осложнений. В обзорах Н.М. Воробьевой [8, 25, 30] представлены и обсуждаются результаты целого ряда исследований, посвященных так называемой псевдорезистентности, которая чаще всего является следствием низкой приверженности к лечению, назначения неадекватных доз, взаимодействия с другими лекарствами. Указанные причины псевдорезистентности к АСК можно выявить, как правило, у больных сердечно-сосудистыми заболеваниями, длительно принимающих АСК, но не у здоровых лиц. Более того, эти факторы являются модифицируемыми, но даже после их коррекции или устранения резистентность к АСК у некоторых больных сохраняется. Именно поэтому многие исследователи полагают, что основной механизм псевдорезистентности – фармакокинетический, связанный с замедленным или неполным всасыванием часто используемой кишечнорастворимой формы препарата в ЖКТ, который также объясняет и резистентность у здоровых лиц. Для подтверждения этого предположения было организовано крупное исследование [31] с участием 400 здоровых добровольцев. В работе не было выявлено ни одного случая истинной фармакологической резистентности к АСК среди 400 здоровых добровольцев. Исследователи сделали вывод, что аспиринорезистентность не имеет генетической основы и является транзиторной. У всех «неответчиков» устойчивость к кишечнорастворимой форме АСК была расценена как псевдорезистентность, обусловленная фармакокинетическим механизмом, связанным с замедлением или снижением всасывания кишечнорастворимых форм. Через 4 часа после приема кишечнорастворимой АСК препарат не ингибировал в достаточной степени агрегацию тромбоцитов у 49% участников исследования, через 8 часов количество «неответчиков» составило 17%, что свидетельствовало о замедленном действии кишечнорастворимой формы, поскольку эффективность простой АСК в отношении ингибирования агрегации тромбоцитов отмечена у 100% обследованных. Кроме того, в исследовании A. Peaceи соавт. результаты многофакторного анализа показали, что масса тела и возраст больных являются независимыми предикторами неполного «ответа» на прием кишечнорастворимой формы АСК (p=0,025 и p=0,001 соответственно).
В настоящее время на фармацевтическом рынке представлены преимущественно кишечнорастворимые формы АСК. Важно помнить, что при использовании низких (75–150 мг/сутки) доз кишечнорастворимых форм биодоступность АСК ниже, поэтому указанные дозы могут быть недостаточными для ряда пациентов. Однако применение простой АСК может вызвать осложнения со стороны ЖКТ. Препаратами выбора в этих ситуациях являются буферные формы АСК, содержащие гидроксид магния, сочетающие преимущества простой АСК (быстрое и полное всасывание в желудке, быстрое начало действия, более прогнозируемый антитромботический эффект) с протективным действием антацида на слизистую оболочку ЖКТ. Таким образом, в тех случаях, когда назначение простой АСК предпочтительнее применения кишечнорастворимых форм, следует использовать АСК в буферной форме, например, отечественный дженерик Кардиомагнум, полностью соответствующий фармокодинамике оригинального препарата.
Результаты проведенных исследований
Европейский конгресс кардиологов, 2018 год, Мюнхен. В исследовании ASCEND участвовало 15 480 пациентов с сахарным диабетом в возрасте 40 лет и старше (в среднем – 63 года) без сердечно-сосудистых заболеваний. Они были случайным образом распределены в группу АСК (100 мг в день) или в группу плацебо. В среднем наблюдение длилось 7 лет и 4 месяца.
Результаты исследования применения ацетилсалициловой кислоты лицами с сахарным диабетом в профилактических целях.
1. Согласно результатам исследования ASCEND, АСК снизила риск развития серьезных сосудистых событий на 12%, но на 29% увеличила риск возникновения кровотечений.
2. Согласно Европейским рекомендациям, пациентам с сахарным диабетом для первичной профилактики можно назначать АСК только по индивидуальным показаниям (одним из вариантов является создание шкалы, по которой можно будет оценить риски развития сердечно-сосудистых заболеваний и кровотечений, поскольку у лиц с сахарным диабетом наблюдаются микрососудистые нарушения, которые значительно повышают риск возникновения сердечно-сосудистых катастроф).
3. По результатам исследования, большинство кровотечений происходили в ЖКТ. Назначение буферных форм АСК и применение ингибиторов протонной помпы может снизить риск развития подобных кровотечений.
4. АСК рекомендуется как протокольный антитромбоцитарный препарат при вторичной профилактике сердечно-сосудистых заболеваний.
Исследование ARRIVE (Aspirin to Reduce Risk of Initial Vascular Events) – рандомизированное двойное слепое плацебо-контролируемое мультицентровое исследование, проводимое в 7 странах (2007–2016). Приняли участие 12 546 пациентов с умеренным сердечно-сосудистым риском. Лица с высоким риском желудочно-кишечных и других кровотечений, а также сахарным диабетом были исключены из исследования. В качестве первичной конечной точки эффективности выбраны сердечно-сосудистая смерть, инфаркт миокарда, нестабильная стенокардия, инсульт и транзиторная ишемическая атака. В качестве конечных точек безопасности рассматривали частоту возникновения геморрагических событий.
Результаты:
1. Гастроинтестинальные кровотечения были диагностированы у 0,97% в группе аспирина и у 0,46% из группы плацебо.
2. Летальность составила 2,55% в группе аспирина и 2,57% в группе плацебо.
3. Полученные в исследовании ARRIVE данные не поддерживают применение аспирина для первичной профилактики сердечно-сосудистых событий у пациентов с умеренным риском.
Заключение
Ацетилсалициловая кислотапродолжает оставаться золотым антитромбоцитарным стандартом для вторичной профилактики осложнений сердечно-сосудистых заболеваний, протокольным препаратом у пациентов с ОКС, ОИМ, после экстренной и хронической реваскуляризации миокарда, обязательным компонентом двойной антиагрегантной терапии. Истинная «аспиринорезистентность» встречается крайне редко и обусловлена генетическими факторами. В клинической практике чаще возникает состояние псевдорезистентности, которая является следствием низкой приверженности к лечению, назначением неадекватных доз АСК, взаимодействием с другими лекарствами. Независимо от причины развития резистентности прекращение приема препарата ассоциируется с увеличением риска возникновения сердечно-сосудистых осложнений. При выборе формы и дозы препарата необходимо исходить из фармакодинамики АСК. В случаях, когда назначение простой АСК предпочтительнее применения кишечнорастворимых форм, следует использовать буферную форму препарата (например, отечественный дженерик Кардиомагнум). В соответствии с Клиническими протоколами диагностики и лечения инфаркта миокарда и нестабильной стенокардии (№59 от 06.06.2017 г.) на догоспитальном этапе не рекомендуется использование кишечнорастворимых форм. Согласно результатам последних многоцентровых исследований ASCEND и ARRIVE, применение АСК для первичной профилактики сердечно-сосудистых событий у пациентов с умеренным риском не показано. Пациентам с сахарным диабетом для первичной профилактики АСК должен назначаться по индивидуальным показаниям (исследования в этом направлении продолжаются).
Л И Т Е Р А Т У Р А
1. Волков В.И., Запровальная О.Е. // Новости фармации. – 2011. – №368. – С.53–59.
2. Campbell C.L., Smyth S., et al. // JAMA. – 2007. – Vol.297. – P.2018–2024.
3. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation // Eur. Heart J. – 2012. – Vol.33, N20. – P.2569–2619.
4. «Stent 4 Life». Targeting PCI at all who will benefit the most. A joint project between EAPCI, Euro-PCR, EUCOMED and the ESC Working Group on Acute Cardiac Care / Widimsky P. [et al.] // Eur. Interv. – 2009. – Vol.4. – P.555–557.
5. Wijns W. [et al.] // Eur. Heart J. – 2010. – Vol.31. – P.2501–2555.
6. Перепеч Н.Б. // MРЖ. – 2012. – №5. – С.175–181.
7. Волков В.И., Запровальная О.Е. // Здоровье Украины. – 2009. – №14. – С.7–10.
8. ВоробьеваН.М. // Consilium Medicum. – 2014. – №10. – С.103–108.
9. Mancia G., Fagard R., Narkiewicz K., et al. // Кардиоваск. терапияипрофилактика. – 2009. – №8 (6), Прил. 6.
10. Hirata Y., Kataoka H., Shimura T., et al. // Scand. J. Gastroenterol. – 2011. – Vol.46. – Р.803–809.
11. Wallace J.L., McKnight G.W. // Gastroenterology. – 1990. – Vol.99, N2. – P.295–304.
12. Somasundaram S., Hayllar H., Rafi S., et al. // Scand. J. Gastroenterol. – 1995. – Vol.30, N4. – P.289–299.
13. Насонов Е.Л., Каратеев А.Е. // Клин. медицина. – 2000. – №78 (3). – С.4–10.
14. Brooks P.M., Day R.O. // N. Engl. J. Med. – 1991. – Vol.324, N24. – P.1716–1725.
15. Patrono C., Coller B., Dalen J.E., et al. // Chest. – 2001. – Vol.119. – P.39–63.
16. Sagar K.A., Smyth M.R. // J. Pharm. Biomed Anal. – 1999. – Vol.21. – P.383–392.
17. Cox D., Maree A. O., Dooley M., et al. // Stroke. – 2006. – Vol.37. – P.2153–2158.
18. Pedersen A., FitzGerald G. // N. Engl. J. Med. – 1984. – Vol.311. – P.1206–1211.
19. Patrono C., Ciabattoni G. // Adv. Prostaglandin Thromboxane Res. – 1980. – Vol.6. – P.187–191.
20. Endo H., Sakaib E., Higurashib T. // Digestive and Liver Disease. – 2012. – Vol.44. – P.833–838.
21. Cox D., Maree A. O., Dooley M., et al. // Stroke. – 2006. – Vol.37. – P.2153–2158.
22. Баркаган З.С., Котовщикова Е.Ф. // Клин. фармакология и терапия. – 2004. – №13 (3). – С.1–4.
23. Верткин А.Л., Аристархова О.Ю., Адонина Е.В. и соавт. // РМЖ. Кардиология. – 2009. – №17 (9). – С.570–575.
24. Воробьева Н.М. // Медицинский совет. – 2013. – №9. – С.76–81
25. MichelsonA.D. и соавт. // Thromb. Haemost. – 2005. – Vol.3. – P.1–3.
26. Undas A., Brummel-Ziedins K.E., Mann K.G. // Blood. – 2007. – Vol.109. – Р.2285–2292.
27. Hankey G.J., Eikelboom J.W. // Lancet. – 2006. – Vol.367. – Р.606–617.
28. Patrono C., Rocca B. // Nat. Clin. Pract. Cardiovasc Med. – 2007. – Vol.4. – Р.42–50.
29. Bhatt D.L., Topol E.J. // Nature Rev. – 2003. – Vol.2. – Р.15–28.
30. Sofi F., Marcucci R., Gori A.M., et al. // Int. J. Cardiol. – 2008. – Vol.128. – Р.166–171.
31. Grosser T., Fries S., Lawson J.A., et al. // Circulation. – 2013. – Vol.127. – Р.377–385.
32. Pease A., McCall M., Tedesco T., et al. // J. Thromb. Haemost. – 2010. – Vol.8. – P.2323–2325.
Медицинские новости. – 2019. – №3. – С. 29-34.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.