Внимание! Статья адресована врачам-специалистам
Kazeko L., Kolb E., Zaharova V., Cherstvy E.
Belarusian State Medical University, Minsk
Expression of matrix metalloproteinase 13 in periodontal pathology
Резюме. В ходе исследования определяли особенности экспрессии матриксной металлопротеиназы 13 (ММР-13) при быстропрогрессирующем и хроническом периодонтите. Исследование проведено на биоптатах десны 29 пациентов, из них 12 пациентов были с признаками быстропрогрессирующего периодонтита, 17 – с хроническим периодонтитом (у 12 человек – хронический сложный периодонтит, у 5 – хронический простой периодонтит). Полученные данные позволяют рекомендовать использование оценки характера экспрессии ММР-13 в биопсийном материале ткани десны на этапе манифестации заболевания для определения прогноза течения и дифференциальной диагностики периодонтитов.
Ключевые слова: матриксная металлопротеиназа 13, периодонтит, иммуногистохимия.
Медицинские новости. – 2019. – №6. – С. 50–53.
Summary. The study is devoted to the determination of the expression of matrix metalloproteinase 13 (MMP-13) in patients with rapidly progressive and chronic periodontitis. The study was performed on biopsy specimens of the gums of 29 patients, 12 of them – with signs of rapidly progressive periodontitis, 17 – with chronic periodontitis (12 people – with chronic complex periodontitis, 5 – with chronic simple periodontitis). The obtained data allow to recommend using the assessment of the expression of the MMP-13 at the stage of disease manifestation to determine the prognosis of the course and to carry out the differential diagnosis of periodontitis.
Key words: matrix metalloproteinase 13, periodontitis, immunohistochemistry.
Meditsinskie novosti. – 2019. – N6. – P. 50–53.
Одной из актуальных проблем современной стоматологии является ранняя диагностика воспалительных заболеваний периодонта и прогнозирование характера их течения. Периодонтит – широко распространенное среди населения всех стран заболевание, при котором поражаются структуры, поддерживающие зуб [1, 2]. На возникновение и скорость развития периодонтита наряду с микробной биопленкой влияют наследственно детерминированные факторы риска, предопределяющие клиническую картину и характер течения патологии.
Неэффективность использования клинических показателей и рентгенологических данных для дифференциальной диагностики различных форм патологии со сходной клинической картиной на ранних стадиях заболевания, невозможность определения характера течения заболевания определяют необходимость поиска дополнительных диагностических параметров, позволяющих судить о прогрессировании процесса, принадлежности пациента к той или иной группе риска и эффективности проводимой терапии.
Активация каскада молекул, к которым относятся провоспалительные медиаторы, радикалы кислорода, матриксные металлопротеиназы (ММР) и их ингибиторы (TIMP), ведет к прогрессированию периодонтита [3, 4].
Разрушение коллагена типа I имеет определяющее значение в деградации соединительной ткани при периодонтите [5]. Именно поэтому ММР (цинкзависимые эндопептидазы) с коллагеназной активностью и ММР, активирующие коллагеназы, представляют интерес как потенциальные ключевые молекулы, играющие роль в патогенезе и прогнозе заболевания.
Металлопротеиназы структурно обособлены внутри лизосом и других органелл, что предохраняет внутриклеточные белки от расщепления. Внутриклеточный путь деградации белков, в том числе фибрилл коллагена, протекает главным образом внутри лизосом, куда белки попадают в результате эндоцитоза, и отвечает за локализованное и физиологическое разрушение коллагена. При повреждении тканей, а также под влиянием ряда факторов (гормоны, токсины, иммунные комплексы и др.) начинает преобладать внеклеточный путь деградации коллагена, который вызывает быстрое и генерализованное разрушение коллагена за счет выхода MMP из клеток с локальным повышением протеолитической активности [6].
В плазме крови и других биологических жидкостях, а также в разных клетках и тканях присутствуют белковые ингибиторы (в том числе TIMP), которые избирательно блокируют активность отдельных ферментов или групп ферментов. Системы таких ингибиторов осуществляют регуляцию активности пептид-гидролаз в физиологических условиях и предохраняют белки от неконтролируемого расщепления. Необходимым условием нормального протекания физиологических процессов является поддержание равновесия между активностью ММР и их ингибиторов.
Изучение качественных и количественных характеристик ММР и их ингибиторов в десневой жидкости, слюне, тканях периодонта представляет собой перспективное направление фундаментальных исследований, которое позволит разработать новые подходы к диагностике, прогнозированию течения заболеваний периодонта и лечению данной патологии.
Действие MMP-13 на ткани весьма разнообразно: от деградации соединительной ткани до участия в прогрессии опухолей. MMP-13 секретируется эпителиальными [7], эндотелиальными клетками, фибробластами [8], макрофагами, лимфоцитами и плазматическими клетками, тучными клетками [9] и нейтрофилами [10], которые играют значительную роль в инициировании и прогрессировании резорбции кости, в том числе при заболеваниях периодонта. Коллагеназа-3 (ММР-13) может разрушать фибриллярные коллагены и проявлять желатиназную активность по отношению к специфичному для нее субстрату, который включает протеогликаны, аггрекан и другие белки межклеточного матрикса (тенасцин С, фибронектин, фибриллин и коллаген IV, IX, X и XIV типов) [11].
ММР-13 в десять раз активнее других коллагеназ разрушает коллаген [5], может инициировать резорбцию костной ткани и, кроме того, активирует proMMP-9 in vitro.
У пациентов с периодонтитом ММР-13 была обнаружена в десневой жидкости как в активной форме, так и в виде профермента [12, 13], и характер ее экспрессии находился под влиянием таких цитокинов, как интерлейкин-1, фактор некроза опухоли α и простагландин E2 [6]. Ряд авторов считают, что коллагеназная активность MMP-13 может играть центральную роль в регуляции процессов периодонтальной деструкции при сахарном диабете 1-го типа, а такой показатель, как баланс ММР-7, -8, -9 и -13 в тканях десны пациентов с сахарным диабетом 1-го типа и ассоциированным с ним периодонтитом, и соотношение экспрессии MMP-13 и TIMP-1 могут отражать начало активного разрушения тканей периодонта [5].
ММР-13 активно вовлечена в процессы деструкции тканей периодонта, связанные с прогрессированием хронического периодонтита и в комплексе с ММР-9 может потенциально активировать каскад реакций, преодолевающих защитный экран TIMP-1, что может быть использовано в диагностических целях и при разработке методов лечения патологии периодонта.
Цель исследования – определить особенности экспрессии ММР-13 в тканях периодонта при различном характере течения периодонтитов.
Материалы и методы
Исследование выполнено на базе 1-й кафедры терапевтической стоматологии (ГУ «Республиканская клиническая стоматологическая поликлиника») и патологической анатомии Белорусского государственного медицинского университета. Группы исследования были представлены пациентами с признаками быстропрогрессирующего (n=12), хронического простого (n=5) и хронического сложного (n=12) периодонтита, группа сравнения – пациентами с признаками гингивита. Перед включением в исследование у всех пациентов было получено информированное согласие. Критериями включения в исследование явились клинико-рентгенологические признаки деструкции периодонта и возраст пациентов при быстропрогрессирующем периодонтите от 18 до 35 лет, при хроническом (простом и сложном) периодонтите – 36–60 лет. Критериями исключения явились: возраст пациентов до 18 лет и старше 60 лет; беременность или лактация (женщины); медицинский или психиатрический риск, нарушающий получение анамнестической информации; наличие острого инфекционного процесса челюстно-лицевой области; наличие тяжелой сопутствующей соматической и инфекционной патологии, влияющей на состояние периодонта; остеопороз и хронические заболевания, связанные с риском его развития; прием медикаментов, влияющих на минеральную плотность костной ткани (при подозрении на быстропрогрессирующее течение периодонтита).
Стоматологическое обследование включало оценку гигиены полости рта (OHI-S), оценку тяжести воспаления десны (GI), определение глубины зондирования периодонтальных карманов и утери прикрепления (LA), также фиксировались рецессия десны, поражение фуркации, патологическая миграция зубов, их подвижность, наличие окклюзионной травмы. Результаты обследования регистрировали в периодонтальной карте. Уровень и характер резорбции костной ткани оценивали при помощи панорамной рентгенографии или компьютерной томографии. С целью исключения соматической патологии, влияющей на состояние периодонта, при быстропрогрессирующем процессе были проведены лабораторные исследования (общий анализ крови, биохимический анализ крови, анализ крови на гормоны щитовидной железы), остеоденситометрия. Всем пациентам проведена профессиональная гигиена и закрытый кюретаж, во время которого выполнена биопсия мягких тканей периодонта.
В рамках проведения иммуногистохимического (ИГХ) окрашивания биопсийного материала десен с моноклональными антителами к ММР-13 фрагменты ткани фиксировались в формалине, после чего изготавливались гистологические срезы толщиной 2,5 мкм и монтировались на предметные стекла, обработанные 3-аминопропилтриэтоксисиланом. Демаскировка антигенов проводилась в течение 30 с при температуре 125 °С в нагреваемой барокамере Pascal (DAKO, Дания) в буфере pH 9,0. В качестве первичных использовались моноклональные мышиные антитела к ММР-13 (клон VIIIA2, Invitrogen, США, 1:250). Инкубация с коктейлем из первичных антител проводилась в холодильной камере при 4 °C в течение 18 ч. Детекция связавшихся антител производилась при помощи полимерной системы визуализации BioGenex Super SensitiveTM (SS) Polymer-HRP IHC Detection System (BioGenex, США). В качестве хромогена использовался диаминобензидин (DAKO, Дания), контр-окрашивание проводилось гематоксилином Майера. В качестве положительного контроля использовались срезы толстой кишки с колоректальным раком, где паттерн окраски ММР-13 заведомо известен, в качестве отрицательного контроля применялось исключение инкубации с первичными антителами из протокола окрашивания.
С целью проведения морфометрического анализа ИГХ экспрессии ММР-13 выполнялась съемка гистологических препаратов (объектив 20) каждого из случаев в 3 случайных непересекающихся полях зрения таким образом, чтобы поле зрения включало участок эпителия и стромы десны. Оценка экспрессии ММР-13 проводилась в стромальном компоненте биопсийного материала десен. Интенсивность коричневой окраски (продукты реакции ДАБ-хромогена) измерялась AperioImageScopev 9.0 автоматически и разделялась на 3 уровня интенсивности и негативную реакцию. Для анализа групп исследования с различным характером течения периодонтита и группы сравнения с использованием программы AperioImageScope по характеру цитоплазматической экспрессии ММР-13 рассчитывались следующие параметры (объектив 20):
позитивность экспрессии ММР-13 (отношение суммы пикселей иммунопозитивных участков стромы к общей сумме позитивных и негативных пикселей стромального компонента десен х 100%):
позитивность = n1 + n2 + n3/
n0 + n1 + n2 + n3 х 100%,
где n0 – число клеток с негативной реакцией;
n1 – число клеток со слабой интенсивностью реакции;
n2 – число клеток с умеренной интенсивностью реакции;
n3 – число клеток с выраженной реакцией;
коэффициент интенсивности экспрессии ММР-13 в иммунопозитивных участках (отношение суммы произведений числа позитивных пикселей на балльный эквивалент, соответствующий их интенсивности (ИГХ реакция отсутствовала – 0 баллов, слабая – 1 балл, умеренная – 2 балла, выраженная – 3 балла), к общему числу позитивных пикселей):
КЭ = 1 балл х n1 + 2 баллa х n2 +
3 баллa х n3 / n1 + n2 + n3,
где n1 – число клеток со слабой интенсивностью реакции;
n2 – число клеток с умеренной интенсивностью реакции;
n3 – число клеток с выраженной реакцией;
общий коэффициент интенсивности экспрессии ММР-13 (отношение суммы произведений числа позитивных и негативных пикселей на балльный эквивалент, соответствующий их интенсивности (ИГХ реакция отсутствовала – 0 баллов, слабая – 1 балл, умеренная – 2 балла, выраженная – 3 балла) к общему числу позитивных и негативных пикселей):
КЭ = 0 баллов х n0 + 1 балл х n1
+ 2 баллa х n2 + 3 баллa х n3 / n0
+ n1 + n2 + n3,
где n0 – число клеток с негативной реакцией;
n1 – число клеток со слабой интенсивностью реакции;
n2 – число клеток с умеренной интенсивностью реакции;
n3 – число клеток с выраженной реакцией.
Статистический анализ проводился с использованием пакета STATISTICA 10. Для оценки характера распределения полученных данных использовался критерий Шапиро – Уилка (W). Уровень статистической значимости устанавливался р<0,05. Сравнение независимых выборок по количественным признакам проводилось с использованием дисперсионного анализа непараметрических данных ANOVA и определением критериев Краскела – Уоллиса (Н-критерий) для трех и более выборок и Манна – Уитни (U-критерий) с целью парного сравнения выборок.
Результаты и обсуждение
При визуальной оценке иммуногистохимических препаратов биопсийного материала десен преобладала стромальная экспрессия ММР-13 от слабой до выраженной интенсивности ИГХ реакции. Отмечалась тенденция к большей площади экспрессии ММР-13 в группе пациентов с хроническим сложным периодонтитом от слабой до умеренно выраженной интенсивности ИГХ реакции и меньшей площади экспрессии ММР-13 в группе пациентов с быстропрогрессирующим и хроническим простым периодонтитом с преобладанием умеренно выраженной и выраженной интенсивности ИГХ окрашивания (рис. 1).
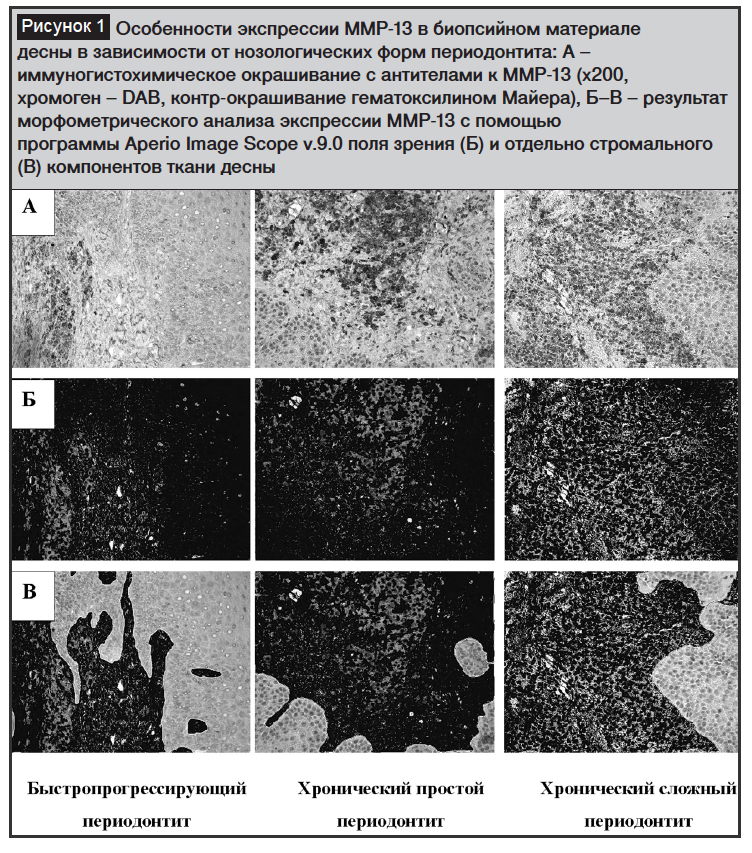
Программный анализ экспрессии ММР-13 в ткани десны выявил наибольшую позитивность экспрессии в группе хронического сложного периодонтита, а наименьшую – в группе хронического простого периодонтита (рис. 2). Одновременно, позитивность экспрессии ММР-13 в группе быстропрогрессирующего периодонтита составила 16%, была значимо меньшей, чем в группе хронического сложного периодонтита, и не имела значимых различий по данному параметру ни с хроническим простым периодонтитом, ни с группой сравнения. Похожие результаты наблюдались по данным анализа общего коэффициента интенсивности экспрессии ММР-13. Анализ же коэффициента интенсивности экспрессии ММР-13 в иммунопозитивных участках стромального компонента биопсийного материала десны выявил обратную тенденцию. Интенсивность ИГХ реакции в иммунопозитивных участках, соответствующая умеренно выраженной экспрессии, наблюдалась в группах быстропрогрессирующего и хронического простого периодонтитов (между которыми статистически значимых различий по данному параметру не выявлено) и была значимо большей, чем в группах сравнения и хронического сложного периодонтитов. При этом в группе хронического сложного периодонтита интенсивность экспрессии ММР-13 в иммунопозитивных участках соответствовала слабовыраженной ИГХ реакции и была наименьшей по сравнению со всеми исследуемыми группами.
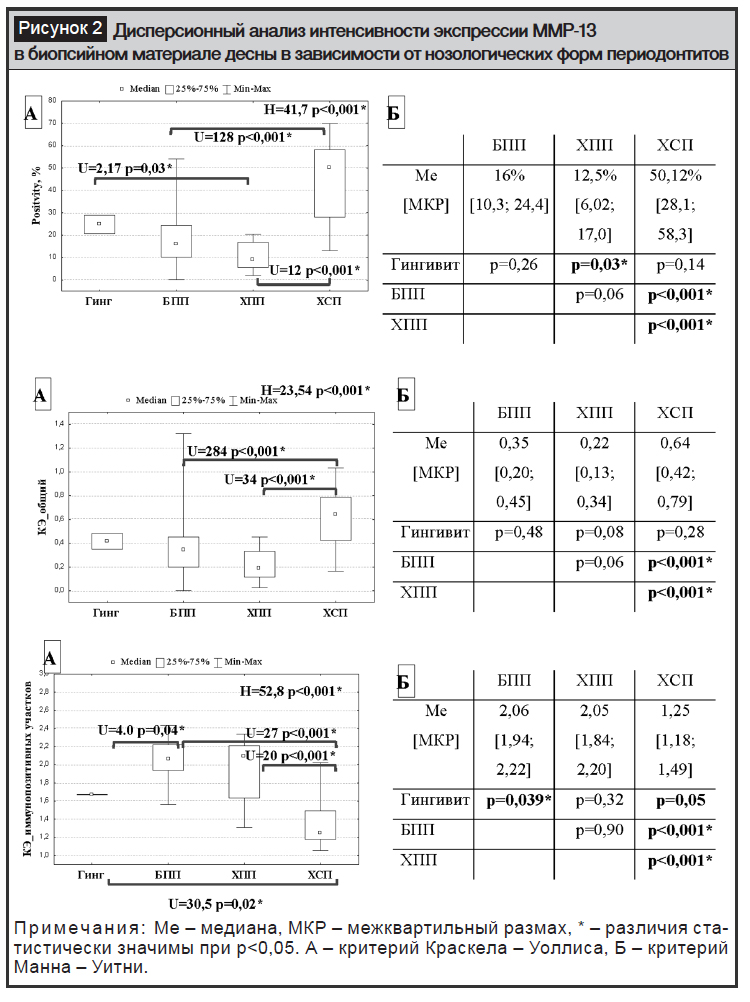
ММР-13 активируется мембрано-связанной ММР-14, проявляющей активность на поверхности клетки, вызывающей деградацию коллагенов 1-го, 2-го, 3-го типов и способной активировать другие ММР, в том числе proММР-8 и ММР-13 [14, 15]. Согласно полученным нами данным, быстропрогрессирующий периодонтит характеризовался низкой площадью экспрессии ММР-13 (Ме=16%) с умеренной и высокой интенсивностью ИГХ реакции по сравнению с хронической формой заболевания (большая площадь экспрессии, Ме=50%, со слабовыраженной интенсивностью ИГХ реакции при хроническом сложном периодонтите), что предполагает потенциальную роль ММР-13 как маркера хронического течения процесса и позволяет использовать иммуногистохимическое окрашивание с моноклональными антителами к ММР-13 как дополнительный метод диагностики и прогнозирования течения периодонтита на ранних стадиях заболевания [16].
Заключение
Особенности экспрессии ММР-13 при быстропрогрессирующем периодонтите заключаются в малой площади стромальной экспрессии данного маркера (Ме=16%), не превышающей в большинстве случаев 25%, при умеренной интенсивности ИГХ реакции в иммунопозитивных участках.
Хронический простой и сложный периодонтиты по результатам проведенного исследования имеют различный характер экспрессии ММР-13. Так, хронический простой периодонтит характеризуется малой площадью (12,5%) с преобладанием умеренной интенсивности стромальной экспрессии ММР-13, а хронический сложный – большей площадью (Ме=50,12%) с преобладанием слабовыраженной ИГХ реакции в иммунопозитивных участках.
Полученные данные позволяют рекомендовать использование оценки характера экспрессии ММР-13 в биопсийном материале десны на этапе манифестации заболевания для определения прогноза течения и дифференциальной диагностики периодонтита:
?в качестве самостоятельного маркера для дифференциальной диагностики быстропрогрессирующего и хронического сложного периодонтита;
?в качестве дополнительного маркера в комплексе с клинико-рентгенологическими данными для дифференциации быстропрогрессирующего и хронического простого периодонтита.
Л И Т Е Р А Т У Р А
1. KinaneD.F. // Periodontol. 2000. – 2001. – №25. – P.8–20.
2. American Academy of Periodontology. – http://www.perio.org.
3. Cavalla F. [et al.] // Int. Journal of Mol. Sciences. – 2017. – Vol.18. – P.440.
4. Reboul P. [et al.] // J. Clin. Invest. – 1996. – Vol.97. – P.2011–2019.
5. Hernandez M. [et al.] // J. Periodontol. – 2010. – Vol.81. – P.1644–1652.
6. Meikle M.C. [et al.] // J. Periodontal. Res. – 1994. – Vol.29. – P.118–126.
7. Nagasupriya A. [et al.] // Int. J. Periodontics. Restorative Dent. – 2014. – Vol.34, N4. – P.79–84.
8. Joan K.H. [et al.] // J. Periodontal Res. – 1982. – Vol.17. – P.183–190.
9. Girolamo N.Di. [et al.] // J. Leukoc. Biol. – 1997. – Vol.61, N6. – P.667–678.
10. Alfant B. [et al.] // Journal of Periodontology. – 2008. – Vol.79, N5. – P.819–826.
11. Hernandez M. [et al.] // J. Periodontol. – 2006. –Vol.77. – P.1863–1870.
12. Tervahartiala T. [et al.] // J. Dent. Res. – 2000. – Vol.79. – Р.1969–1977.
13. Kiili M. [et al] // J. Clin. Periodontol. – 2002. – Vol.29. – Р.224–232.
14. Cox S.W., Eley B.M., Kiili M. // J. Oral Dis. – 2006. – Vol.12. – Р.34–40.
15. Dahan M., Nawrocki B., Elkaim R. // J. Clin. Perio-dontol. – 2001. – Vol.28. – Р.128–136.
16. КазекоЛ.А., РукшаК.Г., ПортянкоА.С., ЛетковскаяТ.А., ЧерствыйЕ.Д. // Здравоохранение. – 2017. – №12. – С.46–49.
Медицинские новости. – 2019. – №6. – С. 50-53.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.