Внимание! Статья адресована врачам-специалистам
VdovichenkoV.P.1, BronskayaG.M.2, BorisenokO.A.1, KorshakT.A.1
1Grodno State Medical University, Belarus
2Gomel State Medical University, Belarus
Risk factors for vitamin B12 deficiency and its effects
Резюме. Дефицит витамина B12 встречается гораздо чаще, чем это представлялось ранее и не является синонимом термина «анемия». Основными причинами дефицита витамина B12 являются нарушение его всасывания в ЖКТ, пернициозная анемия, послеоперационная мальабсорбция и нехватка его в потребляемой пище. Дефицит витамина B12 наиболее вероятен у пожилых людей, при наличии хронических заболеваний органов пищеварения, после хирургических вмешательств (резекции желудка, подвздошной кишки, холецистэктомии), на фоне вегетарианской диеты, при длительном применении некоторых лекарств (ингибиторов протонного насоса, блокаторов Н2-рецепторов, метформина). Однако во многих случаях причина дефицита витамина B12 остается неизвестна. Наиболее удобным для пациента и, одновременно, эффективным путем поддержания надлежащего уровня этого витамина в организме является пероральное назначение препаратов витамина B12.
Ключевые слова: витамин B12, гиповитаминоз, анемия, когнитивные нарушения.
Медицинские новости. – 2019. – №8. – С. 13–18.
Summary. Vitamin B12 deficiency is more common than previously thought and is not synonymous with anemia. The main causes of vitamin B12 deficiency are impaired absorption in the gastrointestinal tract, pernicious anemia, postoperative malabsorption and its insufficient content in food consumed. Vitamin B12 deficiency is most likely in the elderly, in the presence of chronic diseases of the digestive system, after surgical interventions (resection of the stomach, ileum and cholecystectomy), vegetarian diet, long-term use of certain drugs (proton pump inhibitors, H2-receptor blockers, metformin). However, in many cases, the cause of vitamin B12 deficiency remains unknown. The most convenient way for the patient and, at the same time, an effective way to maintain the proper level of vitamin B12 in the body is the oral intake of B12 supplements.
Keywords: vitamin B12, hypovitaminosis, anemia, cognitive impairment.
Meditsinskie novosti. – 2019. – N8. – P. 13–18.
Общая характеристика витамина B12
Витамин B12 – собирательное название четырех биологически активных соединений, содержащих в составе кобальт. Наиболее частая форма витамина B12, в которой он поступает в организм, – цианокобаламин, реже – гидроксокобаламин; в организме эти формы метаболизируются в метилкобаламин и 5-дезоксиаденозилкобаламин, которые и участвуют в биологических процессах [26, 36, 37, 75, 82]. Рекомендуемая суточная норма витамина B12 составляет 2,4 мкг, для беременных – 3,5 мкг [64]. Запасы организма составляют 2–5 мг, а время их истощения составляет 2–5 лет.
Достаточный уровень B12 в организме – результат сложных и многофакторных процессов. Так, для абсорбции B12 из пищи необходимо нормальное функционирование слюнных желез, главных и париетальных клеток желудка, энтероцитов подвздошной кишки.
Витамин B12 природного происхождения (как правило, цианокобаламин) поступает в организм с пищей в связанном с белками виде, абсорбируется в подвздошной кишке, но до этого происходит ряд важных процессов. Слюнными железами вырабатывается важный для метаболизма витамина B12 белок – R-протеин (гаптокоррин или кобалофилин), который нужен для защиты B12 от разрушения в кислой среде желудка. Благодаря активности соляной кислоты и пепсина [42] в желудке витамин B12 высвобождается из связанного с пищевыми белками состояния и сразу же связывается с R-протеином. Этот комплекс связывается с протеином, названным внутренним фактором Кастла(гликопротеином, секретируемым париетальными клетками желудка). В двенадцатиперстной кишке протеазы отщепляют R-пептид, после чего комплекс B12 + внутренний фактор распознается рецепторами поглощающих энтероцитов и может быть абсорбирован за счет рецептор-опосредованного эндоцитоза в дистальном отделе подвздошной кишки [42, 47]. Таким образом осуществляется активный транспорт витамина B12 и поскольку он зависит от транспортных белков и протеинов, количество абсорбируемого таким путем B12, ограничено и составляет максимально 1,5 мкг, независимо от принятой дозы. Интересно, что при приеме высоких доз (свыше 100 мкг) витамин B12 может быть абсорбирован и другим, пассивным, путем, который не требует вовлечения транспортных белков и внутреннего фактора. Этот факт нашел применение в создании лекарственных препаратов для перорального восполнения дефицита B12. При этом в лекарственное средство включен витамин B12 в свободной форме, таблетки покрыты кишечно-растворимой оболочкой (для полноценной абсорбции в этом случае нет необходимости ни в связывании с R-протеином слюны, ни в отщеплении белкового компонента соляной кислотой) и в высоких дозах (абсорбция будет идти пассивно, связывание с внутренним фактором Кастла при этом не нужно). Таким образом, даже у пациентов с дефицитом B12 и заболеваниями желудочно-кишечного тракта (ЖКТ), восполнение цианокобаламина пероральными препаратами в высоких дозах возможно и эффективно.
После абсорбции витамин B12 связывается с транспортными протеинами-транскобаламинами (I, II, III тип), которые способствуют переходу цианокобаламина в активные формы и выполнению физиологической роли.
Витамин B12 действует как кофактор для метионинсинтазы и L-метилмалонил-КоА мутазы. Метионинсинтаза катализирует превращение гомоцистеина в метионин [25, 42]. Метионин необходим для образования S-аденозилметионина, универсального донора метила для почти 100 различных субстратов, включая ДНК, РНК, гормоны, белки и липиды. После превращения пропионовой кислоты в L-метилмалонил-КоА под действием метилмалонил-КоА мутазы переходит в сукцинил-КоА [25, 26, 42]. Сукцинил-КоА играет важную роль в жировом и белковом обмене, а также необходим для синтеза гемоглобина.
Таким образом, для определения дефицита витамина B12 можно использовать как показатели сывороточного уровня B12, так и оценивать его активность по уровню транспортного белка (транскобаламина), а также косвенно – по повышению уровней гомоцистеина и метилмалоновой кислоты, которые в случае дефицита витамина B12 не метаболизируются в достаточной степени, вследствие чего их уровень повышается (рисунок).
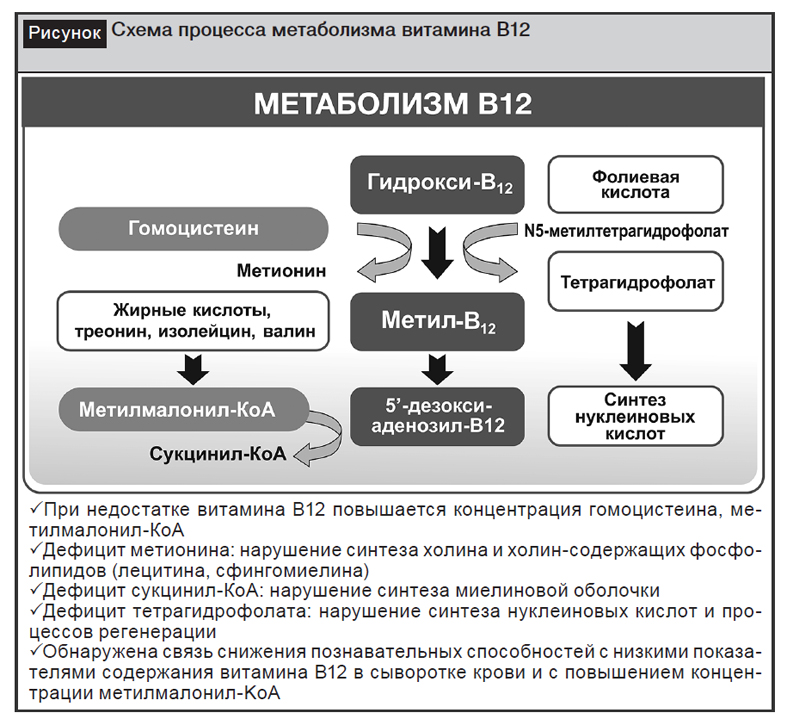
Уровень витамина B12 оценивается по показателям в сыворотке или плазме. Значения ниже 170–250 пг/мл (120–180 пикомоль/л) для взрослых [42] указывают на дефицит витамина B12, хотя его уровень в сыворотке крови не всегда точно коррелирует с его внутриклеточными концентрациями [25]. Повышенный уровень гомоцистеина в сыворотке (значения >13 микромоль/л) также может указывать на дефицит витамина B12 [17, 42]. Однако этот показатель низкоспецифичен из-за влияния иных факторов, таких как низкий уровень витамина B6 или фолиевой кислоты [42]. Повышенные уровни метилмалоновой кислоты (значения >0,4 микромоль/л) могут служить более надежным показателем уровня витамина B12, поскольку они высокоспецифичны для его дефицита [25, 42, 47].
Витамин B12 необходим для эритропоэза, функционирования центральной и периферической нервной системы, а также для синтеза ДНК [26, 37, 36, 42, 82]. Признаками дефицита витамина B12, помимо мегалобластной анемии (13–15% случаев дефицита [2]), являются неврологические нарушения: парестезии, онемение, нарушение координации движений, атаксия, нарушения памяти, когнитивные расстройства и расстройства личности. Показано, что ухудшение когнитивных функций вследствие дефицита витамина В12 и фолиевой кислоты может достигать степени деменции [61]. Когнитивные нарушения при дефиците витамина B12 могут сопровождаться поражением других отделов центральной нервной системы, в частности, кортикоспинального пути, реже – стволовыми и мозжечковыми расстройствами [1]. Важным аспектом дефицита витамина B12 является то, что неврологические симптомы могут возникать гораздо раньше гематологических изменений [1]. Уровни витамина B12 в субклиническом низком нормальном диапазоне (<250 моль/л) связаны с болезнью Альцгеймера, сосудистой деменцией. Дефицит витамина B12 (<150 моль/л) и связанный с ним избыток гомоцистеина могут проявляться нарушениями познавательных функций и мыслительных процессов, что может вызывать нарушения концентрации внимания, ухудшение памяти, снижение способности к усвоению нового материала, нарушение исполнительских функций, снижение скорости психомоторных реакций.
Поэтому при нарушении когнитивных функций и подозрении на деменцию, особенно среди пациентов из групп риска, рекомендуют исключить дефицит витамина B12 [38]. Низкие уровни витамина B12 в сыворотке связаны с нейродегенеративными заболеваниями и когнитивными нарушениями, при этом терапия витамином B12 не улучшает когнитивные функции у пациентов без ранее существовавшего дефицита [60]. У пациентов с дефицитом витамина B12 (уровень витамина B12 в сыворотке <150 моль/л или уровень гомоцистеина в сыворотке >19,9 мкмоль/л) препараты витамина B12, назначаемые перорально или парентерально в высокой дозе (1 мг в день), не только устраняли биохимический дефицит витамина, но и улучшали когнитивные функции.
Категории населения с дефицитом (или риском возникновения дефицита) витамина B12
Дефицит витамина B12 встречается гораздо чаще, чем это представлялось ранее [2]. Дефицит витамина B12 не является синонимом понятия «анемия» [2]. Основными причинами возникновения дефицита витамина B12 являются нарушение всасывания витамина с пищей, гипохлоргидрия, послеоперационная мальабсорбция, пернициозная анемия, а также низкое содержание витамина B12 в потребляемой пище [17, 42]. Нехватка витамина B12 наиболее вероятна у людей старшей возрастной группы, при наличии воспалительных заболеваний кишечника (тонкой кишки), резекция желудка или тонкой кишки, после длительной веганской диеты (то есть без мяса, птицы или молочных продуктов), на фоне длительного (не менее 12 месяцев) применения блокаторов Н2-рецепторов, ингибиторов протонного насоса или метформина (более 4 месяцев) [28, 35, 39, 77]. Люди с дефицитом витамина B12 нередко имеют характерную сопутствующую патологию – аутоиммунные болезни (среди них самой частой является патология щитовидной железы – около 50% всей патологии данной группы) и болезни, при которых нарушается физиологический обмен витамина B12 в организме (заболевания ЖКТ) [2]. Холецистэктомия также является фактором риска развития дефицита витамина B12 [2]. Однако во многих случаях причина возникновения дефицита витамина B12 остается неизвестна. К числу наиболее склонных к дефициту витамина B12 относят следующие категории населения.
Пожилые люди
У 20–40% пожилых людей встречается нарушение всасывания витамина B12 вследствие атрофического или хеликобактерного гастрита [17, 42, 43, 48]. При этом требуется назначение препаратов, содержащих витамин B12, или употребление пищи, обогащенной этим витамином. Например, в США, согласно официальным рекомендациям, люди старше 50 лет должны получать большую часть рекомендуемого дневного потребления витамина B12 из фармацевтических препаратов или обогащенных продуктов [42]. При этом указывается на предпочтительность перорального пути введения [18].
Пациенты с пернициозной анемией
Пернициозная анемия является аутоиммунным заболеванием, которое поражает слизистую оболочку желудка и характеризуется отсутствием выработки внутреннего фактора Кастла, необходимого для абсорбции витамина B12 в кишечнике [43]. Классическая пернициозная анемия составляет не более 13–15% от всех случаев дефицита B12 и, скорее всего, является результатом длительного существования этого дефицита, который осложнился гемолизом [2]. Эпидемиологическое исследование, проведенное в США среди пожилых людей (>60 лет), показало, что 1,9% обследованных имели нераспознанную и нелеченую пернициозную анемию [17]. У пациентов с пернициозной анемией невозможен физиологический путь абсорбции витамина B12, даже при достаточном поступлении его с пищей [26, 42], поэтому требуется назначение высоких доз (1000 мкг/день) витамина B12 [6, 19, 78]. При этом пероральный прием витамина B12 по эффективности не уступает парентеральному [17, 79].
Пациенты с заболеваниями желудочно-кишечного тракта
У пациентов с нарушениями функции желудка или кишечника, такими как целиакия и болезнь Крона, в силу основного заболевания, может быть нарушена абсорбция витамина B12 из пищи, что и приводит к дефициту витамина B12 [17]. Незначительно сниженная когнитивная функция (нарушение концентрации внимания, ухудшение памяти, снижение способности к усвоению нового материала, снижение скорости психомоторных реакций), обусловленная ранним дефицитом витамина B12, может быть единственным и ранним проявлением дефицита, к которому впоследствии присоединяются мегалобластная анемия и деменция [17].
Пациенты, перенесшие желудочно-кишечные операции
Хирургические вмешательства на ЖКТ (полная или частичная резекция желудка) приводят к потере клеток, которые выделяют соляную кислоту и внутренний фактор [13, 42, 71]. Это нарушает высасывание витамина B12, поступающего с пищей [31]. Хирургическое удаление дистального отдела подвздошной кишки также может привести к неспособности усваивать витамин B12. Лицам, перенесшим такие хирургические вмешательства, рекомендуется мониторинг уровня витамина B12 и прием соответствующих препаратов [27].
Вегетарианцы
Вегетарианство способствует снижению уровня витамина B12, что потенциально повышает риск возникновения когнитивных нарушений [60]. Строгие вегетарианцы и веганы подвержены большему риску развития дефицита витамина B12, чем оволактовегетарианцы и невегетарианцы, поскольку натуральные пищевые источники витамина B12 ограничены продуктами животного происхождения [42]. Изучали последствия низкого потребления витамина B12 на когнитивные функции у подростков 10–16 лет, которые до 6-летнего возраста находились на вегетарианской диете. Обнаружено, что хронический дефицит этого витамина приводил к ухудшению когнитивных функций у подростков, при этом гематологические признаки дефицита B12 отсутствовали [54].
Таким образом, питание строгих вегетарианцев и веганов рекомендуется обогащать витамином B12 (обогащенные зерновые хлопья для завтрака, обогащенные питательные дрожжи), при неэффективности этих мер – прием лекарственных средств для поддержания необходимого уровня B12.
Беременные и кормящие женщины, соблюдающие строгие вегетарианские диеты, и их дети
Витамин B12 проникает через плаценту во время беременности и проникает в грудное молоко. Показано, что младенцы матерей-вегетарианок, находящиеся на грудном вскармливании, получают недостаточно витамина B12, что ведет к развитию у них в течение нескольких месяцев после рождения дефицита витамина B12 [42, 81]. Недиагностированный и нелеченый дефицит витамина B12 у младенцев может привести к серьезным и необратимым неврологическим повреждениям. Американская диетическая ассоциация рекомендует дополнительное потребление витамина B12 для женщин, придерживающихся веганства и оволактовегетарианства, во время беременности и кормления грудью, чтобы обеспечить поступление достаточного количества витамина B12 для плода и младенца [44]. Беременные и кормящие женщины, соблюдающие строгие вегетарианские или веганские диеты, должны проконсультироваться с педиатром относительно надлежащего приема витамина B12 их детьми [71].
Дефицит витамина B12 и заболевания
Деменция и когнитивная функция
Исследователей давно интересовала потенциальная связь между дефицитом витамина B12 и деменцией [7, 16, 57, 58, 67]. Дефицит витамина B12 вызывает накопление гомоцистеина в крови и может снизить уровень веществ, необходимых для обмена нейромедиаторов [25, 40]. Обсервационные исследования показывают положительную связь между повышенными уровнями гомоцистеина и частотой как болезни Альцгеймера, так и деменции [25, 67, 68]. Назначение фолиевой кислоты и витамина B12 у людей с повышенным уровнем гомоцистеина было эффективно в снижении его уровня и помогало поддерживать или улучшать когнитивные функции [3]. Низкий уровень витамина B12 также был положительно связан с когнитивными нарушениями у здоровых пожилых людей [22]. Симптомы дефицита этого витамина включают замедление процесса мышления, ухудшение памяти и внимания, снижение способности к усвоению нового материала, сокращение скорости психомоторных реакций, ухудшение исполнительских функций, при прогрессировании – неврологические дефициты и слабоумие. У взрослых пациентов отмечена также оптическая невропатия [12]. Среди пожилых людей с хорошей структурой питания низкий уровень витамина B12 связан с когнитивным дефицитом, особенно у людей с аллелем ApoE?4 или с депрессией [80].
В двойном слепом рандомизированном одноцентровом исследовании определяли, могут ли добавки с витаминами группы В, снижающими уровень общего гомоцистеина в плазме крови, замедлить скорость процессов атрофии головного мозга у пациентов с легкими когнитивными нарушениями (mild cognitive impairment – МСI) [69]. В это исследование были включены люди (n=168) с МСI в возрасте ≥70 лет. Участники исследования были разделены на две равные по числу пациентов группы. Одной из них в течение 2 лет ежедневно назначались витамины группы В в следующих суточных дозах: 0,8 мг фолиевой кислоты, 0,5 мг витамина B12 и 20 мг витамина B6. Другая группа получала плацебо. Средний уровень общего гомоцистеина в плазме был на 30% ниже у тех участников исследования, которые получали витамины группы В. Большая скорость атрофии головного мозга у пожилых людей с легкими когнитивными нарушениями может быть замедлена лечением витаминами группы B, снижающими уровень гомоцистеина [69]. Практическая важность исследования заключается и в том, что у 16% людей старше 70 лет имеются легкие когнитивные нарушения, и у половины из них позднее развивается болезнь Альцгеймера [69]. Таким образом, витамины группы B замедляют дальнейшее когнитивное и клиническое прогрессирование у пациентов с уже имеющимися умеренными когнитивными нарушениями, особенно на фоне повышенного уровня гомоцистеина [29].
Несмотря на доказательства того, что витамин B12 снижает уровень гомоцистеина, корреляцию между низким уровнем витамина B12 и снижением когнитивных функций, исследования не показали, что витамин B12 оказывает независимое влияние на когнитивные функции [4, 23, 33, 41, 45]. Известно, что низкое потребление витамина B12 распространено в Южной Азии. Изучалась связь между потреблением витамина B12 в младенчестве (2–12 месяцев) у непальских детей и их общим развитием и когнитивными функциями 5 лет спустя. Недостаточное потребление витамина B12, как оказалось, связано с нарушениями развития детей и их зрительно-пространственных способностей к пятому году жизни [49]. Как отмечалось выше, прием витамина B12, фолиевой кислоты и витамина B6 не снижал риск развития серьезных сердечно-сосудистых событий у женщин [5, 27]. В этом же исследовании в подгруппе женщин с низким исходным потреблением витаминов группы В показано, что эти витамины значительно замедляли снижение когнитивных функций.
Сердечно-сосудистые заболевания
Сердечно-сосудистые заболевания являются наиболее распространенной причиной смерти в промышленно развитых странах. Факторы риска сердечно-сосудистых заболеваний включают повышенные уровни липопротеинов низкой плотности (ЛПНП), высокое кровяное давление, низкие уровни липопротеинов высокой плотности (ЛПВП), ожирение и диабет [62]. Повышенные уровни гомоцистеина также были определены как независимый фактор риска развития сердечно-сосудистых заболеваний [51, 65, 67]. Гомоцистеин – серосодержащая аминокислота, которая обычно присутствует в крови, образуется из метионина. Считается, что повышенные уровни гомоцистеина способствуют тромбообразованию, перекисному окислению липидов, нарушают эндотелиальную вазомоторную функцию и вызывают пролиферацию гладких мышц сосудов [56, 65, 67]. Данные ретроспективных и проспективных исследований связывают повышенные уровни гомоцистеина с ишемической болезнью сердца и инсультом [56, 65]. Витамин B12, фолиевая кислота и витамин В6 участвуют в метаболизме гомоцистеина. При недостатке витамина B12 уровень гомоцистеина может повышаться из-за неадекватной функции метионинсинтазы [21, 25].
Результаты нескольких рандомизированных контролируемых исследований показывают, что комбинация витамина B12 и фолиевой кислоты с витамином В6 или без него снижают уровень гомоцистеина у людей с сердечно-сосудистыми заболеваниями или диабетом, а также у молодых взрослых женщин [5, 10, 14, 21, 24, 32, 50, 53, 74]. В другом исследовании у пожилых мужчин и женщин, которые принимали поливитаминные/мультиминеральные добавки в течение 8 недель, наблюдалось значительное снижение уровня гомоцистеина [59]. Хотя прием фолиевой кислоты и витамина B12 снижает уровень гомоцистеина, это, согласно результатам ряда крупных проспективных исследований, не снижает риск развития сердечно-сосудистых заболеваний [5, 10, 24, 32, 51, 53, 74]. Женщины с высоким риском возникновения сердечно-сосудистых заболеваний, принимавшие ежедневно препараты, содержащие 1 мг витамина B12, 2,5 мг фолиевой кислоты и 50 мг витамина B6 в течение 3 лет, не продемонстрировали снижения риска серьезных сердечно-сосудистых событий, несмотря на снижение уровня гомоцистеина [5, 27]. Испытание по оценке профилактики исходов сердечной деятельности (HOPE), в котором участвовало 5522 пациента старше 54 лет с сосудистыми заболеваниями или диабетом, показало, что ежедневное назначение 2,5 мг фолиевой кислоты, 50 мг витамина B6 и 1 мг витамина B12 снижало уровень гомоцистеина, но не уменьшало риск развития серьезных сердечно-сосудистых событий [53]. В испытаниях по витаминной терапии в Западной Норвегии, в которых участвовали 3096 пациентов, ежедневный прием 0,4 мг витамина B12 и 0,8 мг фолиевой кислоты с или без 40 мг витамина B6 в течение 1 года снижал уровень гомоцистеина на 30%, но не влиял на смертность или риск возникновения серьезных сердечно-сосудистых событий в течение 38 месяцев наблюдения [69]. Норвежское исследование витаминов «NORVIT» и исследование «Витаминная интервенция для профилактики инсульта» показали аналогичные результаты [10, 74]. Американская кардиологическая ассоциация пришла к выводу, что имеющихся данных недостаточно для подтверждения роли витаминов группы В в снижении сердечно-сосудистого риска [51].
Взаимодействие витамина B12 с лекарствами
Некоторые виды лекарств могут отрицательно влиять на уровень витамина B12 в организме, особенно при продолжительном приеме.
Лекарственные средства, снижающие выделение соляной кислоты в желудке
Ингибиторы протонного насоса (омепразол и др.), использующиеся для лечения состояний, связанных с повышенной кислотностью, из-за снижения кислотности теоретически могут нарушать всасывание витамина B12 из пищи [11, 39, 46]. Имеющиеся фактические данные по этому вопросу противоречивы [30, 66, 73, 77]. Тем не менее, следует иметь в виду, что уровень витамина B12 у пациентов, принимающих ингибиторы протонного насоса в течение длительного времени, может быть снижен. Антагонисты Н2-рецепторов (ранитидин и др.) при постоянном длительном (более 2 лет) приеме могут приводить к вероятному дефициту витамина B12 [34].
Метформин
Метформин – гипогликемическое средство для лечения сахарного диабета II типа, снижает всасывание витамина B12 у 10–30% пациентов, вероятно, вследствие изменения моторики кишечника, его флоры или нарушения всасывания витамина B12 в подвздошной кишке [8, 15, 52]. В рандомизированном плацебо-контролируемом исследовании у пациентов с диабетом II типа лечение метформином в течение 4 лет снижало уровни витамина B12 на 19% и повышало риск дефицита витамина B12 на 7,2% по сравнению с плацебо [28]. При снижении уровня витамина B12 на фоне приема метформина увеличивается риск возникновения когнитивных нарушений [60].
Восполнение дефицита B12
Для профилактики гиповитаминоза B12 наиболее удобным является пероральный путь назначения [6]. Профилактика дефицита витамина B12 может проводиться в группах риска (гипо-ахлоргидрия, вегетарианство, пожилой возраст, прием некоторых медикаментов) путем использования специальных обогащенных пищевых (например, продукты, предназначенные для питания вегетарианцев: соевое молоко, пищевые дрожжи, кукурузные хлопья и т.д. [42, 70, 75, 76]). При лечении гиповитаминозов, витамин B12 назначают в виде фармакологических препаратов, как парентеральных, так и энтеральных (таблетки, сублингвальные таблетки и пастилки). Витамин B12 обычно назначают в виде препаратов цианокобаламина, иногда – гидроксокобаламина, которые в организме переходят в активные формы метилкобаламин и 5-дезоксиаденозилкобаламин [6, 42].
При приеме пероральных высокодозированных препаратов витамина B12 усвоение складывается из возможностей абсорбции с участием внутреннего фактора (максимум 1,5 мкг/сутки) и возможностей пассивной абсорбции, которая становится возможной при приеме высоких доз витамина B12 перорально. Например, при приеме таблетки 500 мкг, у здоровых людей всасывается только около 10 мкг [8].
Участие в метаболических процессах витамина B12, поступающего в организм, ограничено его связыванием с белком-переносчиком плазмы крови (транскобаламином), ведь именно связанный с транскобаламином B12 является биологически активным. Таким образом, парентеральное (внутримышечное) и пероральное введение витамина B12 по терапевтическому эффекту являются сопоставимыми.
Следует отметить, что сублингвальные формы витамина B12 не имеют преимуществ по биодоступности, по сравнению с таблетками, назначаемыми внутрь [42, 70, 75, 76]. Также существует лекарственная форма витамина B12 в виде интраназального геля, которая изучена в клинических условиях менее других [72].
При лечении пациентов с дефицитом витамина B12 результаты контролируемых исследований не показали различий уровня витамина B12 в плазме крови при его парентеральном назначении (внутримышечно) или приеме внутрь [9, 20, 48]. Данные Кокрейновского исследования свидетельствуют, что пероральное назначение больших доз витамина B12 – 2000 мкг в день или 1000 мкг сначала ежедневно, затем еженедельно, а потом ежемесячно – столь же эффективно для устранения гематологических и неврологических нарушений у пациентов с дефицитом витамина B12, как и его внутримышечное введение [79]. Результаты обсервационных исследований также доказывают сопоставимую эффективность внутримышечного (1000 мкг/сутки) и перорального (1000 мкг/сутки) путей назначения витамина B12 для коррекции его дефицита. Продолжительность пероральной терапии у пациентов колебалась от 3 до 18 месяцев. Исследование доказало, что пероральная терапия была эффективной, поддерживая надлежащие уровни B12 в сыворотке крови у всех пациентов. При этом подавляющее большинство пациентов (87%) выразили предпочтение пероральной терапии внутримышечным инъекциям [63].
Случаи передозировки (гипервитаминоз) B12 неизвестны [42]. В исследованиях NORVIT и HOPE прием витамина B12 (в сочетании с фолиевой кислотой и витамином B6) не вызывал каких-либо серьезных побочных эффектов при потреблении в дозах 0,4 мг в течение 40 месяцев (NORVIT) и 1,0 мг – в течение 5 лет (HOPE) [10, 53].
Тем не менее, при отсутствии возможного дефицита B12 его применение не является обоснованным. Например, он не эффективен у спортсменов для повышения выносливости [55].
Заключение
Дефицит витамина B12 встречается гораздо чаще, чем это представлялось ранее. Существует ряд причин развития дефицита витамина B12, при этом во многих случаях причина возникновения такового остается неизвестной. Гиповитаминоз B12 не является синонимом B12-дефицитной анемии и может проявляться снижением когнитивных функций, ухудшением памяти, внимания, неврологическим дефицитом.
Удобным для пациента и эффективным путем поддержания надлежащего уровня витамина B12 в организме является пероральное назначение препаратов витамина B12.
Л И Т Е Р А Т У Р А
1. Камчатнов П.Р., Дамулин И.В. // Клиницист. – 2015. – Т.9, №1. – С.18–23.
2. Перекатова Т.Н., Остроумова М.Н. // Клиническая онкогематология: фундаментальные исследования и клиническая практика. – 2009. – Т.2, №2. – С.185–195.
3. Agrawal A., et al. // Behav. Brain Res. – 2015. – Vol.283. – P.139–144.
4. Aisen P.S., et al. // JAMA. – 2008. – Vol.300. – P.1774–1783.
5. Albert C.M., et al. // JAMA. – 2008. – Vol.299 – P.2027–2036.
6. Andres E., et al. // Int. J. Lab. Hem. – 2009. – Vol.31 – Р.1–8.
7. Balk E.M., et al. // Arch. Intern Med. – 2007. – Vol.2. – Р.21–30.
8. Bauman W.A., et al. // Diabetes Care. – 2000. – Vol.23 – Р.1227–1231.
9. Bolaman Z., et al. // Clin. Ther. – 2003. – Vol.25, N12. – Р.3124–3134.
10. Bønaa K.H., et al. // N. Engl. J. Med. – 2006. – Vol.354 – Р.1578–1588.
11. Bradford G.S., Taylor C.T. // Ann. Pharmacother. – 1999. – Vol.33 – P.641–643.
12. Briani C., et al. // Nutrients. – 2013. – Vol.5, N11. – P.4521–4539.
13. Brolin R.E., et al. // J. Gastrointest. Surg. – 1998. – Vol.2. – P.436–442.
14. Bronstrup A., et al. // Am. J. Clin. Nutr. – 1998. – Vol.68. – P.1104–1110.
15. Buvat D.R. // Am. Fam. Physician. – 2004. – Vol.69. – P.264.
16. Carmel R. // Curr. Opin. Hematol. – 1994. – Vol.1. – P.107–112.
17. Carmel R. // Arch. Intern. Med. – 1996. – Vol.156. – P.1097–1100.
18. Carmel R., Sarrai M. // Curr. Hematol. Rep. – 2006. – Vol.5. – P.23–33.
19. Carmel R. // Blood. – 2008. – Vol.112, N6. – Р.2214–2221.
20. Castelli M.C., et al. // Clin. Ther. – 2011. – Vol.33, N3. – P.358–371.
21. Clarke R. // Br. Med. J. – 1998. – Vol.316. – P.894–898.
22. Clarke R., et al. // Am. J. Clin. Nutr. – 2007. – Vol.86. – P.1384–1391.
23. Clarke R., Harrison G., Richards S. // J. Intern. Med. – 2003. – Vol.254. – P.67–75.
24. Clarke R., et al. // Curr. Opin. Clin. Nutr. Metab. Care. – 2007. – Vol.10. – P.32–39.
25. Clarke R. // Curr. Proc. Nutr. Soc. – 2008. – P.75–81.
26. Combs G. Vitamin B12 in The Vitamins. – New York, 1992.
27. Lehman Center Weight Loss Surgery Expert Panel / Mode of access – https://www.betsylehmancenterma.gov/ – Date of access. – 2007
28. de Jager J., et al. // BMJ. – 2010. – Vol.20, N340. – P.2181.
29. de Jager C.A., et al. // Int. J. Geriatr. Psychiatry. – 2012. – Vol.27, N6. – P.592–600.
30. Den Elzen W.P., et al. // Aliment Pharmacol. Ther. – 2008. – Vol.2. – P.491–497.
31. Doscherholmen A., Swaim W.R. // Gastroenterology. – 1973. – Vol.64. – P.913–919.
32. Ebbing M., et al. // JAMA. – 2000. – Vol.300. – P.795–804.
33. Eussen S.J., et al. // Am. J. Clin. Nutr. – 2006. – Vol.84. – P.361–370.
34. Force R.W., Nahata M.C. // Ann. Pharmacother. – 1999. – Vol.26. – P.1283–1286.
35. Heidelbaugh J.J., Goldberg K.L., Inadomi J.M. // Am. J. Gastroenterol. – 2009. – Vol.104 (Suppl.2). – S27–32.
36. Herbert V., Das K. Vitamin B12 in Modern Nutrition in Health and Disease. – Baltimore, 1994.
37. Herbert V. Vitamin B12 in Present Knowledge in Nutrition. – Washington, 1996.
38. Howard H. Feldman, et al. // CMAJ. – 2008. – Vol.178, N7. – P.825–836.
39. Howden C.W. // J. Clin. Gastroenterol. – 2000. – Vol.30. – P.29–33.
40. Hutto B.R. // Compr. Psychiatr. – 1997. – Vol.38. – P.305–314.
41. Hvas A.M., et al. // J. Affect. Disord. – 2004. – Vol.81. – P.269–273.
42. Institute of Medicine. Food and Nutrition Board. Dietary Reference Intakes: Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12, Pantothenic Acid, Biotin, and Choline. – Washington, 1998.
43. Johnson M.A. // Nutr. Rev. – 2007. – Vol.65. – P.451–458.
44. Kaiser L., Allen L.H. // J. Am. Diet. Assoc. – 2008. – Vol.108. – P.553–561.
45. Kang J.H., et al. // Am. J. Clin. Nutr. – 2008. – Vol.88. – P.1602–1610.
46. Kasper H. // Int. J. Vitam. Nutr. Res. – 1999. – Vol.69. – P.169–172.
47. Klee G.G. // Clin. Chem. – 2000. – Vol.46. – P.1277–1283.
48. Kuzminski A.M., et al. // Blood. – 1998. – Vol.92, N4. – P.1191–1198.
49. Kvestad I., et al. // Am. J. Clin. Nutr. – 2017. – Mode of access: doi:10.3945/ajcn.116.144931
50. Lee B.J., et al. // Eur. J. Clin. Nutr. – 2004. – Vol.58. – P.481–487.
51. Lichtenstein A.H., et al. // Circulation. – 2006. – Vol.114. – P.82–96.
52. Liu K.W., Dai L.K., Jean W. // Age Ageing. – 2006. – Vol.35, – P.200–201.
53. Lonn E., et al. // N. Engl. J. Med. – 2006. – Vol.354. – P.1567–1577.
54. Louwman M.W., et al. // Am. J. Clin. Nutr. – 2000. – Vol.72, N3. – P.762–769.
55. Lukaski H.C. // Nutrition. – 2004. – Vol.20. – P.632–644.
56. Malinow M.R. // Clin. Chem. – 1995. – Vol.41. – P.173–176.
57. Malouf R., Areosa Sastre A. // Cochrane Database Syst. Rev. – 2003. – N3. – CD004326
58. Malouf R., Grimley Evans J. // Cochrane Database Syst. Rev. – 2008. –Vol.8, N4. – CD004514
59. McKay D.L., et al. // J. Nutr. – 2000. – Vol.130. – P.3090–3096.
60. Moore E., et al. // Int. Psychogeriatr. – 2012. – Vol.24, N4. – P.541–556.
61. Moretti R., et al. // Neurol. India. – 2004. – Vol.52. – P.310–318.
62. National Institutes of Health. Third report of the National Cholesterol Education Program Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). – Bethesda, MD. – National Cholesterol Education Program, National Heart, Lung, and Blood Institute, National Institutes of Health. – 2002. – NIH Publication. – N2. – Р.5215.
63. Nyholm E., et al. // Postgrad. Med. J. – 2003. – Vol.79. – N930. – P.218–220.
64. Office of Dietary Supplements. National Institutes of Health. Dietary Supplement Fact Sheet: Vitamin B12 – Date of access: 5.26.2010. – Mode of access: http://ods.od.nih.gov/factsheets/vitaminb12
65. Refsum H., et al. // J. Nutr. – 2006. – Vol.136 (Suppl.6). – 31S–40S.
66. Ruscin J.M., Page R.L., Valuck R.J. // Ann. Pharmacother. – 2002. – Vol.36. – P.812–816.
67. Schulz R.J. // Curr. Opin. Clin. Nutr. Metab. Care. – 2007. – Vol.10. – P.718–723.
68. Seshadri S., et al. // N. Engl. J. Med. – 2002. – Vol.346. – P.476–483.
69. Smith A.D., et al. // PLoS One. – 2010. – Vol.5, N9. – P.122–144.
70. Subar A.F., et al. // J. Am. Diet. Assoc. – 1998. – Vol.98. – P.537–547.
71. Sumner A.E., et al. // Ann. Intern. Med. – 1996. – Vol.12. – P.469–476.
72. Suzuki D.M., et al. // Hawaii Med. J. – 2006. – Vol.65. – P.311–314.
73. Termanini B., et al. // Am. J. Med. – 1998. – Vol.104. – P.422–430.
74. Toole J.F., et al. // JAMA. – 2004. – Vol.291. – P.565–575.
75. Tucker K.L., et al. // Am. J. Clin. Nutr. – 2000. – Vol.71. – P.514–522.
76. U.S. Department of Agriculture, Agricultural Research Service. 2011. USDA National Nutrient Database for Standard Reference. – Release 24. – Nutrient Data Laboratory. – Home Page – http://www.ars.usda.gov/ba/bhnrc/ndl
77. Valuck R.J., Ruscin J.M. // J. Clin. Epidemiol. – 2004. – Vol.57. – P.422–428.
78. van Walraven C., Austin P., Naylor C.D. // Can. Fam. Physician. – 2001. – Vol.47. – P.79–86.
79. Vidal-Alaball J., et al. // Cochrane Database Syst. Rev. – 2005. – Vol.20, N3. – CD004655
80. Vogiatzoglou A., et al. // Psychosom Med. – 2013. – Vol.75, N1. – P.20–29.
81. von Schenck U., Bender-Gotze C., Koletzko B. // Arch. Dis. Childhood. – 1997. – Vol.77. – P.137–139.
82. Zittoun J., Zittoun R. // Sem. Hematol. – 1999. – Vol.36. – P.35–46.
Медицинские новости. – 2019. – №8. – С. 13-18.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.