Внимание! Статья адресована врачам-специалистам
Adzerikho I.E.
Belarusian Medical Academy of Post-Graduate Education, Minsk
Current views on the treatment of pulmonary arterial hypertension
Резюме. Быстрый рост знаний в области молекулярно-клеточных механизмов развития легочной артериальной гипертензии (ЛАГ) способствовал тому, что за последние годы существенно изменились представления о патогенезе данного заболевания. В результате были синтезированы и внедрены в клиническую практику 5 групп препаратов, действующие на три основные патогенетические мишени, вовлеченные в развитие и прогрессирование ЛАГ, – это активация системы эндотелина 1, дефицит эндогенных простациклина и оксида азота. Использование патогенетической терапии в лечении ЛАГ способствовало значительному улучшению выживаемости пациентов и изменило в целом наше представление о неизлечимости данного заболевания. Однако до настоящего времени отсутствует ясность по определению показаний к стартовой терапии и изменения ее в процессе динамического наблюдения за пациентами. В 2018 году разработан новый алгоритм лечения ЛАГ, в основе которого лежит использование специфических препаратов уже на ранних стадиях заболевания и необходимость значительного ее усиления в виде комбинированной терапии на старте и в процессе динамического наблюдения, при отсутствии возможности достичь уровня низкого риска, как минимум, по четырем прогнозным факторам. При этом установлено, что наиболее благоприятный прогноз лечения наблюдается, если тяжесть состояния пациента не выше I–II функцио-нального класса по классификации Всемирной организации здравоохранения – модифицированному варианту классификации Нью-Йоркской ассоциации сердца (NYHA), результат теста 6-минутной ходьбы больше 440 м, давление в правом предсердии меньше 8 мм рт. ст. и сердечный индекс больше 2,5 л/мин/м2.
Ключевые слова: легочная артериальная гипертензия, патогенетическая терапия, алгоритм лечения.
Медицинские новости. – 2019. – №12. – С. 10–14.
Summary. The rapid growth of knowledge in the field of molecular-cellular mechanisms for the development of pulmonary arterial hypertension (PAH) has contributed to the fact that in recent years the perception of the pathogenesis of the disease has changed significantly. As a result, five groups of drugs, acting on the three main pathogenetic targets involved in the development and progression of PAH, were synthesized and introduced into clinical practice: activation of the endothelin-1 system, endogenous deficiency prostacyclin and nitric oxide. The use of pathogenetic therapy in the treatment of PAH has significantly improved patient survival and has changed, in general, our perception of the incurability of the disease. However, until now there is no clarity on the definition of indications to start therapy and changes it in the process of dynamic monitoring of patients. In 2018, a new algorithm for the treatment of PAH, based on the use of specific drugs in the early stages of the disease and the need to significantly strengthen it in the form of combination therapy at the start and in the process of dynamic if it is not possible to reach a low-risk level for at least four predictive factors. It is established that the most favorable prognosis of treatment is observed if the severity of the patient’s condition is not higher than functional class I or II under the modified classification version of the World Health Organization / New York Heart Association (NYHA), 6-min walk distance more than 440 m, right atrial pressure less than 8 mm Hg and cardiac index more than 2.5 L/min/m2.
Keywords: pulmonary arterial hypertension, pathogenetic therapy, treatment algorithm.
Meditsinskie novosti. – 2019. – N12. – P. 10–14.
Прошло более 25 лет после проведения первого клинического исследования по изучению действия специфической, «патогенетической» терапии при идиопатической легочной артериальной гипертензии (ЛАГ), в котором была установлена ее высокая эффективность [1]. За этот период времени были опубликованы результаты 41 рандомизированного клинического исследования (РКИ), главным итогом которых стало внедрение в клинической практике 5 групп препаратов, действующих на три основных звена патогенеза ЛАГ [2, 3]. Дальнейшее использование патогенетической терапии способствовало значительному улучшению выживаемости пациентов ЛАГ, соответственно, и качеству их жизни. В итоге за последние годы изменились в противоположную сторону наши представления о ЛАГ как о неизлечимом заболевании с краткосрочной перспективой жизни.
Вместе с тем, несмотря на достигнутый за последнее время крупный успех в развитии медикаментозной терапии ЛАГ, можно сказать, что повода для оптимизма нет. По-прежнему ЛАГ является одним из самых жизнеугрожающих состояний [4, 5]. Во многом это связано с несвоевременным началом патогенетической терапии и отсутствием ее эффективности на поздних стадиях развития заболевания [6]. Вместе с тем, если на ранних этапах лечения заболевания можно замедлить темпы его прогрессирования, то при последующем развитии ЛАГ возможности медикаментозной терапии значительно ограничены. Кроме того, лекарственная терапия часто сопровождается выраженными побочными эффектами.
Быстропрогрессирующий характер заболевания требует активного внедрения «агрессивных» подходов в ее терапии, одним из которых является раннее использование комбинированной терапии, основанной на одновременном применении двух и более ЛАГ-специфических препаратов. Очевидно, что при таком подходе действующие препараты усиливают и дополняют свойства друг друга, что в конечном итоге положительно сказывается на результате лечения. В этой связи одним из важнейших вопросов в лечении ЛАГ является осуществление своевременного перехода от монотерапии к комбинированной. Данный подход лежит в основе новой тактики лечения ЛАГ, которая была принята на VI Всемирном симпозиуме по легочной гипертензии (ЛГ) [7].
Патогенетическая терапия в лечении ЛАГ и пути ее развития
ЛАГ представляет собой гетерогенную группу заболеваний, которые характеризуются прогрессирующим повышением легочного сосудистого сопротивления (ЛСС) и давления в легочной артерии (ДЛА) с быстрым развитием правожелудочковой сердечной недостаточности, ведущей к преждевременной гибели пациентов. В качестве основного диагностического критерия ЛАГ считается повышение среднего ДЛА до 25 мм рт. ст. и выше [2, 3].
Согласно классификации ЛГ, в группу ЛАГ включены следующие ее формы: идиопатическая, наследуемая, индуцированная приемом лекарств и токсинов, ассоциированная с болезнями соединительной ткани, ВИЧ-инфекцией, портальной гипертензией и врожденными пороками сердца. Кроме того, к ЛАГ относятся легочная венооклюзионная болезнь / легочный капиллярный гемангиоматоз и стойкая легочная гипертензия новорожденных [8].
Последние десятилетия были отмечены крупными достижениями в области изучения молекулярно-клеточных механизмов развития ЛАГ. При этом было установлено, что ключевую роль в этом процессе играет дисфункция эндотелия. Она проявляется, прежде всего, наличием дисбаланса между эндогенными вазодилататорами и вазоконстрикторами, в пользу последних. Большое внимание уделяется недостаточной выработке оксида азота (NO) и простациклина на фоне значительного увеличения количества эндотелина 1 (ЭТ-1) [9].
Новые знания о патогенезе развития ЛАГ привели к тому, что вместо традиционного использования симптоматической терапии, направленной на устранение правожелудочковой недостаточности, был сформирован совершенно новый, патогенетический подход в лечении этого грозного состояния. В его основе лежит медикаментозная терапия, целью которой является достичь в легочных сосудах: 1) преодоления вазоконстрикции за счет недостаточной выработки NO и простациклина на фоне значительного увеличения количества ЭТ-1; 2) существенного уменьшения степени их патологического ремоделирования; 3) полного устранения на поверхности сосудистого эндотелия воспалительного процесса и риска развития тромбоза.
Основу патогенетической терапии ЛАГ составляют группы препаратов, механизм действия которых направлен на устранение дисфункции эндотелия путем, с одной стороны, усиления выработки вазодилататоров простациклина и NO, с другой – уменьшения секреции вазоконстриктора ЭТ-1. К ним относятся: 1) простагландины (простаноиды), 2) антагонисты эндотелиновых рецепторов (АЭР), 3) ингибиторы фосфодиэстеразы 5 (ИФДЭ-5), 4) стимуляторы растворимой гуанилатциклазы и 5) селективные агонисты рецепторов простациклина IP [2, 3].
Эффективность этих групп препаратов подтверждена в целом ряде контролируемых рандомизированных клинических исследований (РКИ) [10–19], что подчеркивает их наибольшую практическую значимость в лечении ЛАГ. В отношении использования антагонистов кальция (АК) при ЛАГ полного единодушия в мире нет. По мнению европейских экспертов, они относятся к препаратам специфической лекарственной терапии [2, 3], противоположная точка зрения существует на американском континенте [20]. Другие группы лекарственных средств и методы лечения, являющиеся составными частями поддерживающей терапии, должны использоваться по клиническим показаниям. К ним относятся диуретики, оксигенотерапия, антикоагулянты [2, 3].
Основа современного алгоритма лечения была заложена на III Всемирном симпозиуме по ЛГ, состоявшемся в 2003 году (Венеция, Италия), согласно которому больным с отрицательной острой фармакологической пробой (ОФП) рекомендовалось назначение препаратов из трех классов: простаноиды, АЭР, ИФДЭ-5 [21]. В последующие годы алгоритм был усовершенствован в соответствии с новыми данными доказательной медицины. Наконец, в 2015 году двумя европейскими обществами по кардиологии и пульмонологии (ESC/ERS) принят последний вариант рекомендаций по диагностике и лечению ЛАГ, в которых было предложено проводить стратификацию риска развития смерти у каждого впервые выявленного пациента ЛАГ, что позволяет определить выбор между моно- или комбинированной терапией [2, 3]. Разделение пациентов в зависимости от степени риска на низкий, промежуточный и высокий необходимо выполнять сразу же после исходного клинико-инструментального обследования. Для комплексной оценки статуса больного важно рассматривать клинические данные, нагрузочные тесты, биохимические маркеры, эхокардиографические и гемодинамические показатели.
Существенным дополнением данной стратегии явился принятый в 2018 году новый алгоритм лечения ЛАГ, который предусматривает проведение стратификации риска не только исходно, но и в процессе лечения [7]. Это стало необходимо с целью расширения показаний для проведения комбинированной терапии, так как ее раннее использование позволяет довольно быстро достичь целевых показателей низкого риска. К ним относятся: 1) ФК I–II (ВОЗ/NYHA), 2) тест 6-минутной ходьбы (Т6МХ) больше 440 м, 3) давление в правом предсердии (ДПП) меньше 8 мм рт. ст., 4) сердечный индекс (СИ) больше 2,5 л/мин/м2. В качестве дополнительных критериев низкого риска также могут использоваться уровень BNP/NT-proBNP, которые должны быть в норме, а также сатурация смешанной венозной крови больше 65%.
В случае наличия у пациентов исходно параметров высокого риска рекомендовано сразу назначать комбинированную терапию. С учетом установленной зависимости прогноза выживаемости пациентов от количества показателей низкого риска, данная тактика лечения ЛАГ в настоящее время является определяющей, что и отражает новый алгоритм, который схематически выглядит следующим образом (рисунок).
Современный алгоритм лечения пациентов ЛАГ
После подтверждения диагноза ЛАГ пациенты, которые не получали лечения, должны быть направлены в экспертный центр для проведения общих мероприятий и поддерживающей терапии (ESC/ERS PH guidelines, см. табл. 16, 17) [2, 3].
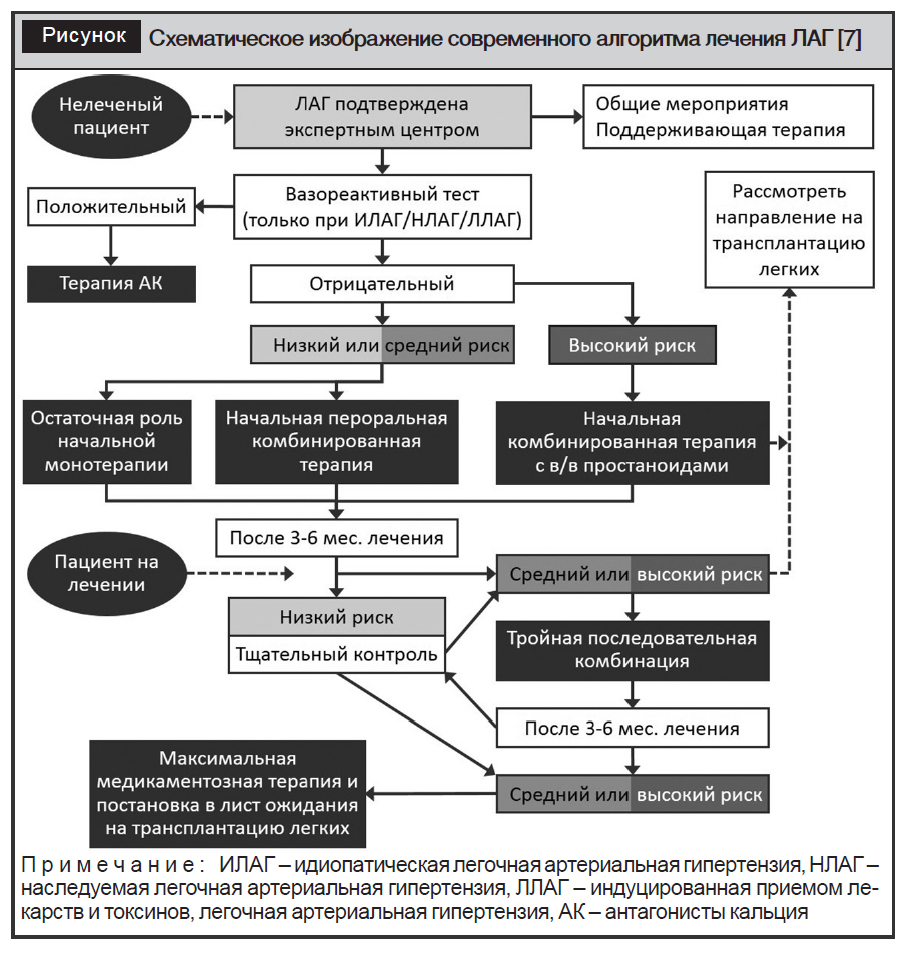
Утвержденный рекомендациями ESC/ERS (2015) перечень общих мероприятий не претерпел существенных изменений при разработке новых подходов к лечению ЛАГ. Однако остается спорным вопрос по назначению оральных антикоагулянтов. Их не рекомендовано использовать при ЛАГ, ассоциированной с различными заболеваниями, но в то же время отсутствует ясность по их назначению при таких формах ЛАГ, как идиопатическая, наследственная, а также индуцированная лекарствами / токсинами (ИЛАГ/НЛАГ/ЛЛАГ). Решение по назначению антикоагулянтов при этих формах ЛАГ в каждом конкретном случае должно быть принято индивидуально, в зависимости от степени риска. Остается также актуальным вопрос по физической нагрузке. Сегодня рекомендуется ее проводить у пациентов в пределах той активности, которая возможна, исходя из выраженности клинической симптоматики. При этом следует избегать возникновения жизненно опасных симптомов. В любом случае проведение реабилитации по специальным программам физической активности оказывает положительный эффект на прогноз заболевания [22].
Для оценки возможности применения АК у пациентов ИЛАГ/НЛАГ, а также ЛАГ, индуцированной приемом аноректиков, проводится ОФП, другими словами, тест оценки вазореактивности легочных сосудов с эпопростенолом, аденозином или NO [8]. Среди перечисленных препаратов наиболее эффективным и безопасным считается NO, который преимущественно используется при проведении ОФП [23]. Тест считается положительным, если при введении одного из препаратов во время проведения катетеризации сердца наблюдается снижение среднего давления в ЛА от 10 мм рт. ст. до 40 мм рт. ст.
Пациентам с положительным результатом ОФП назначают АК в максимально высокой дозе, которую определяют путем медленного ее титрования.
АК вызывают избирательную вазодилатацию легочных артерий [24]. Поэтому при их использовании отсутствует столь значительное снижение системного артериального давления, как это наблюдается при действии других групп вазодилататоров. В результате АК существенно снижают ДЛА, а также уменьшают периферическое ЛСС. Несмотря на столь позитивные гемодинамические изменения, АК не вызывают существенного изменения прогноза жизни пациентов ЛАГ. Например, увеличение продолжительности жизни пациентов с ИЛАГ на фоне терапии АК было отмечено только в 5–10% случаев [25].
В настоящее время считается, что терапия АК показана клинически стабильным пациентам ИЛАГ II и III ФК, при наличии положительного результата теста на вазореактивность и устойчивой гемодинамики. При CИ менее 2,1 л/мин/м2 и/или сатурацией венозной крови менее 63%, и/или ДПП более 10 мм рт. ст., АК абсолютно противопоказаны и наоборот.
Из всей группы АК наиболее часто в клинической практике применяются дилтиазем, нифедипин в пролонгированной форме и амлодипин. Сравнительные исследования по эффективности применения этих препаратов отсутствуют. Однако предпочтения клиницистов в выборе тех или иных АК все же существуют. Выбор АК основан на исходной частоте сердечных сокращений с предпочтением нифедипина и амлодипина при относительной брадикардии и дилтиазема при склонности к тахикардии. Верапамил не рекомендуется применять из-за отрицательного инотропного эффекта. В случае выраженной ЛГ показаны нифедипин и амлодипин. В случае развития недостаточности кровообращения препаратом выбора для больных идиопатической ЛАГ считают амлодипин, прием которого не сопровождается увеличением смертности пациентов. Суточные дозы препаратов, доказавшие эффективность, достаточно высокие: амлодипин – 15–20 мг, нифедипин – 120–240 мг, дилтиазем – 240–720 мг.
Пациентам с отрицательным результатом ОФП, которые имеют низкий или умеренный (промежуточный) риск, необходимо назначить стартовую комбинированную терапию с АЭР и ИФДЭ-5 (ESC/ERS PH guidelines,см. табл. 20) [2, 3, 26]. Однако пациентам, у которых эффективность / безопасность стартовой комбинированной терапии не установлена, рекомендовано проводить стартовую монотерапию АЭР или ИФДЭ-5 [2, 3].
При выборе в пользу стартовой монотерапии необходимо учитывать отсутствие прямых сравнительных исследований по оценке различных ЛАГ-специфических препаратов. Поэтому до настоящего времени невозможно точно определить препараты первой линии. Выбор конкретного лекарственного средства зависит от ряда факторов, включая потенциальную возможность его использования с учетом наличия у него госрегистрации, параметров фармакокинетики, способа введения, наличия, а также выраженности побочных эффектов, клинически значимых лекарственных взаимодействий, предпочтения самого больного, сопутствующей патологии, опыта врача и полной стоимости лечения.
В нашей стране для лечения ЛАГ доступны две группы патогенетических препаратов – это АЭР и ИФДЭ-5. Краткая характеристика механизма действия и клиническое применение отдельных препаратов специфической терапии здесь приводится.
С учетом современных знаний об участии ЭТ-1 в развитии вазоконстрикции и митогенных процессов, АЭР широко используются в лечении ЛАГ [27]. К настоящему времени группа антагонистов ЭТ-1 состоит из трех препаратов: бозентана, маситентана и амбризентана. В зависимости от селективности действия в отношении рецепторов ЭТ-1 АЭР классифицируются на неселективные, воздействующие на рецепторы типа А и B, – бозентан, мацитентан и высокоселективные в отношении рецепторов типа А – амбризентан.
Из группы АЭР в Республике Беларусь доступным пока является бозентан, который в настоящее время используется при ИЛАГ, ЛАГ, ассоциированной с врожденными заболеваниями сердца, соединительной ткани, а также ВИЧ-инфекцией. В начале терапии доза препарата составляет 125 мг в день (62,5 мг 2 раза в день). При хорошей переносимости дозу удваивают, однако при этом необходимо отслеживать уровень печеночных ферментов, так как имеются литературные данные о дозовой зависимости развития гепатотоксичности [28].
Наряду с АЭР, ИФДЭ-5 рассматриваются в качестве важнейшего подхода к проведению патогенетической терапии. Являясь селективными ингибиторами циклической гуанозинмонофосфат (цГМФ)-зависимой ФДЭ-5, они способствуют повышению внутриклеточного содержания цГМФ, соответственно и эндогенного NO, вследствие того, что выступает его вторым мессенджером. Таким образом, цГМФ вызывает вазодилатацию легочных сосудов (там больше всего содержится ФДЭ-5) и подавляет их пролиферацию [29].
В настоящее время для лечения ЛАГ одобрены три ИФДЭ-5 – силденафил, варденафил и тадалафил. Наибольшую известность имеет препарат силденафил [16]. Выраженный вазодилатирующий эффект легочных артерий силденафила был установлен при различных формах ЛАГ. В этой связи препарат имеет показания для клинического применения при ИЛАГ, а также при ЛАГ, ассоциированной с заболеваниями соединительной ткани. Кроме того, силденафил можно использовать при других формах ЛГ: хронической тромбоэмболической, а также вследствие патологии левых отделов сердца и легких. Клинически значимый эффект обычно достигается при дозе 20 мг 3 раза в день. При отсутствии улучшения состояния пациента дозу препарата обычно увеличивают. Однако в последнее время отмечается тенденция в сторону значимого повышения дозы препарата, вплоть до 80 мг 3 раза в день. Побочные эффекты не имеют дозовую зависимость и встречаются редко. Наиболее часто описываются головная боль и боль в спине, покраснение, диспепсия, а также изменения зрения.
Пациентам с отрицательным результатом ОФП, которые имеют высокий риск, стартовая комбинированная терапия включает внутривенное введение простаноидов (ESC/ERS PH guidelines, см. табл. 20). Среди аналогов простациклина рекомендуется отдавать предпочтение внутривенному эпопростенолу, так как он снижает 3-месячную летальность у пациентов высокого риска при монотерапии [30]. Могут рассматриваться альтернативные варианты стартовой комбинированной терапии (ESC/ERS PH guidelines, см. табл. 20). Кроме того, при необходимости, рекомендуется рассмотреть вопрос о направлении пациента на трансплантацию легких.
У пациентов на фоне стартовой терапии через 3–6 месяцев проводится стратификация риска.
Если на фоне стартовой терапии у пациентов определяется низкий риск, то рекомендуется продолжить данное лечение и установить за ними динамическое наблюдение (ESC/ERS PH guidelines, см. табл. 14).
Если на фоне стартовой терапии у пациентов определяется умеренный (промежуточный) риск, то рекомендуется перейти на двойную или тройную комбинированную терапию (ESC/ERS PH guidelines, см. табл. 21). Наиболее высокий уровень рекомендаций получили комбинации мацитентана и силденафила [15], риоцигуата и бозентана [18], селексипага и АЭР и/или ИФДЭ-5 [19]. Комбинация риоцигуата и ИФДЭ-5 противопоказана [31]. При необходимости рекомендуется рассмотреть вопрос о направлении на трансплантацию легких.
Если на фоне стартовой терапии у пациентов имеется высокий риск, то рекомендуется использовать последовательную тройную терапию, с обязательным внутривенным введением эпопростенола (ESC/ERS PH guidelines, см. табл. 20). При необходимости рекомендуется рассмотреть вопрос о направлении на трансплантацию легких.
Если на фоне проводимой терапии повторно через 3–6 месяцев у пациентов сохраняется низкий риск, то рекомендуется продолжить данное лечение и установить за ними динамическое наблюдение (ESC/ERS PH guidelines, см. табл. 14). Также необходимо рассмотреть вопрос о постановке в лист ожидания на трансплантацию легких, так как время нахождения в списке может быть длительным, что зависит не только от медицинских показаний, но и от национальных особенностей закона по трансплантации в месте проживания пациента.
Если на фоне проводимой терапии, повторно через 3–6 месяцев у пациентов сохраняется умеренный (промежуточный) или высокий риск, то рекомендуется тройная комбинированная терапия, включая подкожное (п/к) или внутривенное (в/в) введение простаноидов (у пациентов высокого риска предпочтительней использовать в/в способ введения препарата). У больных с умеренным риском рекомендовано использовать двойную терапию, включающую АЭР и ИФДЭ-5 или риоцигуата с добавлением селексипага [19]. Для пациентов, которые принимают тройную терапию и остаются с умеренным риском или переходят в высокий риск, должна быть замена одного из препаратов комбинации на п/к или в/в способ введения простаноидов. Рекомендуется также рассмотреть вопрос о направлении на трансплантацию легких.
Если на фоне проводимой терапии у пациентов с низким риском, через 3–6 месяцев состояние ухудшается до умеренного (промежуточного) или высокого, то рекомендуется использовать двойную, тройную или максимально допустимую комбинированную терапию, что определяется стартовым лечением.
Всем пациентам, в особенности с умеренным (промежуточным) или высоким риском, которые находятся на максимально допустимой терапии рекомендуется рассмотреть вопрос о трансплантации легких, так как время ожидания операции может быть длительным, что зависит, в том числе и от национального законодательства по трансплантации в месте проживания пациента (ESC/ERS PH guidelines, см. табл. 22) [32].
Баллонная атриальная септостомия рассматривается как паллиативная процедура перед трансплантацией легких для больных с ухудшением, несмотря на максимальную медикаментозную терапию.
Тактика использования ЛАГ-специфических препаратов
В Европейских рекомендациях по лечению ЛАГ отсутствует информация по сравнительной эффективности различных ЛАГ-специфических препаратов, что затрудняет сделать правильный выбор между ними, не говоря уже о равнозначной замене одного лекарственного средства другим. В то же время проведение медикаментозной терапии заболевания сопряжено с риском развития побочных эффектов и не всегда является эффективным в достижении конечных ее целей. Как известно, одним из способов преодоления указанных недостатков выступает замена одного препарата другим, равнозначным по эффективности, но имеющим более безопасный профиль действия, а с целью усиления действенности терапии – использование комбинированной терапии.
Существует незначительное количество РКИ, в которых изучалась возможность смены одних ЛАГ-специфических препаратов на другие. Так, установлено, что замена внутривенного введения эпопростенола на внутривенное введение трепростинила может быть осуществлена у 80% больных ЛАГ [33], а при появлении противопоказаний к приему бозентана из-за повышения уровня печеночных ферментов, его с высокой степенью безопасности можно заменить на амбризентан или мацитентан [34].
В то же время отсутствует ясность по возможности смены путей введения таких препаратов, как простациклин: с парантерального на ингаляционный или оральный прием [33], а также селексипаг или непарантеральные простаноиды: с орального на п/к или в/в их прием. Неубедительные данные также имеются по замене силденафила или тадалафила на риоцигуат [34].
Таким образом, внедрение в клиническую практику нового алгоритма лечения больных ЛАГ, в основе которого лежит раннее использование патогенетических групп препаратов в виде моно- или комбинированной терапии позволит своевременно оказывать существенное воздействие на основные пути развития заболевания. На всех этапах динамического наблюдения за пациентами ЛАГ необходимо регулярно определять панель параметров риска с целью выявления показаний для усиления медикаментозной терапии. Определяющим фактором для перехода от моно- к комбинированной терапии, включающей два и более патогенетических препарата, является необходимость на фоне медикаментозного лечения иметь показатели низкого риска, как минимум, по 4 прогнозным факторам: 1) тяжесть состояния пациента не выше I–II ФК (ВОЗ/NYHA); 2) результат Т6МХ больше 440 м; 3) давление в правом предсердии меньше 8 мм рт. ст.; 4) сердечный индекс больше 2,5 л/мин/м2.
Л И Т Е Р А Т У Р А
1. Rubin L.J., Mendoza J., Hood M., et al. // Ann. Intern. Med. – 1990. – Vol.112. – P.485–491.
2. Galie N., Humbert M., Vachiery J.L., et al. // Eur. Heart J. – 2016. – Vol.37. – P.67–119.
3. Galie N., Humbert M., Vachiery J.L., et al. // Eur. Respir. J. – 2015. – Vol.46. – P.903–975.
4. McGoon M.D., Benza R.L., Escribano-Subias P., et al. // J. Am. Coll. Cardiol. – 2013. – Vol.62. – D51–D59.
5. Hooper M.M., Kramer T., Pan Z., et al. // Eur. Respir. J. – 2017. – Vol.50. – P.1700740.
6. Benza R.L., Miller D.P., Gomberg-Maitland M., et al. // Circulation. – 2010. – Vol.122. – P.164–172.
7. Galie N., Channick R.N., Frantz R.P., et al. // Eur. Respir. J. – 2019. – Vol.53. – P.1801889.
8. Simonneau G., Montani D., Celermajer D.S., et al. // Eur. Respir. J. – 2019. – Vol.53. – P.1801913.
9. Humbert M., Guignabert C., Bonnet S., et al. // Eur. Respir. J. – 2019. – Vol.53. – P.1801887.
10. Sitbon O., Delcroix M., Bergot E., et al. // Am. Heart J. – 2014. – Vol.167. – P.210–217.
11. Galie N., Humbert M., Vachiery J.L., et al. // J. Am. Coll. Cardiol. – 2002. – Vol.39. – P.1496–1502.
12. Simmonneau G., Barst RJ., Galie N., et al. // J. Rеspir. Crit. Care Med. – 2002. – Vol.165. – P.800–804.
13. Channick R.N., Simonneau G., Sitbon O., et al. // Lancet. – 2001. – Vol.358. – P.1119–1123.
14. Galie N., Olschewski H., Oudiz R.J., et al. // Circulation. –2008. – Vol.117. – P.3010–3019.
15. Pulido T., Adzerikho I., Channick R.N., et al. // N. Engl. J. Med. –2013. – Vol.369. – P.809–818.
16. Galie N., Ghofrani H.A., Torbiski A., et al. // N. Engl. J. Med. – 2005. – Vol.353, N20. – P.2148–2157.
17. Jing Z.C., Yu Z.X., Shen J.Y., et al. // Am. J. Respir. Crit Care Med. –2011. – Vol.183. – P.1723–1729.
18. Ghofrani H.A., Galie N, Grimminger F., et al. // N. Engl. J. Med. –2013. – Vol.369. – P.330–340.
19. Sitbon O., Channick R., Kelly C., et al. // New Engl. J. Med. –2015. – Vol.373. – P.2522–2533.
20. McLaughlin V.V., Archer S.L., Badesch D.B., et al. // J. Am. Coll. Cardiol. – 2009. – Vol.53. – P.1573–619.
21. Galie N., Seeger W., Naeije R., et al. // J. Am. Coll. Cardiol. – 2004. – Vol.43. – S81–S88.
22. Keusch S., Turk A., Saxer S., et al. // Swiss Med. Wkly. – 2017. – Vol.147. – w14462.
23. Sitbon O., Humbert M., Jogot T.L., et al. // Eur. Respir. J. – 1998. – Vol.12. – P.265–270.
24. Rich S., Kaufmann E., Levy P.S. // N. Engl. J. Med. – 1992. – Vol.327. – P.76–81.
25. Sitbon O., Humbert M., Jais X., et al. // Circulation. – 2005. – Vol.111. – P.3105–3111.
26. Sitbon O., Satttler C., Bertoletti L., et al. // Eur. Respir. J. – 2016. – Vol.47. – P.1727–1736.
27. Galie N., Manes A., Branzi A. // Cardiovasc. Res. – 2004. – Vol.61. – P.227–237.
28. Rubin L.J., Badesch D.B., Barst R.J., et al. // N. Engl. J. Med. –2002. – Vol.346. – P.896–903.
29. Soderling S.H., Bayuga S.J., Beavo J.A. // J. Biol. Chem. – 1998. – Vol.273, N25. – P.15553–15558.
30. Galie N., Corris P., Frost A., et al. // J. Am. Coll. Cardiol. – 2013. – Vol.62. – D60–D72.
31. Galie N., Muller K., Scalise A.V., et al. // Eur. Respir. J. – 2015. – Vol.45. – P.1314–1322.
32. Hoeper M.M., Benza R.L., Corris P., et al. // Eur. Respir. J. – 2019. – Vol.53. – P.1801906.
33. Sofer A., Ryan M.J., Tedford R.J., et al. // Pulm. Circ. – 2017. – Vol.7. – P.326–338.
34. McGoon M., Frost A., Oudz R., et al. // Chest. – 2009. – Vol.135. – P.122–129.
35. Hoeper M.M., Simonneau G., Corris P., et al. // Eur. Respir. J. – 2017. – Vol.50. – P.1602425.
Медицинские новости. – 2019. – №12. – С. 10-14.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.