Внимание! Статья адресована врачам-специалистам
Abasszade Z.1, Gasimov K.2, Eyvazova Sh.1, Eyyubova G.1,
Israfilova S.1, Gurbanova Sh.1, Gadzhievа Y.1, Shakhmuradov I.3
1Azerbaijan Medical University, Baku
2Institute of Biophysics National Academy of Sciences, Azerbaijan
3Institute of Molecular Biology and Biotechnology National Academy of Sciences, Azerbaijan
Comparative study of genetic variations in patients with hypertension at the gene level
Резюме. Проведено исследование генетических вариаций у больных гипертонией среди азербайджанской популяции на генном уровне, доказывающее взаимосвязь генотипов и риск развития гипертонии. В публикации показана распространенность генов-кандидатов, ассоциированных с риском возникновения артериальной гипертонии (АГ) и сердечно-сосудистых заболеваний (ССЗ), на основании чего были определены специфические генетические особенности азербайджанского этноса. Выявлена связь между гипертонией и определенными молекулярными вариантами генов AGT (ангиотензиноген), АСЕ (ген, кодирующий ангиотензинпревращающий фермент), MTHFR (ген, кодирующий белок метилентетрагидрофолатредуктазу). Для снижения эффекта воздействия риск-факторов на развитие АГ и ССЗ были разработаны рекомендации, среди которых основной является внедрение в диспансеризацию населения генетического анализа полиморфных генов-кандидатов.
Ключевые слова: гипертоническая болезнь, артериальная гипертония, генетические вариации, ген-кандидат, AGT, АСЕ, MTHFR.
Медицинские новости. – 2020. – №1. – С. 65–69.
Summary. The study of genetic variations in patients with hypertension among the Azerbaijani population at the genetic level, proving the relationship of genotypes and the risk of hypertension. The publication shows the prevalence of candidate genes associated with the risk of hypertension and CVD, on the basis of which the specific genetic characteristics of the Azerbaijani ethnic group were determined. The relationship between hypertension and certain molecular variants of the genes AGT, ACE, MTHFR was revealed. To reduce the effect of risk factors on the development of AH and CVD, recommendations were developed, among which the main one is the introduction of a genetic analysis of polymorphic candidate genes into the clinical examination.
Keywords: hypertension, arterial hypertension, genetic variations, candidate gene, AGT, ACE, MTHFR.
Meditsinskie novosti. – 2020. – N1. – P. 65–69.
Артериальная гипертония (АГ) и ее крайнее выражение – гипертоническая болезнь (ГБ) – наиболее распространенные формы сосудистой патологии. Так, распространенность гипертонии среди мирового населения по разным оценкам авторов составляет от 15% и выше [5]. При добавлении в статистику случаев заболеваний с пограничной АГ доля населения с наличием рассматриваемой проблемы достигает 25% [1].
При этом в последние годы многими исследователями в разрезе изучения генома человека было отмечено, что полиморфизм генов человека оказывает существенное влияние на потенциальные возможности развития нарушений сердечной деятельности и функционирования сосудистой системы. Показано, что перспективными маркерами ранней диагностики нарушений важнейшей системы органов человека являются полиморфные проявления генов ренин-ангиотензин-альдостероновой системы (РАС). Для четкого понимания комплексной природы фенотипа артериальной гипертонии требуются крупномасштабные исследования, в том числе для того, чтобы окончательно установить роль определенных хромосомных областей или генов в данном процессе.
Цель исследования – анализ результатов сравнительного исследования генетических вариаций у больных гипертонией на генном уровне.
Анализ публикаций
В исследовании связи между тремя полиморфизмами РАС и эссенциальной гипертонии в популяции пациентов Буркина-Фасо было показано, что полиморфизмы генов AGT (M235T) и AT1R (А1166С) не были связаны с АГ, в то время как частота генотипов i/D полиморфизма ACE между обследуемыми пациентами и группой контроля была достоверно различна (р<10-4). Также отмечено, что генотип DD гена ACE участвует в восприимчивости к АГ [4].
В России исследования связи генотипов с АГ показали сопряженность между положением метионина в 174-м положении гена ангиотензиногена и развитием первичной АГ (ПАГ) [3]. Наряду с перечисленными исследованиями с полученными положительными коррелятивными связями генов-кандидатов и АГ имеются данные, в которых авторы не нашли доказательств связи между полиморфизмом AGT M235T и частотой АГ в исследуемой популяции [9]. Частота генотипа полиморфизма А1166С гена AGT2R1 достоверно различалась у пациентов с АГ по сравнению с нормотензивными лицами. В частности, генотип AGTR1 АА встречался в два раза чаще у пациентов с АГ, чем у пациентов без нее (67% против 33%), в то время как генотипы А/С и С/С по маркеру А1166С были обнаружены преимущественно у нормотензивных пациентов (р=0,0016) [7]. Kato и соавт. обнаружили, что генотип DD полиморфизма I/D АСЕ является основным фактором риска церебральных и сердечно-сосудистых событий, таких как инсульт у японских гипертоников [4]. Mehri и соавт. [9] также сообщили о сильных ассоциациях между генотипом DD гена ACE и риском АГ в исследуемых популяциях. Гомозиготные DD лица имеют повышенный почти в четыре раза риск развития АГ в популяции Буркина-Фасо по сравнению с гомозиготными носителями I аллеля [7]. Логистический регрессионный анализ подтвердил, что генотип DD гена ACE является фактором риска, который увеличит почти в 4 раза частоту АГ среди пациентов вне зависимости от других факторов риска окружающей среды [8]. Генотипирование по MTHFR может определить легкую или умеренную гипергомоцистеинемию, которая является фактором риска сосудистых заболеваний [4].
Исследование, проведенное International Consortium for Blood Pressure Genome-Wide Association Studies (GWAS) и опубликованное в 2011 году, представляет собой беспрецедентное сотрудничество 230 ученых на шести континентах, которые осуществляли сканирование геномов более 200 000 человек европейского происхождения. Они определили 29 генетических вариаций, которые влияют на ГБ, 16 из которых ранее были неизвестны, а 13 уже были идентифицированы в двух исследованиях, проводившихся в 2009 году [3]. Результаты совместных международных генетических исследований, проведение которых считается важным шагом к пониманию процессов и причин повышения артериального давления, представлены ниже.
Материалы и методы
Материалом настоящего исследования является популяционная выборка людей с отсутствием родственных связей азербайджанской национальности (в совокупности 127 человек). Было проведено обследование пациентов обоих полов с ранее установленным диагнозом ГБ, которые находились на стационарном лечении в Институте кардиологии им. Дж. Абдуллаева (Баку). Для проведения молекулярно-генетических исследований у всех пациентов (n=127), принявших участие, осуществляли забор венозной крови. Генотипирование полиморфизмов генов-кандидатов ГБ проводили методами полимеразной цепной реакции (ПЦР) и рестрикционного анализа.
С целью проведения сравнительного исследования генетических вариаций у больных гипертонией на генном уровне использовали набор Devyser CVD – диагностический продукт in vitro для качественного выявления генетических вариантов, которые могут быть связаны с сердечно-сосудистыми заболеваниями (ССЗ), основанный на мультиплексной аллельной специфической ПЦР-амплификации. Анализ различных генетических вариантов проводился с использованием амплификационной смеси (CVD-смесь). Все собранные из цельной крови человека с использованием QIAamp образцы ДНК были изолированы набором QIAGEN DNeasy Blood & Tissue Kit. Следовали протоколу, начиная с 200 мкл свежей цельной крови, и элюировали в 200 мкл буфера элюирования. Очищенная ДНК использована непосредственно для ПЦР без дальнейшего разведения. Результаты последовательно получены при концентрациях ДНК от 25 до 150 НГ/реакция ПЦР. Для рекомендованных условий и установок анализа PCR результаты последовательно получены на концентрации ДНК между реакцией 25 и 150 нг / PCR (образец 10–60 нг / 1 мкл геномной ДНК).
Результаты и обсуждение
Среди исследуемой популяции по генам группы РАС наименьшее распространение имеет гомозиготный мутантный вариант AСЕ и AGT – 14–16,5%. Наибольшее распространение отмечено у гетерозиготных вариантов гена MTHFR 677 – 67%. По группе учетных генов группы СТО максимума достигали гетерозиготные мутантные варианты генов PAI, F2, F5, F7, составляя долю от 37% до 63%. По генам F13A1, FGB, CBS, ITGB3 в популяции преобладал нормальный генотип, составляя долю от 83% до 93%.
Были проанализированы полиморфные варианты генов, ответственных за развитие гипертонии, у мужчин и женщин в сравнении двух возрастных категорий – старше 35 лет и моложе 35 лет (рис. 1). По гену AGT следует отметить, что среди пациентов разных возрастов и полов его встречаемость значительно различается. При этом у зрелых мужчин с повышенным АД большая часть оказалась носителем варианта нормы и не имеет риска АГ по данному гену. Однако наличие у этой части группы мужчин старше 35 лет повышенного АД и диагностированной АГ говорит о том, что при нормальном варианте гена AGT могут развиваться механизмы, приводящие к этой болезни. У женщин по данному гену наблюдалась обратная картина – максимальная встречаемость мутантных вариантов отмечена у зрелых женщин, при этом гетерозиготный вариант встречался в 54% случаев. У молодых женщин этот вариант встречался реже – в 45% случаев. При этом в группе молодых женщин по гену AGT нормальных вариантов было практически в 2 раза больше, чем у зрелых женщин. Таким образом, современная заболеваемость АГ у женщин Азербайджана отражает генотипическое распространение рискованных генных вариантов – у более возрастных пациентов чаще встречаются мутантные варианты главного AGT гена группы РАС. Особенно опасный для женщин вариант СС встречался в соотношении от 15% до 25,9%. В целом, можно говорить о высоком риске развития АГ и ССЗ в азербайджанской популяции на основании соотношения генных вариантов AGT, особенно высок риск для мужчин 35 лет, показывающих повышенные результаты АД.
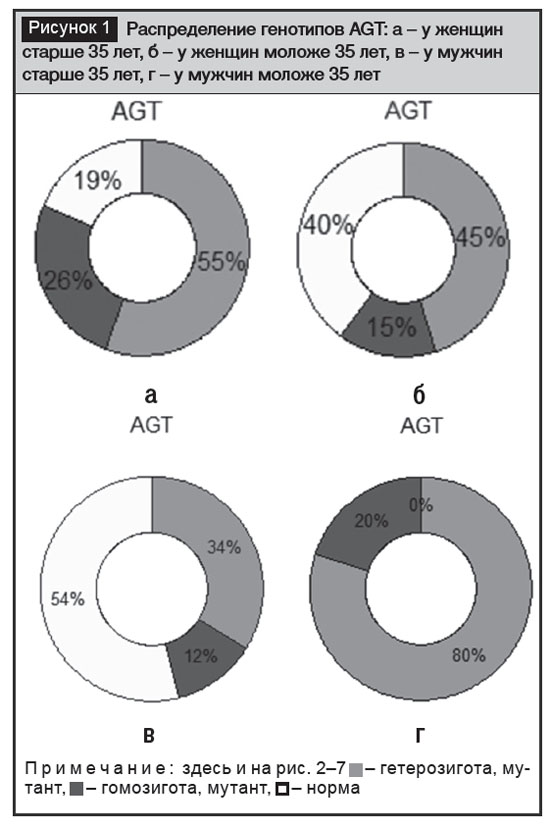
По гену AТG1R также наблюдались существенные различия среди пациентов азербайджанского этноса (рис. 2). Как указывают исследователи, ген ACE функционирует в основном как ген, модифицирующий риск, а эффекты значительно зависят от образа жизни, что в целом отражает картину, полученную в наших исследованиях. Наибольшее количество мутантных вариантов отмечено у мужчин моложе 35 лет, подвергающих себя необдуманному риску вредных привычек, в основном – курения (рис. 3). Вариант нормы по гену АСЕ в нашей работе составил от 50% до 74%. Мутантные варианты АСЕ составили от 26% до 93%, демонстрируя огромный разброс по учетным группам, что в целом подтверждает тезис о том, что ген АСЕ тесно связан с факторами внешней среды. Особенно рискованный вариант DD составил от 13% до 20%.
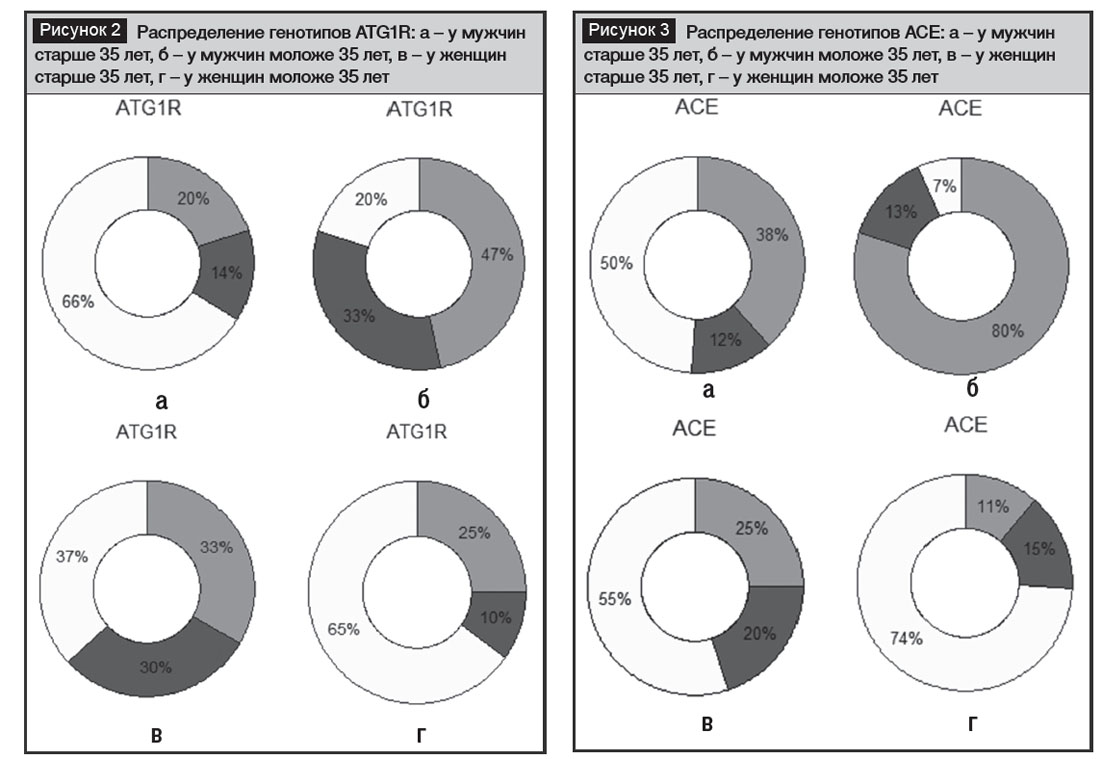
По гену MTHFR в части его полиморфизма по 677 нуклеотидной локализации следует отметить существенное сходство всех исследованных индивидуумов. Количество средне опасного гетерозиготного варианта, определяющего значительный риск АГ и ССЗ, составило от 62% до 74%, при этом по всем учетным группам пациентов было отмечено большое сходство (рис. 4). Единственной группой, которая несколько отличалась от остальных наличием нормального варианта этого гена, оказалась группа зрелых мужчин, доля нормы достигала небольших значений – 12%. Доля наиболее опасного варианта ТТ, обусловливающего наименьшую активность фермента MTHFR, составила 25–33%. Вариант нормы у мужчин – 40–47%, у женщин – от 4% до 20%, снижаясь к зрелому возрасту. Мутантные варианты, ассоциированные с риском увеличения АГ и ССЗ, в популяции азербайджанцев показали весьма значительные проценты и составили от 53% до 96%. Специфической особенностью азербайджанской популяции является сниженная активность фермента MTHFR, обусловленная мутациями C677T и А1298С локализации и высоким риском АГ и ССЗ, что связано с полиморфизмом именно этого гена. По группе генов РАС популяция азербайджанских пациентов с повышенным АД обладает значительным полиморфизмом пяти кандидатных генов, половым диморфизмом из них обладают AGТ, АТG1R и АСЕ. Наибольшее сходство обнаружено по гену MTHFR по обеим локализациям мутантных вариантов.
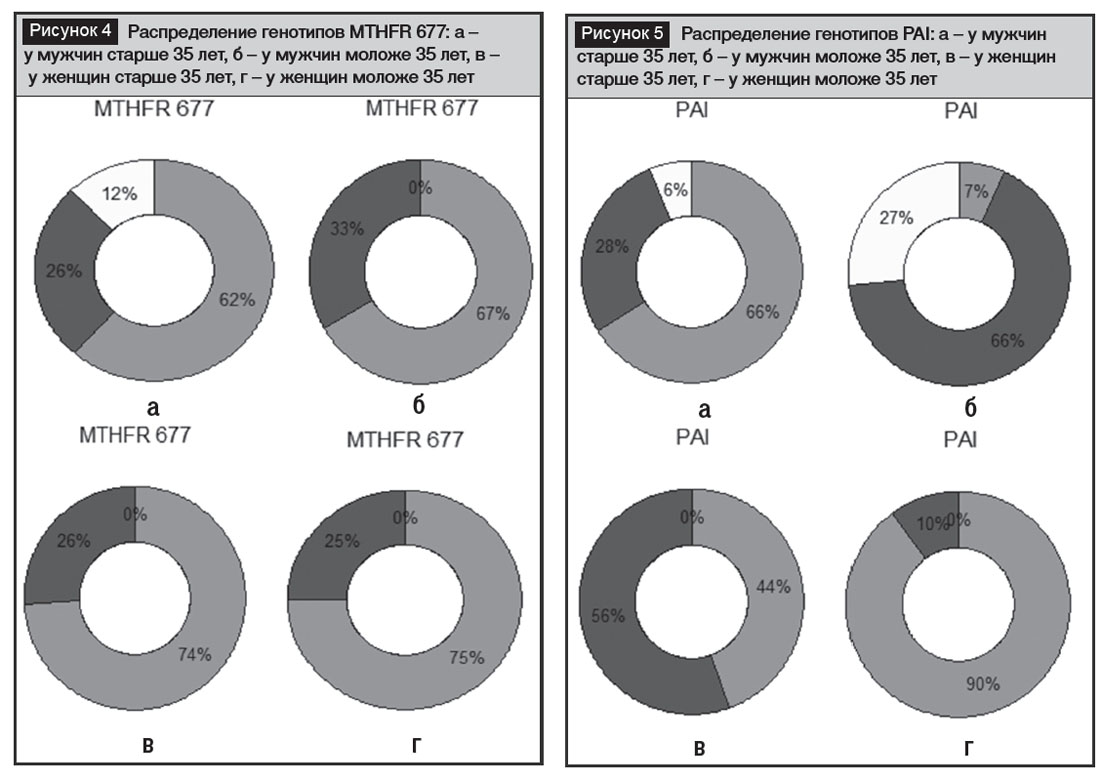
По гену РАI наибольший риск развития тромбозов и ишемической болезни сердца (ИБС) имеют носители аллеля 4G (рис. 5). Среди пациентов учетных групп была отмечена значительная разнородность полиморфизмов гена РАI. Встречаемость аллеля 4G в исследуемой азербайджанской популяции составила от 73% до 100%, что в целом значительно превышает частоту вариантов в европейской популяции по этому гену. Результатом столь широкого распространения аллеля 4G может являться высокая заболеваемость ИБС в Азербайджане. Отмечено, в частности, что у женщин наличие данного аллеля составляет 100%, с возрастом соотношение гомозиготного варианта и гетерозиготы меняется в сторону примерного равенства.
По гену F2 наибольший риск тромбоза имеют носители аллеля А в гомозиготном или гетерозиготном варианте (рис. 6). Наименьшим риском обладали в данном исследовании зрелые мужчины, норма составила порядка 59%.Остальные учетные категории имеют высокий риск развития тромбозов, поскольку распространенность мутантных вариантов достигает 100%. Наибольшим сходством обладали две возрастные группы женщин. Распределение полиморфизмов гена протромбина (F2) у мужчин было очень разнородным.
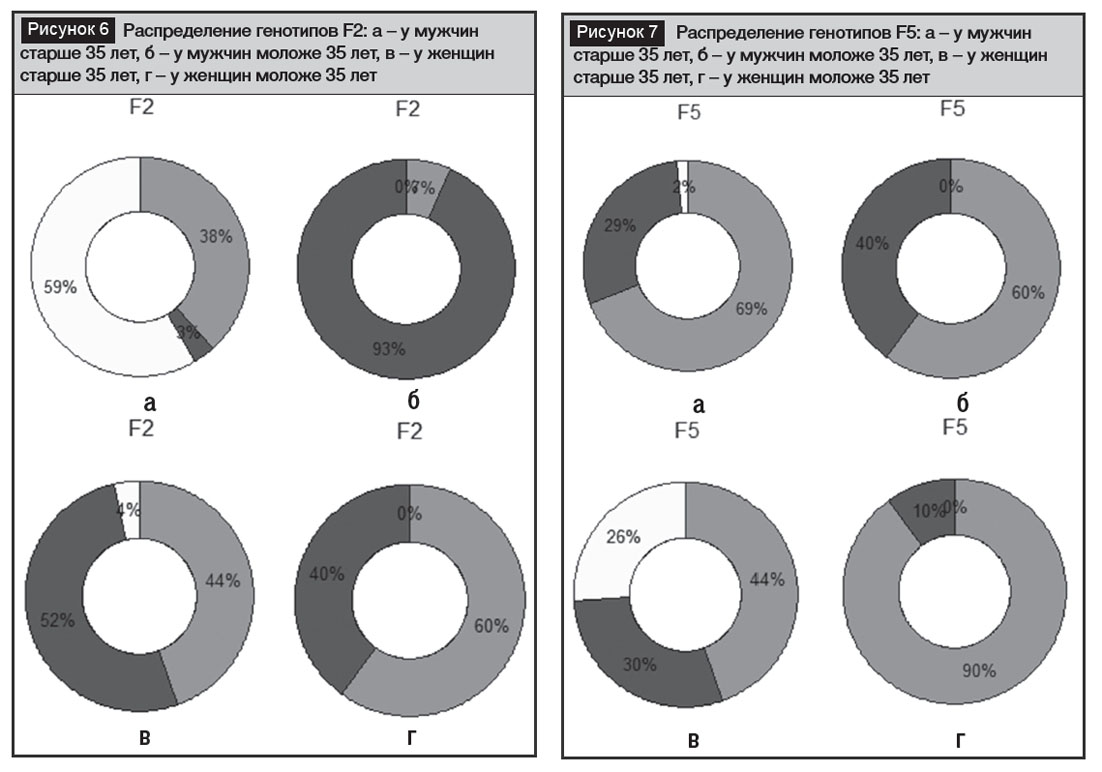
По гену F5 (свертывающий фактор V, фактор Лейден), наоборот, зафиксировали меньший риск у зрелых женщин (рис. 7). У остальных категорий риски оценены как высокие, поскольку распространенность рискованного аллеля А также крайне высока – от 98% до 100% у остальных категорий. Отмечено доминирование гетерозиготного варианта гена F5, что, по-видимому, также является специфической особенностью азербайджанской популяции.
Сходство индивидуумов азербайджанской популяции заключается в широком распространении нормального варианта генотипа по четырем генам группы СТО – F13А1, FGB, СBS и ITGB3, что составило в общем от 67% до 96%. Гены F13А1, FGB, CBS и ITGB3 не являются показательными для оценки рисков ССЗ и тем более АГ в популяции азербайджанцев, поскольку по этим генам доминирует вариант нормы, составляя от 82% до 94%, в связи с чем наименьшее практическое значение для изучения влияния генотипирования и полиморфных генов на возникновение АГ имеют именно эти гены.
Заключение
В настоящем исследовании показана распространенность генов-кандидатов, ассоциированных с риском возникновения АГ, на основании чего были определены специфические генетические особенности азербайджанского этноса. Особенностью азербайджанской популяции являются: меньшая встречаемость генотипа риска DD гена ACE (не более 20%); сниженная активность фермента MTHFR, обусловленная мутациями C677T и А1298С; высокая встречаемость нормального генотипа у генов группы СТО – F13А1, FGB, CBS и ITGB3.
На основании полученных данных рекомендовано проведение профилактической диспансеризации населения, в которое необходимо включать проведение генетического анализа на выявление основных полиморфизмов генов, ответственных за возникновение и развитие АГ и ССЗ. К основным показательным для АГ генам по результатам исследования отнесены полиморфизмы генов AСЕ и AGT, а специфические для азербайджанского этноса – полиморфизмы гена MTHFR. Для предупреждения риска развития ИМ и ИБС необходимо определять полиморфизмы генов РАI и F7 у мужчин. Данные исследования рекомендуются к проведению у пациентов с наличием факторов риск развития АГ – ожирением, вредными привычками, возрастом, стрессами.
Л И Т Е Р А Т У Р А
1. Бармагамбетова А.Т. // Вестник КазНМУ. – 2013. – №1. – С.184–186.
2. Бокарев И.Н. // Клиническая медицина. – 2015. – №8. – С.65–70.
3. Пахомя Н.С., Урясьев О.М., Шаханов А.В. // Земский Врач. – 2014. – №3–4 (24). – С.21–24.
4. Kato N., Tatara Y., Ohishi M., et al. // Hypertension Research. – 2011. – Vol.34, N6. – Р.728–734.
5. Konopka A., Szperl M., Piotrowski W. // Molecular Diagnosis & Therapy. – 2011. – Vol.15, Is.3. – Р.167–176.
6. Liang X., Qiu J., Liu X., et al. // Gene. – 2013. – Vol.15. – Р.73–79.
7. Mehri S., Mahjoub S., Hammami S., et al. // Molecular Biology Reports. – 2012. – Vol.39, N4. – P.4059–4065.
8. Sui X., Gao С. // Molecular Biology Reports. – 2013. – Vol.40, N7. – Р.4439–4445.
9. Tchelougou D., Kologo J.K., Karou S.D. // International Journal of Hypertension. – 2015. – Р.7. Article ID 979631.
Медицинские новости. – 2020. – №1. – С. 65-69.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.