Внимание! Статья адресована врачам-специалистам
Huseynova A.R.1, Gaziyev A.Y.2, Dadashova V.A.2
1Clinic of Nakhchivan Autonomous Republic, Azerbaijan
2Azerbaijan Medical University, Baku
Application of magnetic resonance imaging in the soft tissue tumors diagnostics
Резюме. Изучена роль магнитно-резонансной томографии (МРТ) в диагностике опухолей мягких тканей и проведено исследование семиотики МРТ злокачественных и доброкачественных опухолей мягких тканей. В исследование включены материалы 48 больных со злокачественными и доброкачественными опухолями мягких тканей. Из этих больных 39 (81,2±5,6%) составили основную группу (саркомы мягких тканей) и 9 (18,8±5,6%) – контрольную группу (доброкачественные опухоли мягких тканей). Диагноз был подтвержден морфологически. Описаны результаты исследований МРТ больных, включенных в исследование, а также проведено сравнение между группами. При этом в сравнительном порядке изучены такие признаки, как количество опухолевых очагов, форма опухоли, контуры и структура опухоли (в режиме Т2), степень вовлечения в процесс окружающих тканей. Между группами больных было проведено сравнение интенсивности сигнала, полученного при различных режимах МРТ (Т1, Т2, режим протонной плотности). МРТ является высокоинформативным методом исследования при диагностике опухолей мягких тканей.
Ключевые слова: саркомы мягких тканей, магнитно-резонансная томография.
Медицинские новости. – 2020. – №1. – С. 72–75.
Summary. The purpose of the present study was to investigate the role of MRI in the diagnosis of soft tissue tumors and to investigate the MRI semiotics of malignant and benign tumors of soft tissues. The study included materials from 48 patients diagnosed with malignant and benign tumors of soft tissues. 39 patients (81.2±5.6%) had soft tissue sarcomas (main group), 9 (18.8±5.6) patients with benign tumors of the soft tissues (comparison group). The diagnosis is morphologically confirmed. The results of the MRT examinations of patients enrolled in the study were described and compared between groups. The tumor size, tumor shape, tumor outline, tumor structure (T2 signal intensity), and surrounding tissue involvement were comparatively investigated. Comparison of signal intensity obtained by different MRI modes (T1-weighted mode, T2-weighted mode, proton-density mode) was performed. MRI is a highly informative examination method for the diagnosis of soft tissue tumors.
Keywords: soft tissue sarcomas, magnetic resonance imaging.
Meditsinskie novosti. – 2020. – N1. – P. 72–75.
Саркома мягких тканей (СМТ) – одна из редко встречаемых патологий среди злокачественных опухолей. Так, приблизительно 2–3% злокачественных опухолей приходится на долю опухолей опорно-двигательного аппарата. СМТ встречаются относительно чаще костных сарком [1].
В Азербайджане СМТ в структуре заболеваемости злокачественными опухолями занимают 17-е место (1,72%) среди мужского населения, 16–17-е места с раком слизистой оболочки ротовой полости (1,35%) – среди женского, делят 20–21-е места с раком предстательной железы (1,52%) лица обоих полов [2].
Важную роль играет выявление СМТ, поиск оптимальных методов диагностики для уточнения степени распространенности опухолевого процесса, а также выявление специфической лучевой диагностической семиотики различных форм злокачественных опухолей мягких тканей [3, 4].
В настоящее время МРТ считается эффективным методом в диагностике первичных и рецидивирующих СМТ, а также в оценке эффективности лучевой и химиотерапии [5].
По данным ряда авторов, при комплексной оценке семиотики МРТ (размеры, контуры, гомогенность, интенсивность сигнала) в 82–96% случаев можно выявить злокачественность опухолей мягких тканей. Несмотря на высокую чувствительность этого метода в диагностике СМТ, специфичность относительно низка [6–8]. В связи с этим исследование описания МРТ различных гистологических типов опухолей мягких тканей и изучение роли МРТ в диагностике этих опухолей находится в центре внимания исследователей.
Цель исследования – изучение роли МРТ в диагностике опухолей мягких тканей и исследование семиотики МРТ злокачественных и доброкачественных опухолей мягких тканей.
Материалы и методы
В настоящее исследование включены материалы 48 больных со злокачественными и доброкачественными опухолями мягких тканей, обследованных в онкологической клинике АМУ и в отделении лучевой диагностики больницы Нахичеванской Автономной Республики.
Исследование проведено как ретроспективно, так и проспективно. Из обследованных больных 39 (81,2±5,6%) составили основную группу (саркомы мягких тканей) и 9 (18,8±5,6%) – контрольную группу (доброкачественные опухоли мягких тканей). Больные прошли комплекс клинических, лабораторных, инструментальных обследований, во всех случаях диагноз был подтвержден морфологически.
Исследование МРТ проводилось на аппаратах Philips Achieva 1,5 Tesla и Philips Ingeniа 91,5 Tesla. В исследовании применялись контрастные и неконтрастные режимы аксиальных, коронарных и сагиттальных срезов Т1, Т2, STIR, PD режимов с контрастированием и без контрастирования.
Статистические расчеты проводились с применением методов Уилкоксона, Манна – Уитни, тетрахорического и полихорического анализов Пирсона. Были рассчитаны чувствительность, специфичность и точность диагностического теста [9]. Расчеты проводились в электронной таблице MS Excel-2013 и в программном пакете SPSS-20 [10, 11].
Результаты и обсуждение
На основании результатов морфологического исследования среди обследованных больных гистологические формы опухоли были распределены следующим образом: у 20 (41,7±7,1%) – злокачественная фиброзная гистиоцитома мягких тканей, у 8 (16,7±5,4%) – синовиальная саркома, у 3 (6,3±3,5%) – липосаркома, у 4 (8,3±4,0%) – мезенхимальные опухоли, у 4 (8,3±4,0%) – рабдомиосаркома, у 3 (6,3±3,5%) – гемангиома, у 1 больного (2,1±2,1%) – фиброматоз, у 1 (2,1±2,1%) – эластофиброма, у 3 (6,3±3,5%) – липома, у 1 (2,1±2,1%) – шваннома.
У 19 (48,7±8,0%) больных, входящих в основную группу, опухоль располагалась справа относительно сагиттальной поверхности, у 20 (51,3±8,0%) – слева, у 1 (2,6±2,5%) пациента была двусторонняя опухоль. У 5 (55,6±16,6%) больных, входящих в контрольную группу, патологический очаг располагался справа, у 3 (33,3±15,7%) – слева и у 1 (11,1±10,5%) – была двусторонняя опухоль.
У 30 (76,9±6,7%) больных, входящих в основную группу, опухоль была локализована в области нижних конечностей, у 7 (17,9±6,1%) – в области верхней конечности, у 1 (2,6±2,5%) – в области туловища и у 1 (2,6±2,5%) пациента – в области головы и шеи. В контрольной группе патологический очаг локализовался у 4 (44,4±16,6%) больных на нижних конечностях, у 4 (44,4±16,6%) – на верхних конечностях, у 1 (11,1±10,5%) – в области головы и шеи.
Средний размер выявленного образования в основной группе колебался в пределах 2,5–31,5 см, в среднем составил 7,8 см, а в контрольной группе – в пределах 1,6–14 см и в среднем составил 13,2 см.
Между группами больных было проведено сравнение интенсивности сигнала, полученного при различных режимах МРТ (Т1, Т2, режим протонной плотности).
По мнению авторов, злокачественное образование обычно бывает неправильной формы, с неровными контурами и гетерогенное. В соответствующих исследовательских работах отмечено, что неровность контуров является необязательным показателем злокачественных образований [5, 7].
У 2 (5,1±3,5%) больных с СМТ и у 2 (22,2±13,9%) пациентов из контрольной группы патологический процесс выявлен в виде множественных очагов, в виде единичных очагов – у 37 больных (94,9±3,5%) с СМТ и у 7 (77,8±13,9%) пациентов из контрольной группы (?2=2,797, р=0,094) соответственно.
Форма опухоли у 17 больных (43,6±7,9%) из основной группы была овальной или округлой, у 17 (43,6±7,9%) – неправильной, у 5 (12,8±5,4%) – мультилобулярной, у 4 (44,4±16,6%) пациентов из контрольной группы – овальной или круглой формы, у 3 (33,3±15,7%) – неправильной, у 2 (22,2±13,9%) – мультилобулярной формы (?2=0,629; р=0,730).
Контуры опухоли у больных, включенных в контингент исследования, были следующие: в основной группе у 12 (30,8±7,4%) человек – ровные, у 25 (64,1±7,7%) – неровные, у 2 (5,1±3,5%) – лобулярные; в контрольной группе у 3 (33,3±15,7%) пациентов – ровные, у 6 (66,7±15,7%) – неровные (?2=0,484; р=0,785). При разделении контуров на четкие и нечеткие у 33 (84,6±5,8%) больных с СМТ отмечались ровные и у 6 (66,7±15,7%) – неровные контуры, в контрольной группе – у 6 (66,7±15,7%) больных ровные и у 3 (33,3±15,7%) – неровные контуры (?2=1,546; р=0,214).
Структура опухоли была гомогенная у 15 (38,5±7,8%) пациентов и гетерогенная у 24 (61,5±7,8%) больных в основной группе, гомогенная – у 4 (44,4±16,6%) и гетерогенная – у 5 (55,6±16,6%) больных в контрольной группе (?2=0,109; р=0,741). Изменения в структуре опухоли (по интенсивности Т2-сигнала) были также сгруппированы на основании прослеживания некротического процесса. Так, у 7 больных (17,9±6,1%) с СМТ выявлены изменения с некрозом, у 13 (33,3±7,5%) больных – без некроза, у 19 (48,7±8%) – смешанного типа; в контрольной группе у 1 (11,1±10,5%) человека – с некрозом, у 6 (66,7±15,7%) – без некроза, у 2 (22,2±13,9%) больных выявлен смешанный тип изменений (?2=3,431; р=0180). У 9 (23,1±6,7%) больных с СМТ и у 2 (22,2±13,9%) пациентов из контрольной группы были определены патологические очаги с усилением сосудистого рисунка.
Было оценено и проведено сравнение интенсивности сигналов, полученных от патологических очагов, выявленных в различных режимах МРТ. В Т1-режиме у 38 (97,4±2,5%) больных с СМТ отмечался гипо-, а у 1 (2,6±2,5%) – изоинтенсивный сигнал; в Т2-режиме у 8 (20,5±6,5%) больных – гипо-, у 2 (5,1±3,5%) – изо-, у 29 (74,4±7%) больных – гиперинтенсивный сигнал; в режиме протонной плотности эти показатели были 6 (15,4±5,8%), 2 (5,1±3,5%) и 31 (79,5±6,5%) соответственно. В контрольной группе в Т1-режиме у 1 (11,1±10,5%) больного отмечен гипо-, у 2 (22,2±13,9%) – изо-, у 6 (66,7±15,7%) – гиперинтенсивный сигнал (ру.t<0,001). В двух других режимах получены гипо- и гиперинтенсивные сигналы патологических очагов. В Т2-режиме эти показатели соответствовали 44,4±16,6% (4 больных) и 55,6±16,6% (5 больных), а в режиме протонной плотности, наоборот, отмечены 55,6±16,6% (5 больных) и 44,4±16,6% (4 больных) (ру.t<0,05) соответственно.
С помощью МРТ было изучено воздействие опухоли на окружающие ткани. Так, инвазия патологического процесса в кости при СМТ встречалась у 10 (25,6±7,0%) больных. У 4 (10,3±4,9%) больных с СМТ определялась инвазия опухоли в соседний сустав. У 4 (10,3±4,9%) больных с СМТ и у 1 (11,1±10,5%) пациента из контрольной группы была выявлена компрессия нервно-сосудистого пучка.
Увеличение региональных лимфатических узлов наблюдалось в обеих группах: у 11 (28,2±7,2%) больных в основной и у 1 (11,1±10,5%) человека в контрольной группе.
Была изучена взаимосвязь между особенностями опухолей, выявленных при МРТ, а также рассчитан коэффициент корреляции. Выявлены слабые корреляционные связи между размером патологического процесса при СМТ с другими признаками. Сигнал, полученный в режиме Т1, не зависел от семиотики лучевой диагностики образования, а в режимах Т2 и протонной плотности полученный сигнал зависел от малого количества признаков. Также была выявлена связь между этими двумя режимами (r=0,836, p<0,01). Наблюдалась прямая связь между контурами и формой опухоли (r=0,754, p<0,01).
Семиотика МРТ в зависимости от гистологического типа опухоли была следующей: у 10 (50,0±11,2%) больных злокачественной фиброзной гистио-цитомой мягких тканей обнаружены образования овальной и округлой формы, у 8 (40,0±11,0%) – опухоли неправильной формы и у 2 (10,0±6,7%) – мультилобулярные. По контурам опухоли были разделены на ровные (7 больных – 35,0±10,7%) и неровные (13 больных – 65,0±10,7%), а также четкие (18 больных – 90,0±6,7%) и нечеткие (2 больных – 10,0±6,7%).
Были получены следующие результаты в различных режимах исследования МРТ. В Т1-режиме: у 19 (95,0±4,9%) больных – гипо-, у 1 (5,0±4,9%) – изоинтенсивный сигнал; в Т2-режиме: у 8 (40,0±11%) человек – гипо-, у 2 (10,0±6,7%) – изо-, у 10 (50,0±11,2%) – гиперинтенсивный сигнал; в режиме протонной плотности: у 6 (30,0±10,2%) пациентов – гипо-, у 2 – изо-, а у 12 (60,0±11%) больных получены гиперинтенсивные сигналы.
У большинства больных, включенных в исследование (95,0±4,9%), в режиме Т1 получен гипосигнал, а в режиме Т2 результаты были близки друг другу (гипо- и гиперинтенсивные сигналы).
У 7 (87,5±11,7%) больных синовиальной саркомой опухоль была с неровными, у 6 (75,0±15,3%) – с четкими контурами. По форме образования у 2 (25,0±15,3%) человек наблюдалась правильная, у 5 (62,5±17,1%) – неправильная, у 1 (12,5±11,7%) – мультилобулярная структура опухоли, у 7 (87,5±11,7%) – структура опухоли слегка гетерогенная. У всех больных в Т1-режиме получены гипо-, в Т2- и в режиме протонной плотности – гиперинтенсивные сигналы.
Ниже представлены примеры больных с саркомами мягких тканей, включенных в группу исследования.
Больной Г.А., 19 лет, мужского пола, обратился в онкологическую клинику Азербайджанского медицинского университета с жалобами на опухоль в левой локтевой области. Были получены некоторые изображения в режимах аксиальной T1 TSE, аксиальной и коронарной Т2 TSE SPAIR при МРТ (рис. 1). При исследовании МРТ левой локтевой области выявлена следующая картина: ширина левого плече-локтевого и проксимального луче-локтевого сустава естественная, толщина суставного хряща в пределах нормы, суставная жидкость физиологическая, медиальные и латеральные коллатеральные связки на месте, толщина и интенсивность сигнала естественные.
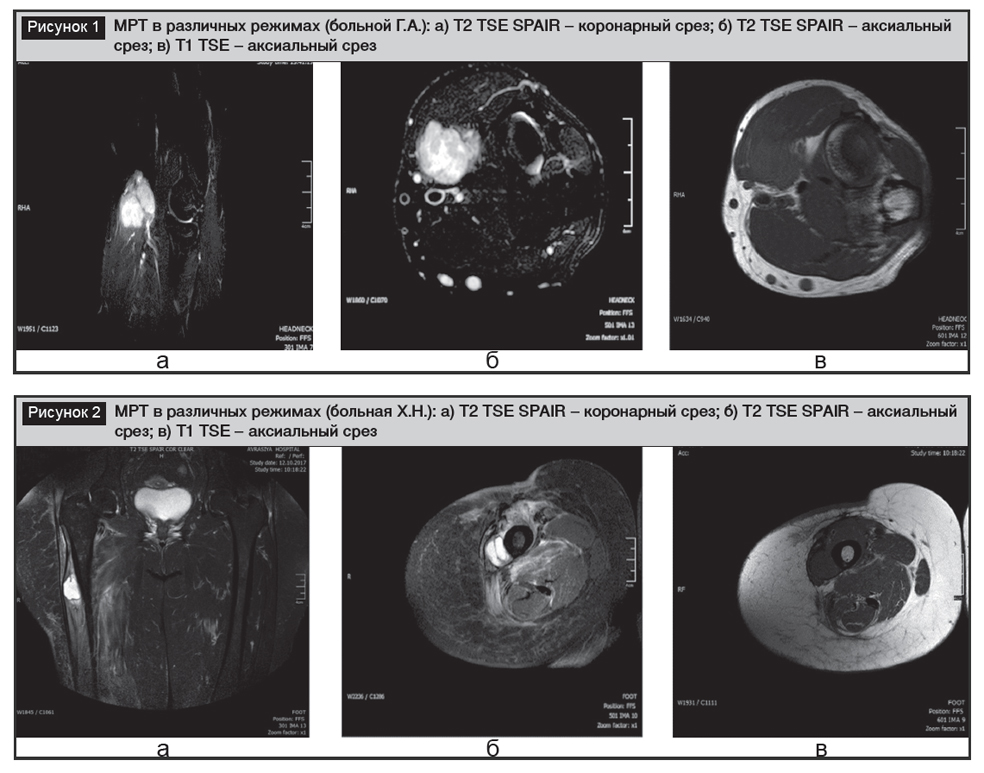
Между плечевой и плече-лучевой мышцей в вентральном отделе локтя обнаружено минимально гиперинтенсивное Т1-, гиперинтенсивное Т2-образования гетерогенной структуры размером (минимально протягивающееся внутрь плече-лучевой мышцы) 35х25х24 мм. Не была выявлена инвазия образования в кости, плечевую мышцу, плечевую вену, главную вену и среднюю локтевую вену. Форма и интенсивность сигналов костей, входящих в зону исследования, естественные.
Больной прошел комплекс клинических, лабораторных, инструментальных исследований, в плановом порядке было выполнено широкое иссечение опухоли. Гистологический диагноз – злокачественная мезенхимальная опухоль мягких тканей.
Больная Х.Н., 62 года, женского пола, обратилась в онкологическую клинику Азербайджанского медицинского университета с жалобами на боли в области правого бедра. При объективном исследовании опухоль не пальпировалась. Были получены изображения в аксиальном T1 TSE, аксиальном и коронарном T2 TSE SPAIR режимах МРТ (рис. 2). При МРТ бедренной области в верхней 1/3 части правого бедра обнаружена Т1-гипо-, Т2-гиперинтенсивная опухоль размерами 28х27 мм, расположенная латерально в близости от бедренной кости, в толще мышцы vastus intermedius (средняя широкая мышца бедра). Инвазия опухоли в бедренную кость не обнаружена.
Отмечались изменения Т2-гиперинтенсивного сигнала в правой четырехглавой и приводящей мышцах бедра, связанные с отеком. Часть бедренной кости, входящая в зону исследования, интактна.
Больная прошла комплекс клинических, лабораторно-инструментальных исследований, подготовлена к операции. В плановом порядке проведено широкое иссечение опухоли. Гистологический диагноз – низкодифференцированная синовиальная саркома.
После выявления диагностических критериев были определены диагностические показатели для каждого метода исследования (чувствительность, специфичность, точность, оценка эффективности положительных и отрицательных результатов, достоверность положительных и отрицательных результатов).
В диагностике патологий мягких тканей чувствительность (Se) МРТ составляла 94,9±3,1%, специфичность (Sp) – 88,9±10,5%, точность (DD) – 93,8±3,5%.
В диагностике злокачественных фиброзных гистиоцитом мягких тканей диагностическая точность МРТ составила 93,1±4,7%. Следовательно, при опухолях мягких тканей МРТ является высокоинформативным методом исследования.
Л И Т Е Р А Т У Р А
1. Siegel R., Miller K., Jemal A. // A cancer journal for clinicians. – 2017. – Vol.67 (1). – Р.7–30.
2. Казиев А.Ю. Эпидемиология, медицинские, демографические и социально-экономические аспекты злокачественных опухолей в Азербайджане. Дис. … д-ра мед. наук. – Баку, 2005. – 412 с.
3. Семенов И.И., и др. // Практическая онкология. – 2013. – Т.14, №2. – С.87–96.
4. Dickerson B., Fenstermacher E., Salat D., et al. // Neuroimage. – 2008. – Vol.39 (1). – Р.10–18.
5. Zamogilnaya Y.А. Current imaging techniques in the assessment of preoperative chemotherapy response in patients with extremity soft tissue sarcomas: Author’ PhD thesis. – М., 2014. – 25 p.
6. Murphey M., Senchak L., Mambalam P., et al. // Radiographics. – 2013. – Vol.33 (3). – Р.803–831.
7. Chou S., Hippe D., Lee A., et al. // Academic radiology. – 2017. – Vol.24 (5). – Р.615–622.
8. Upadhyay N., Saifuddin A. // Skeletal radiology. – 2015. – Vol.44 (4). – Р.467–476.
9. Петри А., Сэбин К. Наглядная статистика в медицине / Пер. с анг. В.П. Леонова. – М., 2009. – 168 с.
10. Лебедев А. Понятный самоучитель Excel 2013. – Питер, 2014. – 128 с.
11. Arbuckle J. IBM SPSS Amos 21: User’s Guide IBM Corp., Amos Development Corporation, 2012. – 680 p. http://www.twirpx.com/file/933135.
Медицинские новости. – 2020. – №1. – С. 72-75.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.