Внимание! Статья адресована врачам-специалистам
Semen Naumovich, MD, Professor, Head of the Department of Orthopedic Dentistry of the Belarusian State Medical University, Minsk
Vitaly Plavsky, PhD, Deputy Director of the SSI B.I. Stepanov Institute of Physics of the National Academy of Sciences of Belarus, Minsk
Andrey Kuvshinov, PhD, Associate Professor of the Departement of Orthopedic Dentistry of the Belarusian State Medical University, Minsk
Antimicrobial photodynamic therapy: advantages, disadvantages and development prospects
Резюме. Антимикробная фотодинамическая терапия зарекомендовала себя как эффективный метод подавления жизнедеятельности патогенных микроорганизмов в инфекционно-воспалительном очаге. Опыт применения данного метода в клинике выявил ряд недостатков, обусловленных физико-химическими свойствами применяемых фотосенсибилизаторов и особенностями их взаимодействия с биологической средой. Работа по преодолению этих недостатков может быть направлена на поиск и создание новых веществ, обладающих фотохимической активностью, а также на использование эндогенных соединений микробной клетки.
В статье представлены химико-биологические механизмы фотодинамического взаимодействия, этапы развития антимикробного направления фотодинамической терапии, трудности и перспективы его развития.
Ключевые слова: фотодинамическая терапия, фотосенсибилизатор, синглетный кислород, патогенные микроорганизмы, лазерное излучение.
Современная стоматология. – 2020. – №1. – С. 11–16.
Summary. Antimicrobial photodynamic therapy has established itself as an effective method of suppressing the vital activity of pathogenic microorganisms in an infectious and inflammatory focus. However, the experience of using this method in the clinic revealed a number of drawbacks, primarily due to the properties of the photosensitizers used today and the peculiarities of their interaction with the biological environment. The search for ways to overcome existing difficulties can be aimed at creating new exogenous substances, as well as at using photoactive endogenous compounds of the microbial cell itself in generating free radical processes.
On the basis of the presented chemical-biological mechanisms of photodynamic interaction, the article describes the main characteristics of its antimicrobial aspect, as well as possible directions for the qualitative improvement of the latter.
Keywords: photodynamic therapy, pathogenic microorganisms, photosensitizer, laser radiation.
Sovremennaya stomatologiya. – 2020. – N1. – P. 11–16.
Фотодинамическая терапия (ФДТ) является эффективным методом лечения инфекционно-воспалительных заболеваний. Ее применение позволяет обеспечить элиминацию из патологического очага микроорганизмов, недоступных для механического, антисептического и антибактериального воздействия. В отличие от использования антибиотиков механизм воздействия ФДТ лишен следующих недостатков: системного действия, уничтожения нормальной микрофлоры, появления микробной устойчивости, токсических побочных эффектов. Кроме того, способность фотосенсибилизатора и лазерного излучения проникать на определенную глубину в ткань обеспечивает возможность прицельного уничтожения патогенной микрофлоры, локализованной субповерхностно и недоступной для действия механических и антисептических средств.
В полости рта мы имеем дело с организованным биоценозом, способным вырабатывать эффективные механизмы коллективной защиты на внешнее воздействие. Поэтому при изучении различных аспектов фотодинамической терапии результаты исследований in vitro и in vivo не всегда будут коррелировать. Так, однократная процедура ФДТ в полости рта может не вызвать существенного изменения микробной обсемененности, в то время как аналогичное воздействие в условиях эксперимента обусловливает практическую стерильность. Проведение повторной процедуры в полости рта позволяет добиться ожидаемого эффекта, что свидетельствует о том, что первичная фотохимическая атака играет, судя по всему, подготовительную роль, деструктурируя матрицу микробной бляшки и открывая непосредственный доступ к бактериальным клеткам.
Механизм реализации фототоксического эффекта в биоткани
Главной мишенью фотодинамического воздействия являются мембранные структуры микробной клетки, для повреждения которых необходимо наличие фоточувствительного вещества, имеющего сродство к молекулам, входящим в состав этих структур, света и растворенного в биологической жидкости кислорода. Первым этапом фотодинамической реакции является поглощение кванта света молекулой светочувствительного вещества и переход его в возбужденное и в то же время нестабильное состояние. Затем это вещество может взаимодействовать либо непосредственно с биосубстратом, тогда реакция идет по типу I, либо с растворенным в цитоплазме молекулярным кислородом, тогда реакция идет по типу II. В первом случае сенсибилизированный агент (3Sens*) отрывает электрон от биологической макромолекулы субстрата, что ведет к образованию двух свободных радикалов – анионного радикала фотосенсибилизатора и катионного радикала биосубстрата:
3Sens* + Х → - Sens• + +X•
Образовавшийся анионный радикал фотосенсибилизатора передает электрон молекулярному тканевому кислороду с образованием новой реакционноспособной частицы – супероксидного анион-радикала:
- Sens• + O2 → Sens + - O2•
Таким образом, результатом первичной фотохимической реакции является образование двух радикалов: катионного радикала биосубстрата +X• и супероксидного анион-радикала -O2•. Фотохимическая деградация биологических макромолекул наступает в результате реакций перекисного окисления, образования новых радикалов и ряда других процессов.
При протекании реакций II типа происходит взаимодействие возбужденного фотосенсибилизатора непосредственно с молекулярным кислородом. Причем в реакцию вступает как триплетная форма сенсибилизированного агента (3Sens*), так и существующая совсем недолго синглетная (1Sens*). Результатом указанного взаимодействия является образование чрезвычайно активного окислителя – синглетного кислорода и возврат возбужденного соединения в свое основное состояние [1].
1Sens* + 3O2 → 3Sens* + 1O2
3Sens* + 3O2 → Sens + 1O2
Синглетный кислород окисляет ароматические аминокислоты, вызывает перекисное окисление липидов, запускает вторичные свободнорадикальные процессы. Финалом его взаимодействия с биосубстратом служит деградация макромолекул-мишеней, что при достаточном количестве фотосенсибилизатора обусловливает цитолиз [9].
В квантовой механике система энергетических подуровней, на которую расщепляется энергетическая оболочка атома или молекулы в результате спин-орбитального взаимодействия, носит название тонкой структуры. Спиновая мультиплетность – параметр, описывающий количественные характеристики тонкой структуры и рассчитываемый по формуле M=2S+1, где S – спиновое квантовое число, определяемое как суммарный спин всех электронов системы.
Численное значение спина может быть +½ и -½, что говорит о том, что для атомов или молекул с четным числом атомов и антипараллельностью спиновых моментов, спиновое квантовое число будет равно 0, а спиновая мультиплетность – 1. Такое состояние характеризуется нерасщепленностью энергетической оболочки частицы и называется синглетным. В силу взаимного расталкивания электронов с антипараллельными спинами синглетное состояние является наиболее высоким по энергии. В случае, если спиновые моменты двух электронов, как, например, в молекуле кислорода, параллельны, спиновое квантовое число будет ½+½=1, а спиновая мультиплетность 2×1+1=3. В таком состоянии энергетическая оболочка молекулы расщеплена на 3 энергетических подуровня, а само состояние носит название «триплет». Это состояние стабильно и является для кислорода основным.
При передаче на молекулу кислорода энергии извне, например, с возбужденной молекулы фотосенсибилизатора либо за счет прямого облучения субстрата, может происходить изменение взаимной ориентации спинов неспаренных электронов внешней электронной оболочки на антипараллельное, и соответствующая трансформация триплетного энергетического состояния в состояние с более высокой энергией – синглетное.
В зависимости от расположения неспаренных электронов на электронных орбиталях выделяют первое и второе синглетные состояния кислорода, характеристики которых несколько отличаются (рис. 1). Так, например, время существования в газовой фазе молекулы кислорода в первом синглетном состоянии составляет около 7 секунд, а во втором – 72 минуты. В условиях жидкой фазы, с которой мы имеем дело при проведении фотодинамической терапии, время существования молекулы синглетного кислорода сокращается до 10-9–10-8 секунд. Синглетный кислород обладает особой реакционной способностью, которая существенно отличается от таковой для основного состояния. Так, молекулы синглетного кислорода способны принимать участие в сложных органических реакциях, таких как реакции Дильса – Альдера, еновые реакции, а также запускать каскад свободнорадикальных взаимодействий.
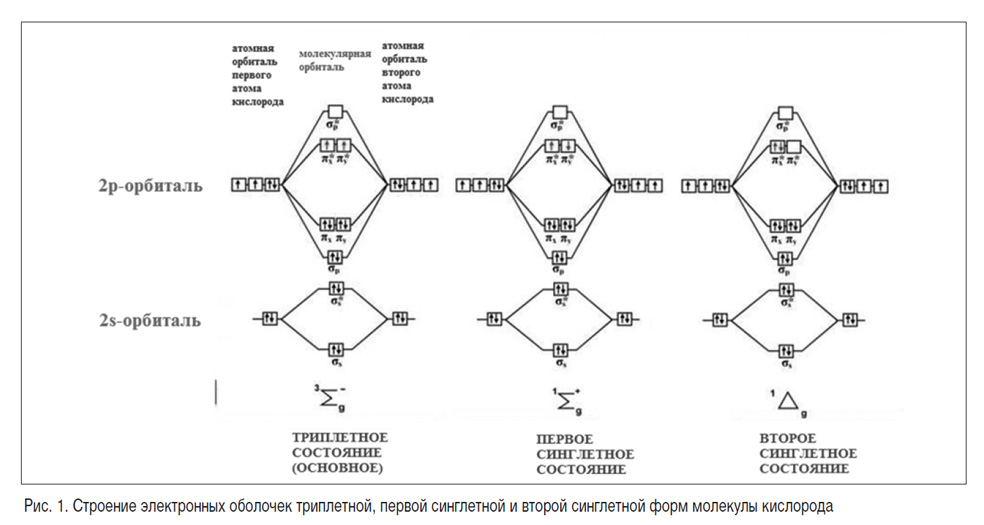
Определить синглетный кислород с помощью оборудования можно по его очень слабой фосфоресценции на длине волны 1270 нм. При высокой концентрации молекул происходят их столкновения с образованием так называемых димолей и соответствующим удвоением энергии излучения образующегося соединения. При последующем переходе димолей из возбужденного синглетного в стабильное триплетное состояние происходит испускание энергии в форме излучения с длиной волны в два раза меньше, чем при фосфоресценции мономолекулярных частиц (в соответствии с расчетами по формулам Е=h? и ?=1/?, где Е – энергия излучения, h – постоянная Планка, ? – частота излучения, ? – длина волны излучения). Длина волны такого излучения составляет 634 нм, что соответствует красной области видимой части спектра.
Примером качественной реакции образования синглетного кислорода может служить взаимодействие газообразного хлора с гидроксидом натрия и перекисью водорода в растворе, в результате которого через стадии образования гипохлорит- и хлорпероксид-ионов, происходит выделение синглетного кислорода. При переходе его в стабильную триплетную форму регистрируется испускание света.
В условиях реальной биологической системы одновременно протекают оба типа реакций (I и II). Количественный вклад каждой из них в общий химический процесс определяется природой окисляемого субстрата и агента, количеством растворенного в биологической жидкости кислорода и рядом других факторов. Оба механизма дополняют друг друга, что в некоторых случаях обусловливает фотодинамический эффект там, где каждый из механизмов по отдельности оказался бы неэффективным.
Резистентность микроорганизмов к фотодинамической терапии
Фотохимическая деградация биологического субстрата возможна лишь при непосредственном контакте фотосенсибилизатора с молекулой-мишенью. Причина состоит в том, что время жизни и диффузионная длина синглетного кислорода чрезвычайно малы: 10-9–10-8 секунд и 10–20 нм соответственно. Образование частицы на некотором расстоянии от повреждаемой структуры приводит к ее дезактивации задолго до непосредственного контакта с этой структурой. Поэтому важнейшим фактором является сродство или способность фотосенсибилизатора прочно сорбироваться на поверхности структурных элементов клетки-мишени [18].
Для грамположительных и грамотрицательных микроорганизмов этот процесс протекает по-разному, и одной из существенных трудностей, с которой столкнулись исследователи, стала устойчивость грамотрицательных микроорганизмов к фотодинамическому воздействию. Обладая слабопроницаемой клеточной стенкой, грамотрицательные микроорганизмы либо не захватывали молекулу фотосенсибилизатора, либо, если захват происходил, то соответствующая реакция не развивалась. Этот аспект служит объяснением неэффективности применения фотосенсибилизаторов I поколения при фотодинамической терапии ряда гнойно-воспалительных процессов, вызываемых неоднородной комплексной микрофлорой.
Первым шагом на пути преодоления устойчивости грамотрицательных микроорганизмов к ФДТ было применение так называемых векторов – биологических агентов или химических веществ, изменяющих проницаемость клеточной стенки микроорганизма за счет ферментной деградации. В роли таких агентов были использованы хлорид кальция, ЭДТА, полимиксин B. Однако, очевидно, что дополнительный этап существенно усложнит технику проведения процедуры ФДТ в клинике и в реальных условиях нежелателен [4, 7, 8, 17].
Изучение эффективности использования различных фотосенсибилизаторов in vitro на примере фотохимического действия на кишечную и синегнойную палочку показало, что грамотрицательные микроорганизмы также могут быть объектом летальной фотосенсибилизации при условии, что используемый фотохимический агент будет иметь положительный заряд. На тот момент все используемые в клинике фотосенсибилизаторы были либо анионными, либо нейтральными; если и происходил их захват грамотрицательным микроорганизмом, то из-за отсутствия его внутриклеточной сорбции, цитолитическая фотодинамическая реакция не развивалась. В то же время использование в качестве светочувствительного агента положительно заряженного иона позволяло обеспечить его захват грамотрицательной микробной клеткой, дальнейшую внутриклеточную сорбцию на функциональных структурах и финальную летальную фотосенсибилизацию.
Поиск причин этого явления показал, что фотосенсибилизатор, как химическое вещество, состоит из нескольких фракций, каждая из которых характеризуется определенной силой связи с внутриклеточными структурами. Среди исследуемых фоточувствительных веществ лишь катионная форма содержала фракции, прочно ассоциируемые с компонентами грамотрицательных микроорганизмов и неудаляемые при повторных промываниях [8, 17].
Кроме того, было показано, что при фотоинактивации грамположительных и грамотрицательных микробных клеток работают разные механизмы. Фотодинамическая деструкция грамположительных микроорганизмов протекает только по II типу реакции с образованием синглетного кислорода, в то время как летальная фотосенсибилизация грамотрицательных микробов последовательно включает в себя оба механизма. В первую очередь запускается реакция типа I, которая приводит к изменению проницаемости клеточной стенки, после чего присоединяется реакция типа II, обусловливающая цитолиз [4, 8, 11, 13, 15, 16, 21].
Важным направлением дальнейшего развития антимикробной ФДТ стал поиск и синтез новых фотосенсибилизаторов. Из синтезированных соединений наибольшую терапевтическую эффективность показали группы мезо-замещенных порфиринов и производных фталоцианина. Причем именно катионные производные этих групп проявили фотодинамическую активность в отношении как грамположительных, так и грамотрицательных микроорганизмов, а также грибов [7, 8, 13–15, 17, 20].
Современные фотосенсибилизаторы и особенности их применения в стоматологии
Фотосенсибилизатор – это химическое вещество, способное поглощать энергию света, переходя при этом на более высокий энергетический уровень, и в возбужденном состоянии проявлять активность, взаимодействуя с другими веществами. Молекула фотосенсибилизатора в той или иной степени поглощает излучение различных длин волн, но существуют участки спектрального диапазона, в которых это поглощение максимально, и которые носят название пика поглощения.
Фотохимической активностью обладают соединения, относящиеся к самым разным классам. Классификация фоточувствительных веществ осуществляется по химическому строению и диапазону поглощения света. Различают также поколения фотосенсибилизаторов. Белорусскими учеными предложена интегральная классификация фотохимически активных агентов, объединяющая существующие мировые данные. Ее применение позволяет выбрать соединение в зависимости от клинической ситуации и параметров лазерного оборудования, а также подобрать излучатель и препарат, зарегистрированные в РБ [2].
Важнейшее место как в природных, так и в антропогенных фотохимических процессах принадлежит такому соединению, как порфирин. Молекула порфирина представляет собой тетрапиррольный макроцикл, в котором четыре азотсодержащих ядра соединены друг с другом четырьмя метиновыми мостиками. Протяженная сопряженная система электронов обусловливает уникальность этого соединения и лежит в основе крайне высокого (порядка 105) молярного коэффициента светопоглощения. Кроме того, порфирин является мощным хелатирующим лигандом, образующим комплексы с большей частью элементов таблицы Д.И. Менделеева [3]. Хрестоматийным примером такого комплексного соединения может служить гем, который выступает в качестве простетической группы белков-переносчиков кислорода (миоглобин, гемоглобин) и универсальных переносчиков электронтранспортной цепи – цитохромов.
Гидрирование одной двойной связи в молекуле порфирина приводит к образованию хлорина, который, образуя комплексы с ионами магния, дает начало зеленым пигментам растительных и бактериальных клеток – хлорофиллам. В свою очередь гидрирование двух двойных связей трансформирует порфирин в бактериохлорин, комплексное соединение которого, бактериохлорофилл, локализуясь в хлоросомах и мембране анаэробных фототрофных бактерий, обусловливает протекание аноксигенного, или бескислородного, фотосинтеза.
Рассмотрим механизм природной реакции оксигенного фотосинтеза в качестве примера протекания фотохимических реакций в биологических системах. Молекула хлорофилла выступает в качестве фотосинтетической антенны, обеспечивая восприятие энергии видимого солнечного излучения и трансформируя ее в энергию протонной градиентной поляризации биологических мембран. Обладая сопряженной системой двойных связей, а также системой неспаренных электронов атомов азота и иона магния, молекула хлорофилла имеет два уровня возбуждения, что на спектре действия фотосинтеза (кривая зависимости интенсивности фотосинтеза от длины волны падающего света) проявляется в виде наличия двух максимумов интенсивности протекания реакции (рис. 2) [6]. При этом, в зависимости от измененности или неизмененности спина электрона, возбужденное состояние пигментной молекулы может быть синглетным или триплетным. Находясь на более высоком энергетическом уровне, молекула хлорофилла далее передает принятый потенциал окружающей среде либо другому соединению.
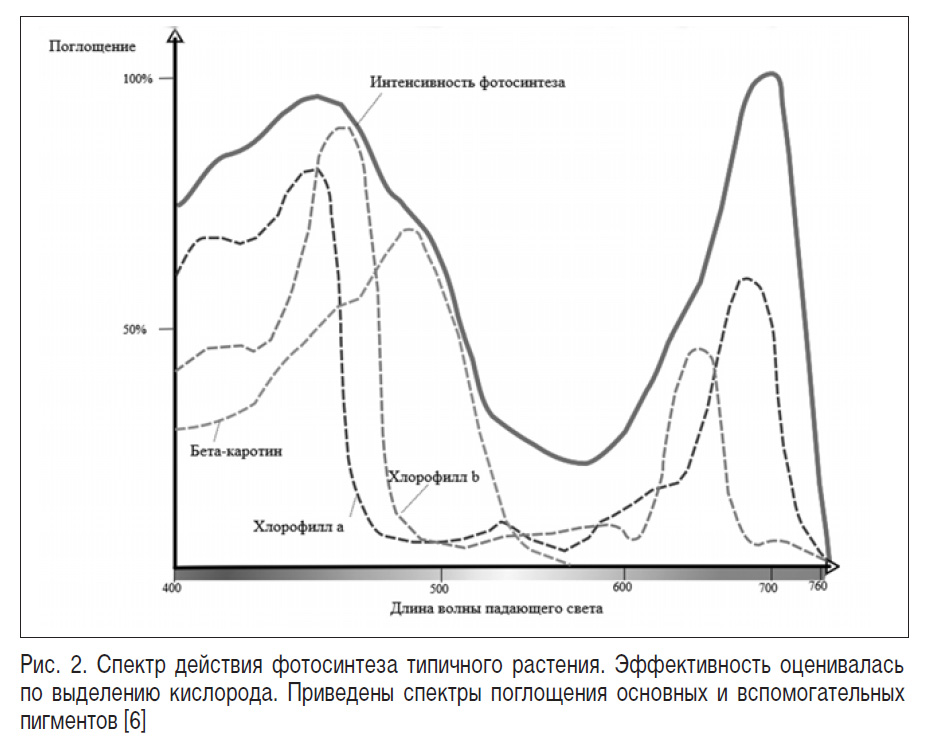
Второй уровень возбуждения пигментной молекулы высокоэнергетичен, нестабилен, и за 10-12 секунд происходит переход на первый уровень с выделением в окружающую среду тепла. Последующий переход электрона из первого возбужденного состояния в основное может протекать двумя путями. При первом происходит выделение света (флуоресценция, фосфоресценция), тепла и передача энергии другим соединениям. При втором, за счет слабой связи возбужденного электрона с ядром, – перенос последнего на молекулу другого вещества (первичного акцептора) с последующей транспортировкой его через цепь элементов электрон-транспортной цепи к молекуле НАДФН+ и восстановлением последней. Восстановление молекулы хлорофилла происходит за счет окисления воды.
К фотосенсибилизаторам первого поколения относят производные гематопорфирина, не оказывающие при активации бактерицидного действия на грамотрицательные микроорганизмы. Работа над преодолением устойчивости грамотрицательных микроорганизмов привела к созданию фотосенсибилизаторов II поколения, основные группы которых представлены ниже.
1) Производные хлорофилла а. Хлорофилл – природное химическое соединение, в основе строения которого лежит тетрапиррольный макроцикл – хлорин, в центре располагается атом магния. Функция хлорофилла – оксигенный фотосинтез в хлоропластах живых клеток. В зависимости от химического строения заместителя различают 6 типов хлорофилла – a, b, c1, c2, d и f. Хлорофилл а имеет наиболее широкое распространение, локализуясь в клетках высших растений, водорослях, цианобактериях (сине-зеленых водорослях), фотоавтотрофных простейших и бактериях. В качестве фотосенсибилизаторов могут быть использованы такие производные хлорофилла а, как хлорин е6, феофорбид, моно- и диамиды хлорофилла а с природной аспарагиновой кислотой.
2) Производные бактериохлорофилла а. Бактериохлорофилл а является основным фотосинтетическим пигментом пурпурных бактерий и отличается от хлорофилла а дополнительным гидрированием двойной связи в положениях 7 и 8. Эта особенность химического строения обусловливает смещение основной полосы поглощения в ближнюю инфракрасную область примерно на 100 нм [10]. По аналогии с хлорофиллом а получены производные бактериохлорофилла, среди которых наиболее значимым является бактериопурин.
3) Тетраазопорфирины. Особенностью химического строения соединений данной группы является замена мезо-углеродных мостиков четырьмя атомами азота. Среди веществ этой группы наиболее изученными являются подгруппы фталоцианинов и нафталоцианинов. Фталоцианины представляют собой макроциклические соединения, сопряженные с четырьмя бензольными кольцами, и имеющие максимум поглощения при длине волны 670 нм. Различия в фотохимических свойствах фталоцианинов определяются строением заместительных радикалов, а также типом иона металла в макроцикле.
4) Производные ?-аминолевулиновой кислоты (5-аминолевулиновой кислоты). ?-аминолевулиновая кислота является предшественником и индуктором синтеза эндогенного протопорфирина IX в организме человека. В основе применения этого соединения в фотодинамической терапии и фотодиагностике лежит селективное накопление в клетках эндогенного протопорфирина IX в присутствии экзогенной ?-аминолевулиновой кислоты.
5) Аналоги порфиринов. К аналогам порфиринов относят соединения, которые отличаются от исходного вещества типом сопряжения между пиррольными кольцами. Примером может служить «расширенный» порфирин, мезо-мостики которого заменены на цепочку из трех углеродных атомов. Разновидностью аналогов порфиринов является группа соединений – порфицены.
Ряд классификаций включает также третье поколение фотосенсибилизаторов, представители которого имеют в своем составе радиоактивный радикал, обусловливающий связь молекулы лишь с определенными белковыми носителями и обеспечивающий минимальное накопление вещества в здоровых клетках с высокой специфичностью по отношению к тканям, задействованным в патологическом процессе [5, 12, 19].
Процесс поиска и синтеза новых веществ, обладающих фотохимической активностью и удовлетворяющих требованиям, предъявляемым клинической практикой, продолжается постоянно. Приблизиться к совершенству в этом вопросе пока не удалось и, для применяемых сегодня в стоматологии фотосенсибилизаторов характерны следующие недостатки.
? Сложность производства. Изготовление современных фотосенсибилизаторов является тонким и трудоемким процессом.
? При аппликационном применении фотосенсибилизатора в полости рта эффективность его работы напрямую зависит от колебаний рН среды, количества слюны, крови, десневой жидкости.
? Попытки увеличения интенсивности проникновения фотоактивного агента в ткань за счет повышения его концентрации приводят к росту выраженности токсического эффекта.
? Существует несоответствие между селективностью происходящей фотохимической деструкции и накоплением фотосенсибилизатора в ткани.
? Невысокая фотодинамическая активность.
? Чувствительность к определенной длине волны [9].
Перспективы развития антимикробной фотодинамической терапии
1. Использование в качестве фотосенсибилизаторов эндогенных соединений, локализованных в микробной клетке. Данный принцип позволяет отказаться от использования экзогенных составляющих фотодинамической реакции, соответственно, преодолеть определенные трудности. Пик поглощения эндогенных порфиринов соответствует значению длины волны излучения 405 нм, флавинов – 445 нм. При помощи таких методов, как спектрофотометрия и спектрофлюорофотометрия можно оценить степень насыщенности микробных клеток этими веществами.
2. Прямая генерация синглетного кислорода. Внутриклеточная среда любой клетки содержит растворенный кислород в триплетной форме. Спектральный максимум поглощения его молекул соответствует длинам волн 1273 нм, 1073 нм, 765 нм и 690 нм. При непосредственном облучении микробных клеток излучением с соответствующей длиной волны возможен переход молекулярного кислорода из основного триплетного в синглетное состояние. Главным условием осуществления такой энергетической трансформации является высокий уровень плотности мощности используемого излучения (более 300 мВт/см2).В условиях биологической системы применение указанных параметров излучения приводит к появлению сопутствующего термического эффекта. Избежать неприемлемого нагрева ткани можно, если использовать энергию не в форме непрерывного потока, а в форме дискретных, следующих друг за другом импульсов. В таких условиях удается передать биосубстрату необходимое возбуждение за очень короткое, недостаточное для развития побочных явлений, время.
3. Поиск и создание фотосенсибилизаторов, лишенных указанных недостатков. Это может быть использование известных веществ, обладающих фотохимической активностью, но не применяемых ранее в качестве фотосенсибилизаторов в стоматологии, либо экстрагирование и синтез принципиально новых соединений.
ЛИТЕРАТУРА / REFERENCES
1. Красновский А.А. мл. Фотодинамическая регуляция биологических процессов: первичные механизмы / Проблемы регуляции в биологических системах: Коллект. монография / Под ред. А.Б. Рубина. – Москва-Ижевск, 2006. – С.223–254. / Krasnovsky A.A. ml Photodynamicheskaya regulyacia biologicheskih processov: pervichnie mehanizmy [Photodynamic regulation of biological processes: primary mechanisms]. Problemy regulyacyi v biologicheskih sistemah: collect. monographia. Pod red. A.B. Rubina. Moskva-Izevsk: NIC «Regulyarnaya i chaoticheskaya dynamica», 2006, pp.223–254. (in Russian)
2. КурочкинаА.Ю., ПлавскийВ.Ю., ЮдинаН.А // Медицинскийжурнал. – 2010. – №2. – С.131–133. / Kurochkina A.Yu., Plavskii V.Yu., Yudina N.A. Klassificaciya fotosensibilizatorov antimicrobnoy fotodinamicheskoi terapii zabolevaniy periodonta [Classifications of photosensitizers of antimicrobial photodynamic therapy of periodontal diseases]. Medicinski jurnal, 2010, vol.2, pp.131–133. (in Russian).
3. Миронов А.Ф. // Российскийхимическийжурнал. – 2006. – Т.L, №4. – С.61–71. / Mironov A.F. Palladii i porphirini [Palladium and porphyrins]. Rossiiski himicheski jurnal, 2006, vol.L, no.4, pp.61–71. (in Russian)
4. ПальчунВ.Т. // Вестникоториноларингологии. – 2007. – №3. – С.4–6. / Palchun V.T., Lapchenko A.S., Lapchenko A.A. i dr. Sovremenni vzglyad na antimicrobnuyu photodynamicheskuyu terapiyu [A modern view of antimicrobial photodynamic therapy]. Vestnik otorinolaringologii, 2007, vol.4, pp.4–6. (in Russian)
5. ПоповаА.Е., Крихели Н.И. // Российскаястоматология. – 2012. – №2. – С.31–37. / Popova A.E., Krikheli N.I. Primenenie photodynamicheskoy terapii v complexnom lechenii hronicheskogo parodontita [The use of photodynamic therapy in the complex treatment of chronic periodontitis]. Rossiyskaya stomatologiya, 2012, vol.2, pp.31–37. (in Russian)
6. Спектрдействияфотосинтеза // Википедия [2019–2019]. Дата обновления: 23.09.2019. (дата обращения: 23.09.2019). / The spectrum of photosynthesis. Wikipedia [2019–2019]. Update date: 09/23/2019. (accessed: 09/23/2019). (in Russian)
7. Странадко Е.Ф., Корабоев У.М., Толстых М.П. // Хирургия. – 2000. – №9. – C.67–70. / Stranadko E.F., Koraboev U.M., Tolstykh M.P. Photodynamicheskaya terapiya pri gnoinyh zabolevaniyah myagkih tkaney [Photodynamic therapy for purulent diseases of soft tissues]. Hirurgiya, 2000, vol.9, pp.67–70. (in Russian)
8. Странадко Е.Ф., Кулешов И.Ю., Карханов Г.И. // Лазерная медицина. – 2010. – Т.14, вып.2. – С.52–56. / Stranadko E.F., Kuleshov I.Yu., Karhanov G.I. Photodynamicheskoye vozdeystvie na patogennye microorganizmy (Sovremennoye sostoyanie problemi antimicrobnoi photodynamicheskoi terapii) [Photodynamic effect on pathogenic microorganisms (Current state of the problem of antimicrobial photodynamic therapy)]. Lasernaya medicina, 2010, vol.14, no.2, pp.52–56. (in Russian)
9. Чунихин А.А., Базикян Э.А., Красновский А.А. и др. // Российская стоматология. – 2015. – №2. – С.71–74. / Chunikhin A.A., Bazikyan E.A., Krasnovsky A.A. i dr. Perspectivi sovershenstvovaniya maloinvazivnih lazernih tehnologiy v photodynamicheskoi terapii stomatologicheskih patologiy [Prospects for improving minimally invasive laser technology in the photodynamic therapy of dental pathologies]. Rossiyskaya stomatologiya, 2015, vol.2, pp.71–74. (in Russian)
10. Adams K.R., Berenbaum M.C. Second generation tumor photosensitisers: the synthesis and biological activity of octaalkychlorins and bacteriochlorins with graded amphiphilic character. Bonnet Chem Soc Perkin Trans, 1992, vol.1, pp.1465–1470.
11. Bertoloni G., Sacchetto R., Jori G., Vemon D.I., Brown S.B. Protoporphyrin photosensitisation of enterococcus hirae and Candida albicans cells. Lasers Life Sci, 1993, vol.5, no.4, pp.267–275.
12. Cieplik F., Maisch T., Tabenski L. Antimicrobial photodynamic therapy for inactivation of biofilms formed by oral key pathogens. Frontiers in Microbiology, 2014, vol.5, article 405. – doi: 10.3389/fmicb.2014.00405
13. Dougherty T.J., Gomer C.J., Henderson B.W., et al. Photodynamic therapy. J Nat Cancer Inst, 1998, vol.90, no.12, pp.889–905.
14. Ichinose-Tsuno A., Aoki A., Takeuchi Y., et al. Antimicrobial photodynamic therapy suppresses dental plaque formation in healthy adults: a randomized controlled clinical trial. BMC Oral Health, 2014, vol.14, article 152. – doi:10.1186/1472-6831-14-152
15. Jori G., Roncucci G. Phthalocyanines as PDT agents for the treatment of infections diseases. Papers from the 9-th World Congress of the International Photodynamic Association, Miyazaki, 20–23 May 2003. Tokyo Medical University; ed.: Harubumi Kato. Tokyo, 2003, pp.27.
16. Lacey J., Oldham T.C., Phillips D. The mechanism of the photodynamic action of disulphonated aluminium phtalocyanine and toluidine blue on bacterial cells. Abstr. 7-th Biennial Congress International Photodynamic Association. Nantes-France, 1998, pp.138.
17. Minnock A., Vernon D.I., Schofi eld J., Griffi J., Parish J.H., Brown S.B. Photoinactivation of bacteria. Use of a cationic watersoluble zinc phthalocyanine to photoinactivate both Gram-negative and Gram-positive bacteria. J Photochem Photobiol B: Biol, 1996, vol.32, pp.159–164.
18. Plavskii V.Yu., Mikulich A.V., Tretyakova A.I., Leusenka I.A. et al. Porphyrins and flavins as endogenous acceptors of optical radiation of the blue spectral region determining photoinactivation of microbial cells. Journal of Photochemistry & Photobiology, B: Biology, 2018, vol.183, pp.172–183.
19. Yin R., Jorge A.E.S., Dai T., Melo W. Light based anti-infectives: Ultraviolet C irradiation, photodynamic therapy, blue light, and beyond. Current opinion in Pharmacology, 2013, vol.13, pp.731–762.
20. Soncin M., Fabris C., Busetti A., et al. Photochem Photobiol Sci, 2002, vol.1, pp.815–819.
21. Takasaki A.A., Aoki A., Mizutani K., et al. Application of antimicrobial photodynamic therapy in periodontal and peri-implant diseases. Periodontology 2000, 2009, vol.51, pp.109–140. – doi: 10.1111/j.1600-0757.2009.00302.x
Современная стоматология. – 2020. – №1. – С.11-16.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.