Внимание! Статья адресована врачам-специалистам
Prystrom A.M.
Belarusian Medical Academy of Post-Graduate Education, Minsk
The role of folate in cardiovascular prophylaxis: current status of the problem
Резюме. Обсуждается проблема гипергомоцистеинемии и роль гомоцистеина в развитии сердечно-сосудистых заболеваний. Приведены результаты рандомизированных клинических исследований и мета-анализов по влиянию добавок фолиевой кислоты на сердечно-сосудистые исходы. Поднята проблема генетических нарушений превращения фолиевой кислоты в ее активную форму – 5-метилтетрагидрофолат и возможности коррекции фолатного статуса.
Ключевые слова: гомоцистеин, фолиевая кислота, сердечно-сосудистые заболевания.
Медицинские новости. – 2020. – №4. – С. 37–43.
Summary. This review discusses the problem of hyperhomocysteinemia and the role of homocysteine in the development of cardiovascular diseases. The results of randomized clinical trials and meta-analyzes on the effect of folic acid supplementation on cardiovascular outcomes are presented. The problem of genetic disorders of the conversion of folic acid to its active form, 5-methyltetrahydrofolate, and the possibility of correcting folate status, has been raised.
Keywords: homocysteine, folic acid, cardiovascular disease.
Meditsinskie novosti. – 2020. – N4. – P. 37–43.
В настоящее время наряду с такими классическими факторами риска, способствующими развитию и прогрессированию ишемической болезни сердца (ИБС), как дислипидемия, артериальная гипертензия (АГ), избыточная масса тела, курение, гиподинамия, сахарный диабет (СД), выделены так называемые «новые» факторы риска, к которым, прежде всего, относят увеличение уровня гомоцистеина в крови [4, 56].
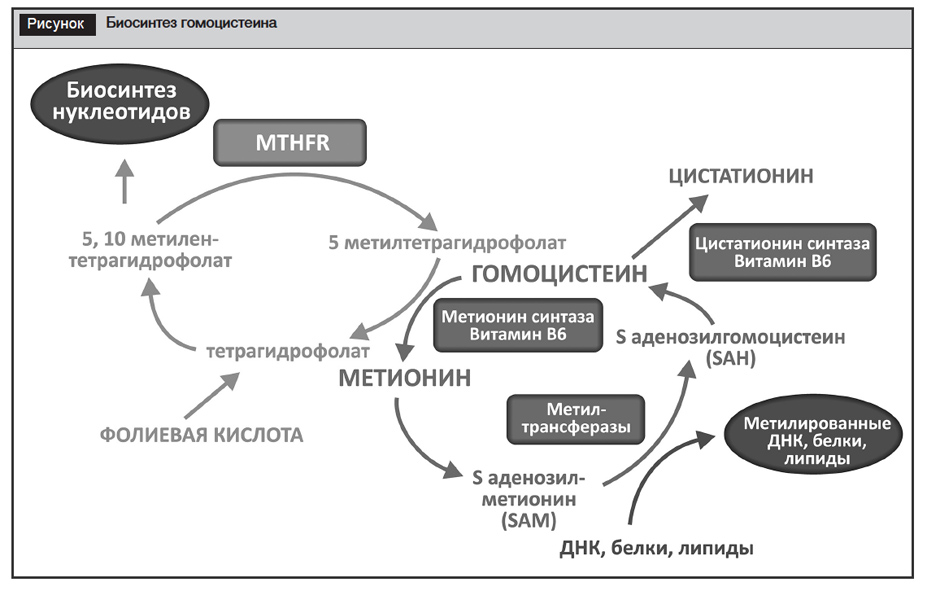
Гомоцистеин (ГЦ) представляет собой сульфгидрилсодержащую аминокислоту, продуцируемую либо за счет переноса сульфатной группы, происходящего в присутствии витамина B6, либо реметилированием, происходящим в присутствии витамина B12 и фолиевой кислоты (ФК) [53], и необходим для внутрисосудистого метаболизма (рисунок). В физиологических условиях ГЦ биосинтезируется из метионина. Для обратного превращения избытка ГЦ в метионин нужны высокие концентрации активной формы ФК (5-метилтетрагидрофолата). При этом превращение ФК в ее активную форму обеспечивается ферментом 5,10-метилентетрагидрофолатредуктаза (MTHFR), а при снижении его активности ГЦ накапливается в организме.
ФК присутствует во многих продуктах – в бобовых, зелени, в том числе листьях салата, яйцах, грибах, дрожжах, мясных субпродуктах. Однако, несмотря на широкую распространенность в природе этого витамина, бóльшая часть (до 90%) разрушается при тепловой обработке. Соединения, синтезируемые микрофлорой толстой кишки, также не вносят существенного вклада в обеспечение организма человека фолатами, поскольку всасывание происходит в вышележащих отделах желудочно-кишечного тракта – двенадцатиперстной и тощей кишках. Термин «фолаты» используется для обозначения всего семейства соединений, в которых птероевая кислота связана с одной или более молекулами L-глутамата.
Метаболизм фолатов служит одним из звеньев одноуглеродного обмена, включающего несколько связанных между собой биохимических циклов, основное предназначение которых – перенос метильных групп с одних субстанций на другие. В качестве субстрата для этого процесса в организме служат поступающие с пищей фолаты, которые в печени быстро восстанавливаются до тетрагидрофолата. 5,10-метилентетрагидрофолат идет на биосинтез нуклеотидов, необходимых для построения ДНК и РНК. 5-метилтетрагидрофолат – важный источник метильных групп для превращения неоптимального с точки зрения физиологии ГЦ в защитный метионин. Благодаря последнему процессу происходит утилизация ГЦ, который в больших концентрациях обладает рядом токсических эффектов на клеточном и тканевом уровне. Метионин же – полезная субстанция, которая выступает донором метильных групп для ДНК, белков и липидов. Реакции метилирования с участием метионина обеспечивают защиту ДНК от мутаций и нормализацию работы генетического аппарата, синтез ферментов в клетке и других белковых молекул [2].
Правильный цикл обмена фолатов и сопряженных с ним клеточных процессов возможен только при достаточном поступ-лении с пищей ФК, а также витаминов В6 и В12. Не менее важное условие – полноценное функционирование всех ферментов, осуществляющих вышеописанные превращения.
Нормальные уровни фолатов в плазме составляют 5–20 мкг/л. Этот показатель колеблется в зависимости от приемов пищи и не позволяет точно оценить фолатный статус. Более достоверным способом считают определение уровня фолатов в эритроцитах, где их содержание выше приблизительно в 30 раз. Ежедневная потребность человека в этих веществах, основным хранилищем которых служит печень, составляет 0,2 мг, а их запас в организме равен 5–10 мг.
ГЦ был открыт в 1933 году, а в 1955 году Винсент дю Виньо за свои работы получил Нобелевскую премию по химии. После его открытия ГЦ стали рассматривать в качестве вероятного фактора риска развития процессов атеросклеротического поражения сосудов, приводящего к сердечно-сосудистым заболеваниям (ССЗ) и инсульту [57].
Накопленные данные эпидемиологических исследований показали, что люди с уровнем ГЦ в крови ≥16 мкмоль/л имели повышенный риск развития ССЗ, а снижение его уровня на 25% было связано с понижением риска развития ИБС на 11% и риска инсульта – на 19% [43]. Это привело к разработке руководств по скринингу и лечению гипергомоцистеинемии при лечении ИБС в США и Канаде [13, 54]. Кроме того, поскольку ФК и витамины B6 и В12 необходимы в качестве субстрата для метаболизма ГЦ, низкий уровень ФК и витаминов группы B в крови может привести к повышению уровня ГЦ в крови и наоборот. По этой причине Управление по контролю за продуктами и лекарствами США в 1996 году рекомендовало обогащать все мучные продукты 140 мкг ФК / 100 г муки [50]. После обогащения муки ФК некоторые проспективные исследования показали либо более слабую связь ГЦ с ССЗ, либо не нашли ее вообще [24].
В норме уровень ГЦ в крови составляет 5–15 мкмоль/л, более высокие его значения обозначаются термином гипергомоцистеинемия [12]. Выделяется три степени гипергомоцистеинемии: умеренная (15–30 мкмоль/л), промежуточная (30–100 мкмоль/л) и тяжелая (более 100 мкмоль/л) [66]. С возрастом уровень ГЦ постепенно возрастает, причем у женщин скорость этого нарастания выше, чем у мужчин.
Повышение уровня ГЦ происходит под влиянием таких факторов риска, как курение, злоупотребление алкоголем, малоподвижный образ жизни. Гипергомоцистеинемия развивается при нарушении функции почек, заболеваниях щитовидной железы, СД, псориазе, системной красной волчанке, лейкозах, злокачественных новообразованиях [29]. Одной из главных причин витаминодефицитных состояний, приводящих к гипергомоцистеинемии, являются заболевания желудочно-кишечного тракта, сопровождающиеся нарушением всасывания витаминов (синдром мальабсорбции). Кроме того, на уровень ГЦ влияет прием лекарств, таких как метотрексат, противосудорожные препараты, метформин и антагонисты H2-рецепторов, эуфиллин.
Под влиянием классических факторов риска (курение, систолическое артериальное давление (АД), избыточный вес и гиперхолестеринемия) запускается процесс окислительного стресса – процесса, заключающегося во внутриклеточном накоплении свободных радикалов и повреждающих структуру и функцию эндотелиоцитов, что лежит в основе развития эндотелиальной дисфункции. Как известно, последняя является наиболее значимым механизмом развития ИБС, АГ и других ССЗ, в основе которых лежит атеросклероз. В ряде исследований было продемонстрировано, что сывороточный ГЦ активирует пролиферацию гладкомышечных сосудистых клеток и снижает уровень оксида азота, ингибируя NO-синтетазу [33, 64].
Установлена связь между высоким значением ГЦ в плазме и возникновением инфаркта миокарда (ИМ), а также смерти от ИБС [1, 63, 68], высокой частотой развития рестенозов коронарных артерий после выполнения ангиопластики [3]. Плазменный уровень ГЦ у пациентов с ИМ с подъемом сегмента ST коррелировал с частотой развития сердечно-сосудистых событий [17]. В ряде исследований была найдена связь между тяжестью ИБС и гипергомоцистеинемией. Уровень ГЦ был выше при трехсосудистом поражении коронарных артерий по сравнению с однососудистым [46]. ГЦ сильно коррелировал с тяжестью ИБС [18, 73].
Гипергомоцистеинемия ассоциирована с высоким риском развития АГ [45], ведет к увеличению риска возникновения венозных тромбозов [5, 58]. Гипергомоцистеинемия у пожилых пациентов с острым коронарным синдромом (ОКС) проявила себя как важный предиктор смертности от всех причин и больших сердечно-сосудистых событий [49].
Гипергомоцистеинемия также является независимым фактором риска развития хронической болезни почек (ХБП). Было показано, что у пациентов с ХБП гипергомоцистеинемия встречалась статистически значимо чаще по сравнению со здоровыми лицами [42], уровень ГЦ отрицательно коррелировал с расчетной скоростью клубочковой фильтрации и положительно – с риском ХБП [32]. Анализ, включающий 13 693 человек из Национального обследования здоровья и питания (NHANES) 1999–2006, продемонстрировал, что АГ и гипергомоцистеинемия могут действовать синергически в направлении большего повреждения почек, чем сумма их независимых эффектов [67].
Таким образом, гипергомоцистеинемия оказывает неблагоприятное влияние на механизмы, участвующие в регуляции сосудистого тонуса, обмена липидов и коагуляционного каскада [9].
Наряду с ССЗ дефицит фолатов играет заметную роль в развитии колоректального рака [21], рака молочной железы [35], меланомы [37], раковых и предраковых состояний шейки матки [41], рака яичников [51], плоскоклеточного рака пищевода [65], а также рака легких [8].
Фолатный дефицит ассоциирован с рядом психических нарушений. Очевидно, функции нейроглии требуют быстрого клеточного обновления, что невозможно в условиях недостатка ФК. Обнаружено, что тяжесть и длительность депрессии значимо связаны с концентрацией фолатов в сыворотке крови [52]. Пациенты с низким содержанием фолатов плазмы крови чаще оказываются нон-респондерами при лечении антидепрессантами по сравнению с теми, у кого изначально этот показатель выше [72].
В 2007 году были опубликованы результаты более чем 40-летнего исследования, которые показали, что внутриутробные нарушения фолатного обмена служат главным фактором, формирующим предрасположенность к развитию шизофрении [31]. Систематический обзор ретроспективных исследований показал, что гипергомоцистеинемия увеличивает риск развития болезни Альц-геймера и старческого слабоумия [71].
Предпринимаемые попытки повлиять на синтез ГЦ применением различных витаминов продемонстрировали неоднозначные результаты. В исследовании Alpha-Tocopherol, Beta Carotene Cancer Prevention Study [70] прием витамина Е, В6 (по 50 мг/сутки) лишь незначительно снижал смертность от ИБС (снижение относительного риска составило 5%), но повышал смертность от рака и геморрагического инсульта на 2% (хотя это повышение было статистически незначимым). Среди принимавших каротин через 5 лет наблюдения отмечено больше случаев смерти от рака легких, ИБС, ишемического и геморрагического инсульта; все это способствовало увеличению общей смертности на 8%.
В двойном слепом плацебо-контролируемом испытании Beta Carotene and Retinol Efficacy Trial, включавшем более 18 000 участников, оценивалась эффективность ежедневного приема каротина (по 30 мг) и ретинила пальмитата (по 25 000 МЕ); в группе каротина отмечена большая частота развития рака легких и смерти от этого заболевания [61]. В исследовании Physicians’ Health Study прием каротина (по 50 мг через день) не влиял на частоту развития злокачественных опухолей и ИБС, а также на уровень общей смертности [62].
В то же время имеются многочисленные данные, указывающие на гомоцистеин как на независимый модифицируемый фактор риска развития ССЗ [48]. Так, в ряде исследований и наблюдений было показано влияние добавления ФК на сердечно-сосудистые исходы в качестве первичной профилактики. Несколько проспективных рандомизированных плацебо-контролируемых исследований продемонстрировали связь гипергомоцистеинемии с повышенной частотой ССЗ и инсульта, а также снижение с помощью ФК и витаминов группы В уровня ГЦ и частоты этих осложнений. В проспективном совместном когортном исследовании R. Cui и соавт. [19] изучалось протективное влияние лечения ФК и витаминами B6 и B12 у 23 119 японских мужчин и 35 611 японских женщин в возрасте 40–79 лет. В течение 14-летнего наблюдения была обнаружена значимая обратная связь между самым высоким и самым низким уровнями ФК и смертностью от сердечной недостаточности у мужчин (ОР 0,50 (95% ДИ 0,27–0,94), р=0,03) и ИБС у женщин (ОР 0,57 (95% ДИ 0,34–0,96), р=0,03). Z.M. Wang и соавт. [40] проанализировали первичные профилактические эффекты приема ФК при ИБС в 14 проспективных исследованиях, включающих 223 691 человека в возрасте от 25 до 79 лет. После 10,7 года наблюдения они обнаружили обратную зависимость между наибольшим потреблением ФК (200 мкмоль/день) и частотой ИБС (ОР 0,88 (95% ДИ 0,82–0,94)). В другом мета-анализе 19 рандомизированных контролируемых исследований (РКИ) с участием 47 921 пациента Т. Huang и соавт. [59] после трехлетнего приема ФК и витаминов группы В не было выявлено различий в частоте сердечно-сосудистых событий по сравнению с плацебо. В мета-анализе 9 РКИ с участием 8 234 пациентов в возрасте 49–72 лет с ХБП и гипергомоцистеинемией Х. Qin и соавт. [47] установили, что снижение уровня ГЦ было связано с 10% снижением ССЗ (ОР 0,90 (95% ДИ 0,81–1,00), р=0,046). Более значительное снижение ССЗ наблюдалось в исследованиях без обогащения зерна ФК (ОР 0,82 (95% ДИ 0,70–0,96), р=0,01), с более низкой распространенностью СД 2-го типа (ОР 0,80 (95% ДИ 0,65–0,99), р=0,04) и у пациентов с ХБП (ОР 0,85 (95% ДИ 0,77–0,94), р=0,002). Y. Huo и соавт. [23] в крупном РКИ по изучению инсульта (CSPPT) у 20 702 пациентов с гипергомоцистеинемией и АГ в возрасте 60 лет исследовали влияние ГЦ на снижение АД и профилактику инсульта. Пациенты были рандомизированы в группы принимающих ФК 0,8 мг плюс эналаприл 10 мг/сутки и принимающих только эналаприл 10 мг/сутки. В течение 4,5 лет частота возникновения первого инсульта составила 2,7% в 1-й группе и 3,4% – во 2-й группе (ОР 0,79 (95% ДИ 0,68–0,93)). Кроме того, в 1-й группе смертность от ССЗ, ИМ и инсульта была ниже по сравнению с таковой во 2-й группе (3,1% и 3,9%, ОР 0,80 (95% ДИ 0,69–0,92)). Y. Li и соавт. [38] проанализировали первичные профилактические эффекты добавок ФК на риск возникновения ССЗ в мета-анализе 30 РКИ с участием 82 334 пациентов в возрасте 49–69 лет. Исходный уровень ГЦ в плазме колебался в пределах 9,8–50,3 мкмоль/л, а доза ФК составляла 0,8–40 мг/сутки. В течение 7 лет наблюдения добавки ФК по сравнению с контролем снизили риск развития инсульта (ОР 0,90 (95% ДИ 0,84–0,96), р=0,002), ИБС (ОР 1,04 (95% ДИ 0,99–1,09), р=0,16) и любых ССЗ (ОР 0,96 (95% ДИ 0,92–0,99), р=0,02).
Кроме того, имеются исследования по применению ФК с целью вторичной профилактики. В мета-анализе J.H. Park и соавт. [20] проанализировали вторичные протективные эффекты ФК и витаминов группы В на ССЗ и профилактику инсульта в трех РКИ (4 643 пациента высокого риска). В исследовании VISP оценивались эффекты снижения ГЦ ФК плюс витаминами B6 и B12 в профилактике инсульта у 1 773 человек в возрасте старше 35 лет в течение 2 лет наблюдения. В исследовании VITATORS оценивались профилактические эффекты ФК и витаминов группы В на частоту возникновения инсульта, ИМ или сосудистой смерти у 1 463 пациентов с недавним инсультом или транзиторной ишемической атакой в течение 3 лет наблюдения по сравнению с плацебо. В исследовании HOPE -2 оценивали, снижают ли ФК, витамины B6 и B12 риск смерти от сердечно-сосудистых причин, ИМ или инсульта у 1 407 пациентов в возрасте старше 55 лет с предшествующей ИБС, цереброваскулярным заболеванием или болезнью периферических сосудов. Во всех исследованиях в группе, получавшей лечение, частота рецидивов была ниже, чем в контрольной группе (ОР 0,86 (95% ДИ 0,62–1,19) в VISP, ОР 0,65 (95% ДИ 0,46–0,91) в VITATORS и ОР 0,60 (95% ДИ 0,39–0,92) в HOPE -2), с общим снижением риска на 29% (ОР 0,71 (95% ДИ 0,58–0,88)). W.W. Wang и соавт. [7] проанализировали влияние ФК в 65 РКИ с участием 7 887 пациентов в возрасте 35–73 лет с АГ и гипергомоцистенемией, принимающих антигипертензивные препараты. В 49 исследованиях 5 707 пациентов были рандомизированы в группы ФК + антигипертензивная терапия и только антигипертензивная терапия. Комбинированная терапия привела к значительному снижению АД (средневзвешенная разница (СВР) -7,85 (95% ДИ от -9,43 до -6,27, р<0,0001 для систолического АД и СВР -6,77 (95% ДИ от -8,55 до -5,00, р<0,0001 для диастолического АД), а также значимому снижению риска сердечно-сосудистых и цереброваскулярных событий на 12,9% по сравнению с только антигипертензивной терапией. Наилучшие положительные эффекты от приема ФК наблюдались в РКИ с продолжительностью лечения более 12 недель (ОР 0,31 (ДИ 95% 0,22–0,43)) и не зависели от снижения АД. В мета-анализе Т. Tan и соавт. [39] изучили влияние добавок ФК ± витамины группы B на профилактику инсульта в 11 РКИ с участием 65 790 пациентов с ССЗ в возрасте 50–69 лет. После периода наблюдения от 1 до 7 лет частота инсульта была значительно ниже у пациентов с ранее существовавшим ССЗ (ОР 0,90 (95% ДИ 0,84–0,97), р=0,005). Эффект был больше при снижении уровня ГЦ в крови ≥25% (ОР 0,85 (95% ДИ 0,74–0,97), р=0,03), а также в популяциях без или с частично обогащенными ФК зернами (ОР 0,87 (95% ДИ 0,81–0,94), р=0,04).
В то же время есть исследования, демонстрирующие отсутствие связи ГЦ с ССЗ и инсультом. Так, в РКИ из 12 064 выживших после ИМ [27] лечение ФК 2 мг/сутки + витамин B12 1 мг/сутки привело к снижению ГЦ по сравнению с плацебо на 3,8 мкмоль (28%), но не привело к значительным различиям в сосудистых событиях (25,5%) по сравнению с плацебо (24,8%) через 6,7 года наблюдения (ОР 1,04 (95% ДИ 0,97–1,12), р=0,28). Также не было различий между приемом ФК с витамином B12 и плацебо в частоте развития крупных коронарных событий (ОР 1,05 (95% ДИ 097–1,13)), инсульта (ОР 1,02 (95% ДИ 0,86–1,21)), коронарной реваскуляризации (ОР 1,18 (95% ДИ 0,95–1,46)) и числа случаев смерти от ССЗ. М. Ebbing и соавт. [16] изучали влияние снижения уровня ГЦ с помощью ФК на основные неблагоприятные сердечно-сосудистые события (MACE), сердечно-сосудистую смерть, ИМ или инсульт в двух норвежских РКИ (Norwegian Vitamin Trial и Western Norway B Vitamin Intervention Trial (WENBIT)) с участием 6 837 пациентов. Добавка ФК и витамина B12 по сравнению с отсутствием лечения снизила уровень ГЦ на 25%, но не повлияла на частоту MACE (ОР 1,07 (95% ДИ 0,95–1,21)) в течение последующих 3,3 года или смертность от ССЗ (ОР 1,12 (95% ДИ 0,95–1,31)) в течение 6,5 лет. Кроме того, K.H. Loland и соавт. [25] исследовали влияние ФК плюс витамины B6 и B12 на ангиографическое развитие ИБС. Через 10,5 месяца у лиц в возрасте 60 лет из 348 проанализированных коронарных ангиограмм у 309 было показано значительное уменьшение минимального диаметра просвета (-0,16±0,4 мм) и увеличение диаметра стеноза на 4,4±0,7%. Лечение ФК с витаминами группы В не влияло на прогрессирование артериального стеноза или минимального диаметра просвета сосуда.
Отсутствие влияния ФК на частоту сердечно-сосудистых событий было продемонстрировано и в ряде мета-анализов. R. Clark и соавт. [28] проанализировали влияние добавок ФК на сердечно-сосудистые события в 8 РКИ с участием 37 485 пациентов с высоким риском ССЗ (средний возраст составил 65±10 лет) и средним исходным уровнем ГЦ 12,3 мкмоль/л. После 5 лет наблюдения у мужчин было 3 900 MACE (1 528 инсультов, 5 068 реваскуляризаций, 5 125 смертей). Терапия ФК 0,8–5 мг/сутки привела к снижению уровня ГЦ на 25% без значительного снижения сосудистых исходов (ОР 1,01 (95% ДИ 0,97–1,05)), MACE (ОР 1,03 (95% ДИ 0,97–1,10)), инсультов (ОР 0,96 (95% ДИ 0,87–1,06)), общей смертности (ОР 1,02 (95% ДИ 0,97–1,08)). В другом мета-анализе W. Mei и соавт. [24] проанализировали результаты снижения уровня ГЦ с добавкой ФК и витаминов группы B на сердечно-сосудистые события в 17 РКИ с участием 39 107 пациентов в возрасте 52–69 лет с перенесенным ССЗ. Анализ результатов показал, что добавление ФК и витаминов группы B не оказывало значительного влияния на частоту повторных сердечно-сосудистых или цереброваскулярных исходов по сравнению с таковой в контрольной группе: ОР 1,01 (95% ДИ 0,97–1,05) для сердечно-сосудистых событий, ОР 1,01 (95% ДИ 0,94–1,07) для ИБС, ОР 0,94 (95% ДИ 0,85–1,04) для инсульта и ОР 1,00 (95% ДИ 0,95–1,05) для смертности от всех причин. В другом обзоре, Y.H. Zhou и соавт. [22], были проанализированы сердечно-сосудистые профилактические эффекты приема ФК в 16 РКИ с участием 44 841 пациента в возрасте 49–69 лет по сравнению с плацебо. Всего было 8 238 случаев сердечно-сосудистых событий, из которых 2 001 были инсульты, 2 917 – ИМ и 6 314 летальных исходов. Прием ФК по сравнению с плацебо приводил к незначительным различиям по частоте серьезных сердечно-сосудистых событий (ОР 0,98 (95% ДИ 0,93–1,04)), инсультов (ОР 0,89 (95% ДИ 0,78–1,01)), ИМ (ОР 1,00 (95% ДИ 0,93–1,07)) или смерти от любой причины (ОР 1,00 (95% ДИ 0,96–1,05)). Кроме того, не было установлено никакого влияния на вторичные исходы, такие как реваскуляризация, ОКС или сосудистые и несосудистые смерти. В другом мета-анализе 13 РКИ 39 005 пациентов в возрасте 54–69 лет М. Lee и соавт. [26] проанализировали влияние лечения ФК на профилактику инсультов в течение среднего периода наблюдения 3,7 года. Применение ФК не предотвращало частоту развития инсультов (ОР 0,93 (95% ДИ 0,85–1,03), р=0,16). M.J. Jardine и соавт. [69] в 11 РКИ с участием 10 951 пациента в возрасте 49–72 лет с ХБП с СКФ <60 мл/мин, лечение ФК в дозе от 2,5 до 40 мг/сутки не оказало значительного эффекта в профилактике сердечно-сосудистых событий (ОР 0,97 (95% ДИ 0,92–1,03), р=0,33) или на вторичные исходы, такие как смертность от ССЗ (ОР 0,97 (95% ДИ 0,82–1,16)), смертность от всех причин (ОР 1,02 (95% ДИ 0,95–1,10)), ИМ (ОР 0,96 (95% ДИ 0,84–1,11)), инсульт (ОР 0,95 (95% ДИ 0,75–1,21)), профилактика прогрессирования ХБП (ОР 1,05 (95% ДИ 0,95–1,16)). A.J. Marti-Carvajal и соавт. [55] проанализировали данные 15 РКИ с участием 71 422 пациентов с высоким уровнем ГЦ в отношении его влияния на частоту развития сердечно-сосудистых событий и инсультов у пациентов с или без существующих ССЗ. Анализ данных показал, что после 1–7,3 года наблюдения не было выявлено различий между снижением уровня ГЦ и плацебо в отношении частоты ИМ (ОР 1,02 (95% ДИ 0,95–1,10)) или MACE (ОР 1,07 (95% ДИ 1,00–1,14)), за исключением инсульта, который был снижен на 10% (ОР 0,90 (95% ДИ 0,82–1,06)).
В настоящее время существует много противоречивых мнений относительно связи ГЦ с истинной частотой ССЗ или является ли эта связь случайной [15]. Сегодня многие исследователи предлагают рассматривать ГЦ как фактор риска ССЗ и ИБС, поскольку только 50% этих заболеваний могут быть объяснены классическими Фрамингемскими факторами риска (дислипидемия, АГ, СД и курение), и они предлагают добавить дополнительные факторы риска к Фрамингемским, чтобы повысить их прогностическую ценность [34]. Патогенетические механизмы неблагоприятных сердечно-сосудистых событий ГЦ объясняются увеличением пролиферации клеток гладких мышц сосудов, эндотелиальной дисфункцией, окислительным повреждением, увеличением синтеза коллагена и ухудшением эластичности материала артериальной стенки [11]. По рекомендациям Американской коллегии кардиологов/Американской ассоциации сердца тощаковый уровень ГЦ, превышающий 12,1 мкмоль/л, связан с 2-кратным повышенным риском развития атеросклеротических сосудистых заболеваний, включая ИБС и инсульт, независимо от традиционных факторов риска [6]. В настоящее время нет достаточных доказательств того, что снижение уровня ГЦ за счет дополнительного применения ФК может снизить риск ССЗ, инсульт и смертность. Поэтому добавки ФК необязательны для первичной или вторичной профилактики ССЗ и инсульта. Подобные рекомендации, очевидно, связаны с тем, что большинство этих исследований проводились в странах, где пищевые продукты обогащались ФК. В то же время, в мета-анализе 13 РКИ с участием 65 812 субъектов из стран, не имеющих обогащения ФК пищи, C.Y. Hsu и соавт. [36] обнаружили, что добавка ФК была связана с более низким риском частоты развития инсультов в будущем (ОР 0,85 (95 % ДИ 0,77–0,95)), а профилактика инсульта при лечении ФК зависела от процента снижения уровня ГЦ. Аналогичные результаты были сообщены М. Zhao и соавт. [60] в мета-анализе 22 исследований, в которых участвовали 82 723 человека из стран, в которых была добавлена или не была добавлена ФК. У субъектов без добавок ФК частота инсульта была выше (ОР 0,85 (95% ДИ 0,77–0,94)) по сравнению со странами с обогащением пищи ФК, где частота инсульта была значительно ниже (ОР 1,05 (95% ДИ 0,90–1,23)). Что касается величины снижения уровня ГЦ, Х. Huang и соавт. [10] продемонстрировали на основе анализа результатов 16 867 участников исследования CSPPT, получавших ФК, частота инсультов зависела от процента снижения уровня ГЦ. После медианного периода наблюдения в 4,5 года участники, у которых развился первый инсульт, имели значительно более низкий процент снижения общего ГЦ, чем их аналоги. Общее снижение ГЦ на 20% было связано со снижением риска возникновения инсульта на 7% (ОР 0,93 (95% ДИ 0,90–0,97)). Аналогичные результаты наблюдались для совокупности сердечно-сосудистых событий (сердечно-сосудистая смерть, ИМ, инсульт). Что касается дозы ФК, то не установлено оптимальной дозы применяемой ФК для достижения наиболее низкого уровня ГЦ, но ее снижение до ≤10 мкмоль/л будет полезно для предотвращения возникновения инсульта [44]. Что касается дозы ФК, то в настоящее время нет конкретной дозы, поскольку ФК вводилась в дозах от 0,8 до 40 мг/сутки. Доза 0,8–1,0 мг/сутки представляется разумной.
К настоящему времени обнаружен ряд точечных мутаций генов, кодирующих ферменты фолатного цикла и, как следствие, снижающих эффективность биохимических процессов усвоения ФК. К таким мутациям относят, например, точечную замену нуклеотида цитозина на тимидин в позиции 677-го гена, кодирующего фермент MTHFR. Если у индивида в обоих аллелях этого гена присутствует вышеописанная замена, то его называют гомозиготным носителем мутации, имеющим генотип MTHFR 677TT; при этом эффективность работы фермента MTHFR снижена до 60% от нормы – он не выполняет свою прямую функцию, и ФК не трансформируется в 5-метилтетрагидрофолат.
Известно, что от 10 до 25% в общей популяции (в зависимости от национальной принадлежности) – носители генотипа MTHFR 677TT (гомозиготны), тогда как около 40% – гетерозиготные носители мутантного аллеля [14].
Последствия гомозиготного носительства выражаются в том, что процесс восстановления ГЦ в метионин нарушается – накапливаются избытки неоптимального ГЦ, а метионин образуется в недостаточных количествах. Обладая выраженным токсическим, атерогенным и тромбофилическим действием, избыточный ГЦ увеличивает риск развития ССЗ, онкологических болезней и нервно-психических расстройств, обусловливает осложнения беременности, дефекты развития плода.
Наиболее правильным решением проблемы дефектных ферментов фолатного цикла стала идея вводить в организм не ФК, а непосредственно ее активный метаболит – 5-метилтетрагидрофолат. Это вещество в виде L-метилфолата кальция стали применять в качестве пищевой добавки, эффективно восстанавливая концентрацию фолатов в крови. С учетом высокого показателя распространенности генетических полиморфизмов MTHFR у населения с целью профилактики и лечения различных состояний, связанных с дефицитом фолатов во время и вне беременности, целесообразно применять препараты, содержащие именно L-метилфолат.
Биологически активные формы ФК давно применяются в мировой клинической практике. В аптеках Республики Беларусь список официально зарегистрированных и доступных в продаже фолатов пополнил препарат L-метилфолата в дозе 400 мкг под торговым название «Лефол», английской компании «Ламира». Рекомендуемая доза приема 1–2 раза в сутки, длительность терапии определяется индивидуально.
Внедрение в клиническую практику L-метилфолата (Лефол) расширяет и дополняет технологические возможности коррекции гипергомоцистеинемии, восстановления фолатного статуса и профилактики многочисленных осложнений, в том числе у пациентов, которые не имеют генетической возможности качественного метаболизма ФК.
Выводы:
1. Гомоцистеин является признаком нездорового образа жизни и в совокупности с классическими факторами существенно повышает риск развития ССЗ.
2. Несмотря на то, что снижение уровня гомоцистеина в крови с помощью фолиевой кислоты, а также витаминов В6 и В12, до сих пор остается открытым, их применение в регионах, где не проводится обогащения фолиевой кислотой продуктов питания, показало весьма убедительные результаты снижения сердечно-сосудистого риска.
3. На фоне высокой частоты встречаемости гомозиготного носительства генотипа MTHFR наиболее целесообразно дополнительное применение активного метаболита фолиевой кислоты – 5-метилтетрагидрофолата.
Л И Т Е Р А Т У Р А
1. Баранова Е.И., Большакова О.О. // Артериальная гипертензия. – 2004. – №10. – C.85–87.
2. Касимова Л.Н., Жиляева Т.В. // Практическая медицина. – 2012. – №2.
3. Мухин Н.А., Моисеев С.В., Фомин В.В. // Клиническая медицина. – 2001. – №6. – C.7–13.
4. Скворцов Ю.И., Королькова А.С. // Саратовский научно-медицинский журнал. – 2011. – Т.7, №3. – С.619–624.
5. Шевченко О.П., Олефриенко Г.А. // Лаборатория. – 2002. – №1. – C.3–7.
6. ACC/AHA 2005 practice guidelines for the management of patients with peripheral arterial disease (lower extremity. renal, mesenteric, and abdominal aortic) / A.T. Hirsch [et al.] // Circulation. – 2006. – Vol.113. – e463–e654.
7. A meta-analysis of folic acid in combination with antihypertension drugs in patients with hypertension and hyperhomocysteinemia / W.W. Wang [et al.] // Front Pharmacol. – 2017. – Vol.8. – P.585
8. An open-label, multicenter, randomized, phase II study of pazopanib in combination with pemetrexed in first-line treatment of patients with advanced-stage non-small-cell lung cancer / G.V. Scagliotti [et al.] // J. Thorac. Oncol. – 2013. – Vol.8, N12. – P.1529–1537.
9. Arnadottir M. Homocysteine in renal disease, in Homocysteine in health and disease. – Cambridge, UK, 2001. – P.321–330.
10. Association between percent decline in serum total homocysteine and risk of first stroke / X. Huang [et al.] // Neurology. – 2017. – Vol.89. – P.2101–2107.
11. Association between serum homocysteine and arterial stiffness in elderly: a community-based study / S. Zhang [et al.] // J. Geriatr. Cardiol. – 2014. – Vol.11. – P.32–38.
12. Bonitton-Kopp С. // Kopp. Ibid. – 1993. – Vol.24. – P.1837–1843.
13. Booth G.L., Wang E.E. // CMAJ. – 2000. – Vol.163. – P.21–29.
14. Caso V., Paciaroni M. // J. Neurol. Neurosurg. Psychiatry. – 2006. – Vol.77, N10. – P.1103
15. Chrysant S.G., Chrysant G.S. // Exp. Rev. Cardiovasc. Ther. – 2018. – doi:10.1080/14779072.2018.1497974
16. Combined analyses and extended follow-up of two randomized controlled homocysteine-lowering B-vitamin trials / M. Ebbing [et al.] // J. Intern. Med. – 2010. – Vol.268. – P.367–382.
17. Correlation between hyperhomocysteinemia and outcomes of patients with acutemyocardial infarction / Y. Ma [et al.] // Am. J. Ther. – 2016. – Vol.23. – e1464–e1468.
18. Correlation of serum homocysteine levels with the severity of coronary artery disease / V. Shenoy [et al.] // Indian J. Clin. Biochem. – 2014. – Vol.29. – P.339–344.
19. Dietary folate and vitamin B6, and B12 intake in relation to mortality from cardiovascular diseases. Japan Collaborative Cohort Study / R. Cui [et al.] // Stroke. – 2010. – Vol.41. – P.1285–1289.
20. Effect of B-vitamins on stroke risk among individuals with vascular disease who are not on antiplatelets: A meta-analysis / J.H. Park [et al.] // Int. J. Stroke. – 2016. – Vol.11. – P.206–211.
21. Effect of folate supplementation on mucosal cell proliferation in high risk patients for colon cancer / K. Khosraviani [et al.] // Colorectal Cancer. – 2002. – Vol.51. – P.195–199.
22. Effect of folic acid supplementation on cardiovascular outcomes: a systematic review and meta-analysis / Y.H. Zhou [et al.] // PLoS One. – 2011. – Vol.6. – e25142.
23. Efficacy of folic acid therapy in primary prevention of stroke among adults with hypertension in China. The CSPPT randomized trial / Y. Huo [et al.] // JAMA. – 2015. – Vol.313. – P.1325–1335.
24. Effect of homocysteine interventions on the risk of cardiocerebral events: a meta-analysis of randomised controlled trials / W. Mei [et al.] // Int. J. Clin. Pract. – 2010. – Vol.64. – P.208–215.
25. Effect of homocysteine-lowering B vitamin treatment on angiographic progression of coronary artery disease: A Western Norway B Vitamin Intervention Trial (WENBIT) substudy / K.H. Loland [et al.] // Am. J. Cardiol. – 2010. – Vol.105. – P.1577–1584.
26. Efficacy of homocysteine-lowering therapy with folic acid in stroke prevention. A meta-analysis / M. Lee [et al.] // Stroke. – 2011. – Vol.41. – P.1205–1212.
27. Effects of homocysteine-lowering with folic acid plus vitamin B12 vs placebo on mortality and major morbidity in myocardial infarction survivors: a randomized trial / J.M. Armitage [et al.] // JAMA. – 2010. – Vol.303. – P.2486–2494.
28. Effects of lowering homocysteine levels with B vitamins on cardiovascular disease, cancer and cause-specific mortality / R. Clarke [et al.] // Arch. Intern. Med. – 2010. – Vol.170. – P.1622–1631.
29. Effect of pravastatin on endothelial function in patients with coronary artery disease / A. Masumoto [et al.] // Amer. J. Cardiol. – 2001. – Vol.88. – P.1291–1294.
30. Elevated prenatal homocysteine levels as a risk factor for schizophrenia / A.S. Brown [et al.] // Arch Gen Psychiatry. – 2007. – Vol.64. – №1. – P.31–39.
31. Elevated serum homocysteine is a predictor of accelerated decline in renal function and chronic kidney disease: a historical prospective study / A. Levi [et al.] // I. Eur. J. Intern. Med. – 2014. – Vol.25, N10. – P.951–955.
32. Endothelial nitric oxide synthase gene polymorphism, homocysteine, cholesterol and vascular endothelial function / W. Bilsborough [et al.] // Atherosclerosis. – 2003. – Vol.169. – P.131–138.
33. Faeh D., Chiolero A., Pascaud F. // Swiss Med. Wkly. – 2006. – Vol.136. – P.745–756.
34. Folate, vitamin B(6), and vitamin B(12) intake and the risk of breast cancer among Mexican women / M. Lajous [et al.] // Cancer Epidemiol. Biomarkers Prev. – 2006. – Vol.15, N3. – P.443–448.
35. Folic acid in stroke prevention in countries without mandatory folic acid food fortification: A meta-analysis of randomized controlled trials / C.Y. Hsu [et al.] // J. Stroke. – 2018. – Vol.20. – P.99–109.
36. Folic acid supplementation and cancer risk: A meta-analysis of randomized controlled trials / Q. Xianhui [et al.] // Int. J. Cancer. – 2013. – VC 2013 UICC.
37. Folic acid supplementation and the risk of cardiovascular diseases: A meta-analysis of randomized controlled trials / Y. Li [et al.] // J. Am. Heart Assoc. – 2016. – Vol.5. – e003768.
38. Folic acid supplementation for stroke prevention in patients with cardiovascular disease / T. Tan [et al.] // Am. J. Med. Sci. – 2017. – Vol.354. – P.379–387.
39. Folate and risk of coronary heart disease: a meta-analysis of prospective studies / Z.M. Wang [et al.] // Nutr. Metab. Cardiovasc. Dis. – 2012. – Vol.22. – P.890–899.
40. Folate status and aberrant DNA methylation are associated with HPV infection and cervical pathogenesis / J.E. Flatley [et al.] // Cancer Epidemiol. Biomarkers Prev. – 2009. – Vol.18, N10. – P.2782–2789.
41. High prevalence of hyperhomocysteinemia and its association with target organ damage in Chinese patients with chronic kidney disease / Z. Ye [et al.] // Nutrients. – 2016. – Vol.8, N10. – P.645–656.
42. Homocysteine and risk of ischemic heart disease and stroke: a meta-analysis / R. Clarke [et al.] // JAMA. – 2002. – Vol.288. – P.2015–2022.
43. Homocysteine as a predictor of early neurological deterioration in acute ischemic stroke / H.M. Kwon [et al.] // Stroke. – 2014. – Vol.45. – P.871–873.
44. Homocysteine, endothelial dysfunction and oxidative stress in type 1 diabetes mellitus / F. Wotherspoon [et al.] // Br. J. Diabetes Vasc. Dis. – 2003. – Vol.3. – P.334–340.
45. Homocysteine levels and coronary heart disease in Syria / R. Joubran [et al.] // J. Cardiovasc. Risk. – 1998. – Vol.5. – P.257–261.
46. Homocysteine-lowering therapy with folic acid is effective in cardiovascular disease prevention in patients with kidney disease: A meta-analysis of randomized controlled trials / X. Qin [et al.] // Clin. Nutr. – 2013. – Vol.32. – P.722–727.
47. Hyperhomocysteinemia but not the C677 T mutation of MTHFR is an independent risk determinant of carotid wall thickening / B.M. McQuillan [et al.] // Circulation. – 1999. – Vol.99. – P.2383–2388.
48. Hyperhomocysteinemia is an independent predictor of long-term clinical outcomes in Chinese octogenarians with acute coronary syndrome / Z. Fu [et al.] // Clin. Interv. Aging. – 2015. – Vol.10. – P.1467.
49. Jacques P.F., Selhub J., Bostom A.G. // N. Engl. J. Med. – 1999. – Vol.340. – P.1449–1454.
50. Larsson S.C., Giovannucci E., Wolk A. // J. Natl. Cancer Inst. – 2004. – Vol.96, N5. – P.396–402.
51. Levitt A.J., Joffe R.T. // Biol. Psychiatry. – 1989. – Vol.25. – P.867–872.
52. MacMahon M. // Nutr. Metab. Cardiovasc. Dis. – 2000. – Vol.10. – Р.195–203.
53. Malinow M.R., Bostom A.G., Kraus R.M. // Circulation. – 1999. – Vol.99. – P.178–182.
54. Marti-Carvajal A.J. [et al.] // Cochrane Database Syst. Rev. – 2017. – Vol.8. – CD006612.
55. Mayer E., Jacobsen D., Robinson K. // J. Am. Coll. Cardiol. – 1996. – Р.517–527.
56. McCully K.S., Ragsdale B.D. // Am. J. Pathol. – 1970. – Vol.61. – P.1–11.
57. Mechanisms of homocysteineinduced oxidative stress // N. Tyagi [et al.] / Am. J. Physiol. Heart Circ. Physiol. – 2005. – Vol.289. – H2649–2656.
58. Meta-analysis of B vitamin supplementation on plasma homocysteine, cardiovascular and all-cause mortality / T. Huang [et al.] // Clin. Nutr. – 2012. – Vol.31. – P.448–454.
59. Meta-analysis of folic acid efficacy trials in stroke prevention: insight into effect modifiers / M. Zhao [et al.] // Neurology. – 2017. – Vol.88. – P.1830–1838.
60. 5-methyltetrahydrofolate, the active form of folic acid, restores endothelial function in familial hypercholesterolemia / M.C. Verhaar [et al.] // Circulation. – 1998. – Vol.97. – P.237–241.
61. Normohomocysteinaemia and vitamin B treated hyperhomocysteinaemia are associated with similar risks of cardiovascular events in patients with premature atherothrombotic cerebrovascular disease / E.G. Vermeulen [et al.] A prospective cohort study // Neth. J. Med. – 2000. – Vol.56. – P.138–146.
62. Prospective study of serum homocysteine and risk of ischemic stroke among patients with preexisting coronary heart disease / D. Tanne [et al.] // Stroke. – 2003. – Vol.34. – P.632–636.
63. Role of oxidant stress in endothelial dysfunction produced by experimental hyperhomocysteinemia in humans / P.M. Kanani [et al.] // Circulation. – 1999. – Vol.100. – P.1161–1168.
64. Serum folate, MTHFR C677T polymorphism and esophageal squamous cell carcinoma risk / G.L. Huang [et al.] // Biomed Environ. Sci. – 2013. – Vol.26, N12. – P.1008–1012.
65. Single LDL apheresis improves endothelium-dependent vasodilatation in hypercholesterolemic humans / O. Tamai [et al.] // Circulation. – 1997. – Vol.95. – P.76–82.
66. Synergistic interaction of hypertension and hyperhomocysteinemia on chronic kidney disease: Findings from the National Health and Nutrition Examination Survey 1999–2006 / S. Wenrui [et al.] // J. Clin. Hypertens. – 2019. – Vol.21. – P.1567–1577.
67. Trabetti E. // J. Appl. Genet. – 2008. – Vol.49. – P.267–282.
68. The effect of folic acid based homocysteine lowering on cardiovascular events in people with kidney disease: a systematic review and meta-analysis / M.J. Jardine [et al.] // BMJ. – 2012. – Vol.344. – e3533.
69. Ueland P.M., Refsum H. // J. Lab. Clin. Med. – 1989. – Vol.114. – P.473–501.
70. Van Dam F., Van Gool W.A. // Arch Gerontol. Geriatr. – 2009. – Vol.48, N3. – P.425–430.
71. Wesson V.A., Levitt A.J., Joffe R.T. // Psychiatry Res. – 1994. – Vol.53. – P.313–322.
72. Wu Y., Yang L., Zhong L. // Atherosclerosis. – 2010. – Vol.212. – P.351–355.
Медицинские новости. – 2020. – №4. – С. 37-43.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.