Внимание! Статья адресована врачам-специалистам
DzenisYu.L., SverzickisR.J., DolgopolovaJ.D.
Neurosurgical Clinic, Pauls Stradins Clinical University Hospital, Riga, Latvia
Latvian University, Riga
Dislocation syndrome and brainstem herniation
(review and first experience surgical treatment
for nontraumatical intracerebral haematomas in large hemispheres)
Резюме. В обзоре представлены 5 клинически важнейших вариантов вклинения ствола головного мозга как завершающую стадию дислокационного синдрома. Показаны методики хирургического лечения каждого из вариантов вклинения ствола мозга. Описан первый клинический опыт хирургического лечения пациентов с вклинением ствола мозга при нетравматических внутримозговых гематомах больших полушарий. Для клинической характеристики процесса вклинения ствола мозга предложен индекс дислокационной скорости.
Ключевые слова: дислокационный синдром, вклинение ствола мозга, патофизиологическая и патоморфологическая характеристика, методы лечения.
Медицинские новости. – 2020. – №7. – С. 30–38.
Summary. In this review five types of clinically most important variants of brainstem herniation as the last stage of dislocation syndrome are presented. Methods of surgical treatment for each of herniation type are shown. The first clinical experience of surgical treatment for patients with non traumatical intracerebral haematomas of large hemispheres is reported. The index of dislocation speed for clinical characteristics of the process of brainstem herniation is offered.
Keywords: dislocation syndrome, brainstem herniation, pathophysiological and pathomorphological characteristics, methods of treatments.
Meditsinskie novosti. – 2020. – N7. – P. 30–38.
Доктрина Monro-Kellie определяет равновесие трех основных объемов внутричерепной полости – цереброспинальной жидкости (ЦСЖ), мозговой ткани и сосудистого русла. Ввиду ригидности полости черепа увеличение одного объема вызывает компенсаторное уменьшение другого [52, 66].
Увеличение объема головного мозга за счет развития патологического очага и перифокального отека вызывает нарушение ликвороциркуляции и венозного оттока из полости черепа. Постепенно истощаются компенсаторные возможности перераспределения ЦСЖ в резервных пространствах – субарахноидальном, цистернах и желудочках мозга [3,5,20,39].
При медленном развитии патологического очага признаки перемещения (дислокации) нередко наблюдаются в течение длительного периода за счет внутричерепных резервных пространств. В то же время при быстром увеличении очага имеет место бурная клиническая картина, а компенсаторные возможности резервных пространств так же быстро исчерпывают себя, и болезнь, как правило, завершается летально [3,5,39,84].
Представлен обзор литературы и собственный опыт по основным видам дислокационных синдромов и их конечную стадию – вклинение ствола мозга (ВСМ), а также показаны возможности их комплексного лечения.
Определение дислокационного синдрома
Дислокационный синдром – это комплекс патофизиологических и патоморфологических процессов, сопровождающихся определенными симптомокомплексами, обусловленными смещением полушарий большого мозга с вторичным сдавлением его стволовых отделов. Причиной дислокационного процесса является разница (градиент) внутричерепного давления (ВЧД), складывающаяся в различных полостях краниовертебрального пространства, и процесс ее выравнивания. ВЧД составляет парциальные давления: мозговой ткани, ЦСЖ и интерстициальной жидкости, которые в нормальных условиях соотносятся 2:1:0,1, что нарушается при дислокационном синдроме [5,13,14,20,21,23,43].
Подразделяют два вида дислока-ционных синдромов:
а) простой (неосложненный) – характеризуется отсутствием странгуляционной борозды; обратимыми морфологическими изменениями мозга и полным функциональным восстановлением; начальным этапом сложного дислокационного синдрома при быстром регрессе его причины;
б) сложный дислокационный синдром имеет грыжевое вклинение отдельных структур мозга (часто гиппокампа с образованием странгуляционной борозды с формированием мелких точечных или оформленных кровоизлияний в субкортикальные слои в сочетании с ишемией; типичные локализации вклинения в плотных неподатливых анатомических образованиях: область вырезки намета мозжечка, под серп большого мозга и в затылочно-шейную дуральную воронку [13,22].
По клинико-радиологической классификации дислокационныхсиндромовЮ.А. Щербук (1995) выделяет следующие стадии:
а) гипертензионно-дисциркуляторный синдром (общее состояние средней тяжести; смещение прозрачной перегородки не превышает 4 мм и пр.);
б) гипертензионно-дислокационно полушарный синдром (общее состояние тяжелое; смещение прозрачной перегородки составляет 4–9 мм и пр.);
в) гипертензионно-дислокационно стволовой синдром (общее состояние тяжелое или крайне тяжелое; смещение прозрачной перегородки превышает 10 мм и пр.) [24].
Из всего многообразия дислокационных синдромов и ВСМ как завершающую фазу этого процесса клинически выделяют:
1. При супратенториальной локализации:
а) боковой дислокационный синдром под фалькс (субфальцинный);
б) аксиальный дислокационный синдром;
в) височно-тенториальный дислокационный синдром.
2. При субтенториальной локализации:
а) дислокационный синдром мозжечка в шейно-затылочную дуральную воронку (мозжечковый конус вклинения, нижняя дислокация);
б) дислокационный синдром мозжечка в отверстие мозжечкового намета (мозжечково-тенториальное вклинение, верхняя дислокация) [3,13,14,16,43].
Летальность при быстром дислокационном синдроме и ВСМ у большинства авторов остается высокой и в зависимости от уровня угнетения сознания по шкале комы Глазко (ШКГ) может приближаться 100% [3, 5, 13, 16, 39, 77, 85]. Публикации по этой теме малочисленны, а летальность высока, что подтверждает актуальность рассматриваемых вопросов в современной неврологии и нейрохирургии.
Резервные пространства и патофизиология ВСМ
Смещение мозга в ограниченном черепном пространстве было бы невозможным при отсутствии интракраниального резервного пространства. Его составляет подпаутинное пространство с расширением (цистернами), наполненное ЦСЖ, а также наполненная ЦСЖ желудочковая система мозга [3,6,11].
ЦСЖ выполняет амортизирующую, трофическую и защитную функции, постоянно продуцируется сосудистыми сплетениями желудочков (в основном боковых – 80%). Из боковых желудочков ЦСЖ поступает через отверстие Монро в третий желудочек, далее через водопровод мозга в четвертый желудочек, оттуда – через латеральные (Люшке) и медиальные (Мажанди) апертуры проникает в субарахноидальное пространство головного и спинного мозга. Из субарахноидальных цистерн ЦСЖ оттекает вдоль артериальных стволов в субдуральное пространство, где резорбируется через внутреннюю капиллярную сеть и пахионовы грануляции в венозные синусы. При циркуляции ЦСЖ от места продукции до места резорбции обусловлены анатомией ликворных пространств и градиентом ВЧД [2, 6, 7, 15, 26, 30].
Классификация субарахноидальных цистерн отражена в исследованиях M.G. Yasargil (1984) и В.В. Крылова (2011)[11, 93].Супратенториальные цистерны: передней локализации (каротидная, хиазмальная, ольфакторная, цистерна терминальной пластинки, латеральной щели); латеральной или парапедункулярной локализации (ножковая, охватывающаяя); задней (вырезки намета мозжечка) локализации (четверохолмная, цистерна промежуточного мозгового паруса); верхней локализации (цистерна мозолистого тела). Субтенториальные цистерны: передней локализации (межножковая, предмостовая, предмедулярная); латеральной локализации (мостомозжечковая, латеральная мозжечково-медуллярная); задней локализации (большая, верхняя мозжечковая).
Общий объем ЦСЖ у взрослого человека составляет в норме 90–220 мл, в среднем около 150 мл. Желудочки мозга содержат только треть этой величины (около 50 мл). В полости черепа количество ЦСЖ в 3 раза больше, чем в спинальном канале. Ежедневно вырабатывается около 600 мл ЦСЖ, а обновление ее происходит 1–8 раз в сутки. В минуту продуцируется 0,2–0,7 мл, что в среднем составляет около 0,4 мл. Давление ЦСЖ на поясничном уровне лежа на боку составляет 100–180 мм вод. ст. [6, 15, 30, 69].
Как известно, содержание внутричерепной полости: вещество мозга, ЦСЖ, внутриклеточная и внеклеточная жидкости, кровеносная система мозга – суммарно определяют ВЧД. Согласно физиологическим и патофизиологическим условиям, ВЧД как в ликворосодержащих пространствах, так и внутри мозга имеет неравномерный характер распределения. К нормальным показателям ВЧД относят 5–15 мм рт.ст. [12,15,20,62,76,80].
Неотъемлемой составной частью и одной из причин дислокационного синдрома является повышение ВЧД – внутричерепная гипертензия (ВЧГ). Последняя занимает одно из ключевых звеньев в механизме дислокационного синдрома и отражает его степень, в том числе и в цифровых значениях. Степень повышения ВЧД условно подразделяют на умеренную – 20–30 мм рт. ст.; средней тяжести – 31–40 мм рт. ст., выраженную (жизнеугрожающую) – свыше 40 мм рт. ст. В тесной связи с ВЧД находится церебральное перфузионное давление (ЦПД), которое определяется как разница между средним артериальным давлением и ВЧД (АДср. – ВЧД=ЦПД). Эту величину рекомендуют поддерживать выше 60 мм рт. ст. [23,43,62,80].
Определены критические значения клинически значимых ВЧД-градиентов: межполушарный – 10 мм рт. ст. (превышение этой величины несет опасность ВСМ); аналогично (10 мм рт. ст.) и при супраинфратенториальном варианте (превышение грозит ВСМ). При имеющейся ВСМ величина градиента может достичь 30–40 мм рт. ст. [12,31,51,56,75,78].
В заключение следует отметить, что интракраниальные резервные пространства играют основную роль в компенсаторных механизмах при дислокационных синдромах. Данные объема желудочковой системы и цистерн, а также физиология продукции и циркуляции ЦСЖ может быть использована при планировании лечебных мероприятий. Неотъемлемой составной частью дислокационного синдрома является повышенное ВЧД. Клинически важны степень повышения ВЧД, а также его градиенты. Показатели ВЧД служат объективным клиническим критерием в лечебном процессе, особенно у пациентов в глубокой коме.
Патоморфология ВСМ
Боковой дислокационный синдром под фалькс характеризуется заполнением цистерны мозолистого тела; перемещением в противоположную сторону частей мозга, расположенных между свободным краем большого серповидного отростка (фалькса) и основанием черепа; без смещения базальных структур, включая воронку серого будра, которые прочно фиксированы оболочками и сосудами; выпячиванием поясничной извилины между краем серповидного отростка (фалькса) и мозолистым телом в сторону противоположного полушария; смещением и сдавлением внутренних вен мозга; сдавлением передней мозговой артерии, что ведет к ишемии и инфаркту; развитием вклинения поясничной извилины и образованием на ней странгуляционной борозды от острого края серповидного отростка [3,14,39,43,48,79].
Аксиальный дислокационный синдром мозга, или центральное транстенториальное ВСМ, образуется смещением диэнцефальной области и других стволовых структур в каудальном направлении через вырезку намета. Эта форма ВСМ характеризуется передавливанием и частичным отрывом ножки гипофиза (несахарный диабет); придавливанием задней мозговой артерии к открытому краю вырезки (инфаркт к затылочной доли); сдавлением большой вены мозга; натяжением медиальных перфорирующих ветвей базилярной артерии, что ведет к ишемическим повреждениям ствола мозга с распространением процесса в каудальном направлении; окклюзией путей оттока ЦСЖ; вторичным кровоизлиянием Дюре в стволе мозга [3,14,35,43,73].
Височно-тенториальный дислока-ционный синдром образуется смещением (выпячиванием) базальных отделов височной доли (в основном гиппокамповых извилин под намет мозжечка). Характеризуется локализацией процесса в области cisterna ambiens et interpreduncularis; сдавлениемглазодвигательного нерва, задней мозговой артерии и базальной вены Розенталя; одно- или двусторонним смещением под намет мозжечка в области переднего, бокового или заднего отдела отверстия, а также вдоль всей полуокружности намета мозжечка; смещением верхнего отдела мозгового ствола и мозолистого тела; странгуляционной бороздой, образованной свободным краем намета мозжечка на гиппокамповой извилине;пятью формами смещения (по Б.С. Хоминскому, 1960):
1) переднее – в супраселлярную ямку с заполнением базальной цистерны;
2) переднебоковое – вдоль переднего квадранта среднего мозга;
3) заднебоковое – в области заднего квадранта среднего мозга;
4) заднее – расположение сзади и сверху от среднего мозга;
5) полулунное или серповидное – сплошное вклинение вдоль всей полуокружности среднего мозга) [3,13,14,22,43].
Дислокационный синдром мозжечка в шейно-затылочную дуральную воронку, которая укреплена снаружи затылочной костью и верхними шейными позвонками с их мощным связочным аппаратом, развивается в области cisterna cerebellomedullaris (нижняя дислокация) и характеризуется смещением миндалин мозжечка в большое отверстие затылочной кости, край которой образует странгуляционную борозду на нижней поверхности мозжечка; сдавлением продолговатого мозга сзади и с боков на уровне выходящих корешков IX, X, XI и XII пар черепно-мозговых нервов; окклюзией отверстия Мажанди; сдавлением и блокированием ликворооттока на уровне большого затылочного отверстия;при значительном смещении в большое затылочное отверстие не только миндалин, но и части двубрюшных долек имеет место их вклинение и распространение вниз на уровне первых 1–2 шейных позвонков [3,14,27,39,43].
Дислокационный синдром мозжечка в отверстие намета (верхняя дислокация) ведет к смещению четверохолмия верхне-переднем (оральном) направлении и характеризуется деформацией заднего отдела третьего желудочка и водопровода; блокадой ликворных путей на уровне сильвиева водопровода и цистерн, окружающих средний мозг; сдавлением и деформацией вены Галена и Розенталя, повышая супратенториальное венозное давление; сдавлением верхних мозжечковых артерий (инфаркт верхних отделов мозжечка); 30–60% частотой проявления при опухолях задней черепной ямки (ЗЧЯ); смещением варолиева моста в оральном направлении (область cisterna interpeduncularis) при невриномах слухового нерва; заполнением cisterna pontis media et lateralisпри смещении и придавливании варолиева моста к блюшенбаховому скату; странгуляционной бороздой отводящего нерва от передней нижней мозжечковой артерии [3, 14, 43].
Нередко в процессе ВСМ в самом стволе формируется вторичные гематомы Дюре (Duret). Их обычная локализация – средний мозг и верхняя часть моста. Эти гематомы образуются за счет разрыва перфорирующих ветвей основной артерии во время прижатия ствола и намету мозжечка [35,40,50,72].
При всех типичных видах дислока-ционных синдромов и ВСМ как конечной стадии этого процесса имеет место повреждение медио-базальных структур головного мозга, главным образом ствола мозга на разном уровне. Клинически особо опасной считается нарушение функции ретикулярной формации, тянущейся вдоль всей оси ствола.
Неврологическая симптоматика ВСМ
Самыми частыми неврологическими симптомокомплексами у тяжелых больных в догоспитальном этапе, которые сохраняют свое клиническое значение и в дальнейшем, являются расширенный и фиксированный зрачок с одной стороны, контрлатеральный гемипарез (гемиплегия), нарушение сознания вплоть до комы.Неврологическая оценка коматозных пациентов включает 4 раздела: уровень бодрствования по ШКГ; симптоматика поражения ствола мозга; изучение моторных ответов и оценка патологического типа дыхания [16,74,85,89]. Для оценки быстроты развития самого процесса ВСМ у части пациентов имеет смысл динамическое неврологическое наблюдение [74,85,86,89].
При быстро развивающемся дислокационном синдроме у коматозных больных нередко встречаются клинические синдромы, характерные для обширных повреждениях головного мозга: декортикационная ригидность – развивается при двустороннем поражении глубоких отделов полушарий мозга и выключении кортико-спинальных трактов, что выражается сгибанием верхних конечностей и прижатием их к туловищу, разгибанием и ротацией внутрь нижних конечностей; децеребрационная ригидность – развивается при повреждении ствола мозга на уровне среднего мозга, зрительного бугра, двустороннего поражения полушарий, перерыв тормозящей функции красного ядра на ядро Дейтерса, что проявляется тоническим разгибанием, гиперпронацией верхних и нижних конечностей; горметония – развивается после обширных кровоизлияний в полушарие, особенно в желудочковую систему, за счет выключения пирамидных путей и включения бульбоспинальных автоматизмов, что манифестируется периодическим тоническим напряжением мышц конечностей и туловища и выраженными защитными рефлексами; генерализованная мышечная атония – развивается за счет повреждения средней трети ствола мозга, включая ретикулярную формацию [5].
К наиболее часто встречающимся общим неврологическим симптомам, характеризующих процесс ВСМ, относят: нарушение сознания (до ШКГ=3); расширение зрачка на стороне патологического очага; фиксированные зрачки с анизокорией; расширение обоих зрачков; отсутствие корнеального рефлекса; нарушение содружественного движения глазных яблок; контрлатеральная гомониальная гемианопсия; контрлатеральный гемипарез; ипсилатеральный гемипарез; пульс – тахикардия, нарастающая брадикардия; резко выраженные двусторонние патологические рефлексы; нарушение функции сфинктеров; отсутствие околоцефального и окуловестибулярного рефлекса; отсутствие всех стволовых рефлексов; пульс – тахикардия, нарастающая брадикардия, температура – выраженная гипертермия, постепенное снижение температуры; нарушение дыхания – гипервентиляция, Чейна – Стокса, Биота, замедленное поверхностное дыхание, нарастающее брадипноэ, остановка дыхания [3,5,14,84,88].
Многие авторы подчеркивают стадийность клинического течения дислокационного процесса и его конечного состояния – ВСМ [3,5,14,39,44,71,86]. В соответствии со стадией в динамике меняется неврологическая симптоматика. Как правило, сначала подключается симптоматика поражения верхних отделов ствола (диэнцефальная область), а далее по десцендирующему типу превалирует клиника поражения моста и продолговатого мозга. Исходя из вышеизложенного, оценка неврологической симптоматики при конкретном механизме ВСМ проводится, учитывая стадию процесса.
Боковой дислокационный синдром под большой серповидный отросток неврологически проявляется в виде неравномерного гемипареза и гемигипестезии с преимущественным поражением ноги на противоположной стороне; рефлексов орального автоматизма контрлатерально от очага; гемиатаксией на противоположной стороне; лобной психикой и вторичным синдромом базальных ганглиев (гиперкинезы), феноменом зубчатого колеса и т.д. [3,14,39].
Аксиальный дислокационный синдром (центральное транстенториальное ВСМ) в своем процессе проходит 5 последовательных стадий: ранняя диэнцефальная; поздняя диэнцефальная; стадия среднего мозга – верхних отделов моста; стадия нижних отделов моста – верхних отделов продолговатого мозга; стадия продолговатого мозга. Последние две характеризуются глубокой комой; поверхностным дыханием, тахипноэ (20–40 в 1 минуту); отсутствием реакции на свет, окулоцефальных и окуловестибулярных реакций; мышечной атонией. В стадии продолговатого мозга представленая клиника усиливается: останавливается дыхание, падает АД [3, 14, 43].
Завершающий процесс височно-тенториального ВСМ неврологически характеризуется резким нарушением сознания; брадикардией, повышением АД, тахипноэ; двухсторонними двигательными нарушениями (децеребрационными реакциями); грубыми глазодвигательными и зрачковыми расстройствами; расходящимся косоглазием за счет противоположного глаза; спонтанным конвергирующим, вертикальным, монокулярным нистагмом [3, 14, 43].
Неврологическая картина вклинения мозжечка в шейно-затылочную дуральную воронку в завершающем этапе процесса характеризуется сохранением сознания достаточно долго; нарушением ритма и частоты пульса, синдром Кушинга – подъем АД на фоне замедленного пульса; прогрессирующими нарушениями дыхания; гипертензионно-окклю-зионными приступами; недостаточностью отводящего нерва (патогномный симптом вклинения миндалины мозжечка); тоническими разгибаниями шеи; исчезновением децеребрационной ригидности; грубыми бульбарными нарушениями: дизартрия, расстройства глотания, западение языка, цианоз, нарушения функции XI, XII нервов [3, 14, 27, 43].
Неврологическая симптоматика мозжечково-тенториального вклинения включает: анизокорию; симптом Гертвига – Мажанди; спонтанный вертикальный, ротаторный или диагональный нистагм; понижение слуха; приступы горметонии и децеребрационной ригидности; нарушение чувствительности в зоне иннервации пятого нерва; патологические знаки, защитные рефлексы; тахипноэ, тенденцию к повышению АД и пр. [14].Завершающая стадия этого механизма вклинения характеризуется тахикардией (пульс свыше 130 в 1 минуту); брадипноэ (менее 12 вдохов в 1 минуту); дыханием типа Чейна – Стокса; понижением АД (менее 80 мм рт. ст.); гипертермией (более 38,8 ºС) и желудочно-кишечным кровотечением [3,14,43].
Таким образом, неврология ВСМ, как правило, представляется нарушением сознания вплоть до комы и симптоматикой повреждения ствола мозга. Сам процесс ВСМ характеризуется стадийностью, а неврологическая симптоматика чаще всего нарастает по десцендирующему типу: от промежуточного до продолговатого мозга.
Медикаментозное лечение ВСМ
Создание градиента давлений между внутрисосудистым пространством и мозговой тканью может быть использовано в лечении отека мозга. Для этой цели предлагаются белково-коллоидные препараты; осмодиуретики (подробно изучен маннитол); салуретики; ограничение и темп введения инфузных сред при лечении повреждений головного мозга. На основании многоступенчатых рандомизированных доказательных исследований по маннитолу были сделаны выводы:
а) маннитол (0,25:1 г/кг) в первую очередь эффективен при повышении ВЧД;
б) ограниченное использование препарата имеет место при транстенториальном вклинении с прогрессированием неврологической симптоматики на фоне мониторинга ВЧД;
в) маннитол противопоказан при артериальной гипотензии менее 90 мм рт. ст. [20,23,32].
Изучена эффективность энергопротектора, обладающего свойствами антиоксиданта – цитофламина (20 мл раствора на 400 мл физраствора 1–2 раза/сутки внутривенно) при интенсивной терапии инфарктов, кровоизлияний и травмах головного мозга. Все эти патологические процессы имеют место при ВСМ. Терапия цитофламином в рандомизированном комплексном исследовании приводила к быстрейшему восстановлению сознания у коматозных больных; уменьшению показателей летальности; повышению степени функционального исхода и пр. [1,17–19,47].
При внутричерепных кровоизлияниях и ВСМ положительный эффект оказывает ингибитор протеаз контрикал, который заметно уменьшает степень перигеморрагического отека, а этим снижает объемное воздействие. Но в то же время при использовании препарата, особенно длительно, следует учитывать и возможные побочные явления: аллергические реакции; артериальную гипотензию; артериальные и венозные тромбозы. Хотя тромбогенные свойства контрикала крайне уместны в хирургии нетравматических внутримозговых гематом (НВМГ) на ранних и сверхранних сроках [4,5,8,9,25,36,81].
Опухоли головного мозга, особенно глиобластомы, индуцируют перитуморный вазогенный отек, лечение которого комплексное. Существенное место в нем занимают дексаметазон (или синтетический его аналог гликокортикоид) и осмодиуретики. Использование этих средств уменьшает проницаемость гематоэнцефалического барьера, объем перитуморозного вазогенного отека, а этим и степень дислокационного синдрома [33,43].
Аналогично следует рассматривать тактику лечения абсцессов мозга, протекающих с вазогенным отеком, где существенное место отводится антибактериальным средствам. Здесь определяем предельный диаметр абсцесса в 3 см, где превалирует консервативное лечение. При большем диаметре консервативное лечение, как правило, дополняет (или становится основным) хирургическое вмешательство [43].
С помощью терапевтической гипотермии достигают уменьшения отека мозга, кровообращения в зоне очага, реакции оксидативного стресса свободных радикалов, противовоспалительного эффекта, подавления активности металлопротеиназы-9, которая вызывает повреждения гематоэнцефалического барьера и формирования вазогенного отека. Начато клиническое рандомизированное исследование по терапевтической гипотермии пациентов с большими внутримозговыми кровоизлияниями. Продолжительность гипотермии составляла 10 суток при температуре 35ºС [38, 41, 54, 55, 63, 64, 82, 91]. Таким образом, терапевтическая гипотермия усиливает медикаментозный эффект.
Резюмируя, следует отметить, что медикаментозное лечение, влияющее на этиопатогенез заболевания, и терапевтическая гипотермия служат серьезным дополнением оперативного вмешательства при выраженных дислокационных синдромах и ВСМ.
Хирургические возможности лечения ВСМ
Первым и основным условием успешного хирургического лечения дислокационного синдрома и ВСМ является устранение этиопатогенетического фактора этого процесса [13,14]. Остальные хирургические методики можно подразделить следующим образом: 1) декомпрессивная краниоэктомия (наружная декомпрессия супратенториального пространства); 2) наружное вентрикулярное дренирование (внутренняя декомпрессия); 3) внутренняя декомпрессия за счет резекции медиобазальных отделов височной доли; 4) уменьшение объема отечного мозга путем резекции поврежденных височных и лобных долей; 5) резекция ущемленных участков мозга; 6) декопрессивная краниоэктомия ЗЧЯ (расширение затылочно-шейного конуса вклинения); 7) тенторотомия и фальксотомия; 8) редислокация мозга в виде интратекального введения физраствора; 9) сочетание методик [10,13,14,34,43,65,70].
Следующим шагом после патогенетической терапии по уменьшению ВЧД и степени дислокации, согласно Колумбийскому протоколу, является наружная декомпрессия – широкая краниоэктомия. Операция проводится при различной супратенториальной патологии (тяжелые черепно-мозговые травмы, НВМГ, ишемические инсульты, протекающие с выраженной дислокацией и пр.). Операция показана при боковой дислокации под фалькс и височно-тенториальном ВСМ. Оптимальным размером декомпрессии является краниоэктомия диаметром около 12 см, обычно в височно-теменной области. В части наблюдений при аксиальной дислокации эффективна бифронтальная краниоэктомия. Наружная декомпрессия в рандомизированных исследованиях в целом заметно уменьшает показатели летальности [14,28,29,37,42,45,59,62,63,87,92].
Равноценным хирургическим мероприятием по отношению к наружной декомпрессии является наружное вентрикулярное дренирование. Этой операцией или внутренней декомпрессией одновременно достигается быстрое снижение ВЧД и его мониторинг. Операция часто используется при различной интракраниальной патологии (аналогично наружной декомпрессии). Она показана при аксиальном ВСМ; дислокации мозжечка в шейно-затылочную дуральную воронку; височно-тенториальном ВСМ на стороне патологического очага и подготовке (1-й этап) к основной операции (2-й этап). Наружное вентрикулярное дренирование не всегда выполнимо из-за сдавливания желудочковой системы, а осложнение в основном носит инфекционный характер с частотой до 10%. Использование данной операции у коматозных пациентов с ВСМ по результатам рандомизированных исследований снижает летальность [14, 32, 46, 58, 67, 80, 84].
Интратекальное введение 30–40 мл физиологического раствора вводилось вторым этапом у 45 больных после наружного вентрикулярного дренирования или открытой краниотомии и удаления очага. При этом пациенты имели вклинение миндалин в большое затылочное отверстие и отсутствие спонтанного дыхания. Выздоровление наступило в 11 (24,4%) случаях, временное восстановление дыхания с последующим летальным исходом у 16 (35,6%) больных, а у остальных 18 (40%) – неблагоприятный исход без улучшения [65].
Ряд исследователей [10, 34, 68, 70] при остром дислокационном синдроме и угрожающем височно-тенториальном вклинении рекомендуют создавать внутреннюю декомпрессию за счет резекции височной доли целиком или ее медиобазальных отделов (ункусэктомия, парагиппокампэктомия). В сравнительных группах этим достигается заметное уменьшение летальности.
При нарастающем объеме мозжечка (обычно при инфарктах), который ведет к вклинению его структур в шейно-затылочную дуральную воронку и мозжечково-тенториальному вклинению, показана билатеральная субокципитальная краниоэктомия. Эта операция включает ламинэктомию первого шейного позвонка; вскрытие твердой мозговой оболочки; эвакуацию некротической ткани (у 50% больных). Операция у части пациентов сочетается с наружным вентрикулярным дренированием. Субокципитальная билатеральная краниоэктомия при инфарктах мозжечка по результатам рандомизированных исследований уменьшает степень функционального исхода [14,27,53,57,60,90].
Височно-тенториальное ВСМ является показанием для тенториотомии. При отеке мозга прямой доступ к вырезке намета мозжечка обычно затруднен или даже невозможен, поэтому был разработан специальный инструмент – тенториотом. Он представляет собой крючок со стержнем и рукояткой, покрытый изолирующим материалом. Тенториотомию выполняют через отдельное фрезевое отверстие по разработанным разметкам. Применение тенториотомии у коматозных больных уменьшает летальность на 5–10% [13].
Аналогичный принцип в виде фальксотомии используется при вклинении поясничной извилиныпод серповидный отросток. На стороне, противоположной очагу, вблизи точки Кохера накладывают фрезевое отверстие, которое расширяют к срединной линии. Вскрывают твердую мозговую оболочку и специальным устройством клипируют пересекают нижний сагиттальный синус и серп. Такой способ фальксотомии служит одной из опций лечениявклинения под серповидный отросток [13].
Следует отметить, что в настоящее время при ВСМ чаще всего используются наружная и внутренняя декомпрессии, реже – их сочетание. Дополняющую роль отводят интратекальному введению физраствора с целью уменьшения супра- и инфратенториального ВЧД-градиента. В отдельных случаях может быть использована резекция височной доли или ее медиобазальных отделов.
Клиническая часть
Клинический материалпредставлен пациентами с НВМГ (таблица): 4 женщины; 4 мужчины; возраст – от 22 до 75 лет. Все больные до операции находились в коматозном состоянии (ШКГ=3–6). Это тяжелое клиническое состояние наступало у пациентов с различной скоростью.
Таблица. Коматозные больные с НВМГ больших полушарий и ВСМ
|
№
|
Ф.И.,
возраст, пол
|
Этиология НВМГ
|
Локализация, сторона, объем (см³)
|
КТ См ПП (мм)
|
Основной механизм ВСМ
|
Индекс дисл. Скорости ШКГ до – ШКГ по продолж. (часы)
|
Лечебные мероприятия
|
Исходы
|
|
1
|
Ш.Э., 22, ж.
|
HELLP-синдром
|
Латер.,
левостор., 46
|
12
Выраж. ПГО и общий отек, гематома Дюре
|
Височно-тентор.
|
(15–3):1 = 12
|
Микрохир. удаление НВМГ + краниоэктомия + ВЧД сенсор (15–22 мм рт. ст.) Октаплекс – 2 дозы
|
Возвр. сознания: ШКГ=10; отсутствие спонтанных движений; пролежни, сепсис; летальный исход через 3 месяца
|
|
2
|
А.,
28, ж.
|
Разрыв АВМ + аневризма
|
Лобар., левостор., 50 (теменная доля)
|
10
Общий отек мозга
|
Бок. дисл. синдр. (под фалькс)
|
(15–5):4 = 2,5
|
Микрохир. удаление НВМГ + краниоэктомия + ВЧД сенсор (10–20 мм рт. ст.) + эмболизация АВМ + автокраниопластика
|
Хорошее функц. восстановление (5-я степень по ШФИ) через 16 месяцев [1]
|
|
3
|
К.А.,
25, м.
|
Повторный разрыв аневризмы СМА + тромбоз
|
Латер.,
левостор., 46
|
12
Общий отек мозга, инфаркт бассейна СМА слева
|
Височно-тентор. + бок. дисл. синдр. (под фалькс)
|
(15–5):8 = 1,25
|
Наружное вентрикул. дренирование + кранио-эктомия + автокраниопластика
|
Через 2 года хорошее функц. восстановление (4–5-я степень по ШФИ); остаточный умеренный прав. гемипарез
|
|
4
|
К.А.,
53, м.
|
Артер.
гипертензия
|
Смеш.,
правостор., 74
|
15
Ишемия в бассейне СМА справа
|
Височно-тентор. + бок. дисл. синдр. (под фалькс)
|
(15–6):24 = 0,375
|
Микрохир. удаление НВМГ + ВЧД сенсор (13–25 мм рт. ст.)
|
Через 5 лет функц. восстановление умерен. (3-я степень по ШФИ); остается глубокий лев. гемипарез
|
|
5
|
З.И.,
65, ж.
|
Разрыв АВМ
|
Лобар., правост., 52 + СДГ
правостор.
|
16
Общий отек мозга
|
Височно-тентор. + бок. дисл. синдр.
|
(15–3):3 = 4
|
Удаление СДГ + кранио-эктомия + ВЧД сенсор (10–24 мм рт. ст.)
|
Кратковременное улучшение: ШКГ=6–7; летальный исход через 3 недели
|
|
6
|
Э.И.,
75, ж.
|
Артериальная гипертензия
|
Смеш.,
правостор., 68
|
20
Общий отек мозга
|
Височно-тентор. + бок. дисл. синдр.
|
(15–5):5 = 2
|
Микрохир. удаление НВМГ + ВЧД сенсор (17–26 мм рт. ст.)
|
Без улучшения, летальный исход на 3-и сутки
|
|
7
|
К.Р.,
37, м.
|
Осложнение фибринолиза
|
Смеш.,
правостор., АКЖС, 78
|
8
Выраженный общий отек мозга
|
Височно-тентор. + бок. дисл. синдр. (под фалькс)
|
(15–3):4 = 3
|
Микрохир. удаление НВМГ + краниоэктомия + наружное вентрикул. дренирование (ВЧД 14–25 мм рт. ст.)
|
Возвр. сознания: ШКГ=15; бульбарный синдром; летальный исход через 2 месяца от пневмонии (рис. 1–8)
|
Примечание: АВМ – артериовенозная мальформация; ПКЖС – прорыв крови в желудочковую систему; СДГ – субдуральная гематома; СМА – средняя мозговая артерия; ШФИ – шкала функциональных исходов Глазго. [1] –полное описание: Украинский нейрохирургический журнал. – 2017. – №3. – С.46–51. [2] – полное описание: Украинский нейрохирургический журнал. – 2015. – №4. – С.69–75. [3] – полное описание: Украинский нейрохирургический журнал. – 2014. – №1. – С.16–25.
Для клинической оценки больных с ВСМ мы ввели оптимизирующий показатель – индекс дислокационной скорости, который определяли, как разницу в баллах по ШКГ до заболевания (обычно 15) и на момент начала операции (как правило, 3–6), поделив эту разницу на продолжительность времени (в часах) от начала заболевания до «операционного стола».
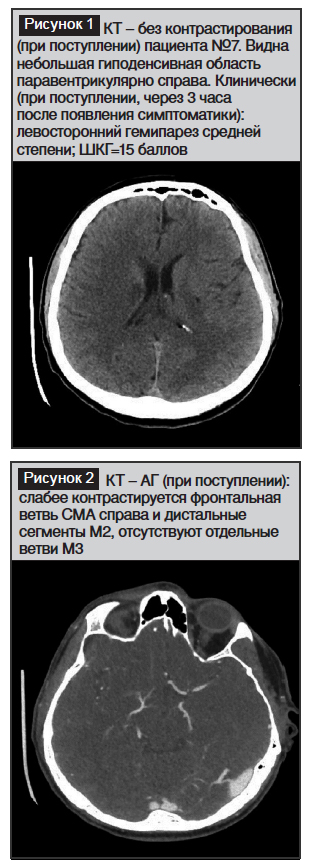
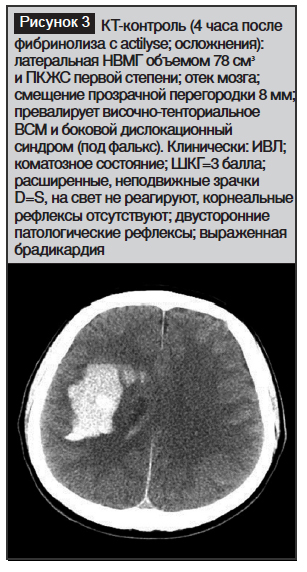

В наших наблюдениях НВМГ были различной этиологии: артериальная гипертензия; разрыв АВМ; разрыв аневризмы СМА с последующим ее тромбозом; HELLP-синдром и осложнение тромболиза.
Всем больным до и после оперативного лечения было проведено спиральное КТ-обследование и КТ-АГ. Из основных КТ-параметров были выделены: локализация, объем НВМГ; смещение прозрачной перегородки; превалирующие механизмы ВСМ, поскольку в этом патологическом процессе, как правило, наблюдаются симптомы всех основных механизмов ВСМ.
Арсенал хирургического лечения включал микрохирургическое удаление НВМГ; наружное вентрикулярное дренирование; декомпрессивную краниоэктомию с последующим возвратом костного лоскута на место; имплантацию паренхиматозного ВЧД-сенсора; сочетание методов. У двух пациентов, где резко была нарушена система гемостатических факторов (HELLP-синдром и состояние после тромболиза), во время операции использовали протромбиновый комплекс – октаплекс.
После оперативного лечения, как правило, наступал этап неврологической стабилизации: уменьшалась или исчезла анизокория; повышался уровень сознания на 1–3 балла по ШКГ и др. Исключение – наблюдение №6, где имел место летальный исход на 3-и сутки.
После этапа временной неврологической стабилизации (примерно через 4–5 суток) из-за нарушения центральной иннервации, клинически начинали проявляться симптомы типичных осложнений: бронхолегочные инфекции; воспаления мочевых путей; пролежни; венозный застой – тромбоэмболия и т.д. Параллельно наблюдался подъем лабораторных воспалительных показателей. В этом периоде неблагоприятный исход наступил у 3 пациентов.
Степень функционального исхода оценивали по шкале Глазго [49]. Согласно этой шкале, 5-я степень имела место только в одном случае (№2, была достигнута повторными курсами цито-фламина, милдроната, кавинтона и др.); 4-я степень – также в одном случае (№3), а у двух пациентов – 3-я степень функционального исхода.
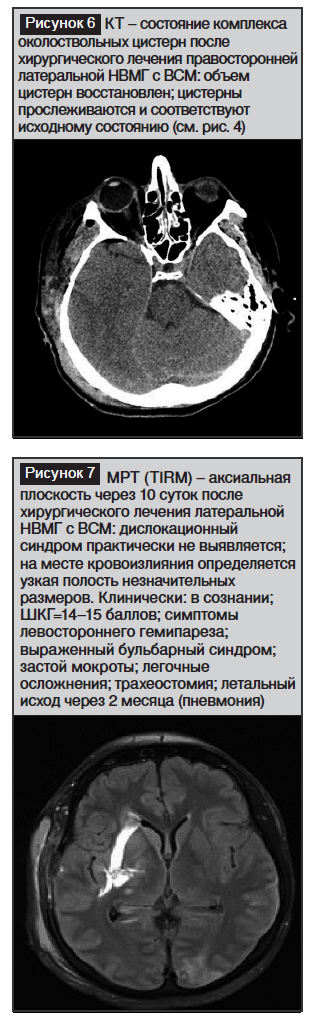
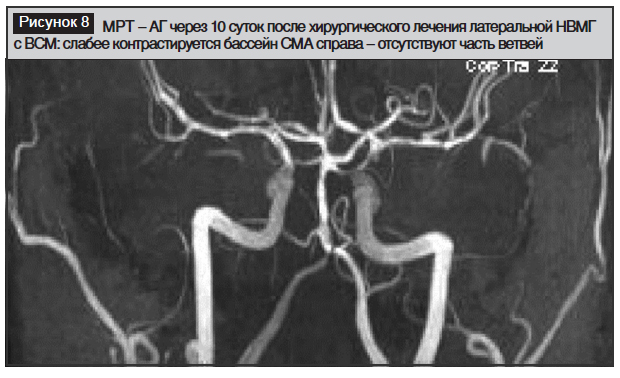
Заключение
Дислокационный синдром и его завершающая стадия – ВСМ, часто встречаются при заболеваниях и травмах головного мозга. Выявлено 5 клинически значимых механизмов ВСМ. В процессе дислокации образуются градиенты ВЧД между полушариями и между супра- и инфратенториальным пространством. Критическими считаются ВЧД-градиенты, превышающие 10 мм рт. ст., а при ВСМ эта величина может достичь 30–40 мм рт. ст.
Резервные пространства (в основном цистерны и желудочковая система) могут длительно компенсировать клинические проявления дислокационного синдрома.
Быстрый дислокационный синдром и ВСМ (его завершающая стадия), где имеют место обширные повреждения головного мозга, неврологически могут характеризоваться типичными синдромами: декортикационной, децеребрационной ригидностью; горметонией и генерализованной мышечной атонией. В наших наблюдениях неврологическая картина включала коматозное состояние (ШКГ=3–7), стволовую симптоматику, а также горметонию у части больных.
Всегда остается в силе правило по первоочередному удалению очага, вызывающего дислокационный синдром и ВСМ. Из дополнительного хирургического арсенала в современном этапе чаще всего применяются обширные декомпрессивные краниотомии (в том числе и ЗЧЯ), наружное вентрикулярное дренирование, а в диагностическом аспекте – регистрация ВЧД. При вклинении мозжечка в шейно-затылочную дуральную воронку, как дополняющий фактор, сохраняет свою актуальность интратекальное введение физраствора.
По нашему опыту у всех пациентов с НВМГ велась регистрация ВЧД (паренхиматозным сенсором или через наружное вентрикулярное дренирование); проводилась обширная декомпрессивная краниоэктомия с сохранением лоскута в жидком азоте; одновременно осуществлялось нейрохирургическое удаление НВМГ (при существенном объемном влиянии). В последнем этапе исследования наружная декомпрессия (краниоэктомия) сочеталась с одновременной внутренней декомпрессией (наружным вентрикулярным дренированием). Таким сочетанием достигается быстрый и убедительный разгрузочный эффект.
Консервативная терапия, независимо от этиологии ВСМ, служит дополнением к хирургическому лечению. В наших наблюдениях в обширную интенсивную терапию на раннем этапе включали средства с антиоксидантными свойствами (аскорбиновая кислота, милдронат, витамин Е в зонд, а через несколько дней – актовегин, цитофламин и др.).
Быстрый дислокационный синдром и его завершающая стадия – ВСМ – у всех авторов характеризуется высокими показателями летальности. Этому способствуют трофические изменения в тканях легких, кожных покровах и слизистых оболочках, что определяет повреждения стволовых структур и нарушения центральной иннервации.
Улучшение результатов лечения ВСМ индуцирует многогранное дальнейшее изучение этого жизнеугрожающего состояния.
Л И Т Е Р А Т У Р А
1. Афанасьев В.В. Цитофлавин в интенсивной терапии: Пособие для врачей. – СПб, 2006. – 36 с.
2. Барон М.А., Майорова Н.А. Функциональная стереоморфология мозговых оболочек. Атлас. – М., 1982. – 349 с.
3. Блинков С.М., Смирнов Н.А. Смещение и деформация головного мозга. – Л., 1967. – 204 с.
4. Виленский Б.С., Кузнецов А.Н., Виноградов О.И. Геморрагические формы инсульта: кровоизлияние в головной мозг, субарахноидальное кровоизлияние. Справочник. – СПб, 2008. – 69 c.
5. Виленский Б.С. Неотложные состояния в неврологии. – СПб, 2006. – 512 c.
6. Винокуров А.Г., Смирнов Д.С. Хирургическая анатомия желудочковой системы // Хирургия аневризм головного мозга. – Т.1. – М., 2011. – С.291–311.
7. Дзенис Ю.Л. Синдром окклюзионной гидроцефалии при супратенториальных опухолях мозга срединной локализации (диагностика и хирургическое лечение): Дис. … канд. мед. наук. – М.,1988. – 286 c.
8. Дзенис Ю.Л., Олманис А.Ю. // Украинский нейрохир. журнал. – 2018. – №3. – С.5–14.
9. Дзенис Ю.Л. // Украинский нейрохир. журнал. – 2014. – №2. – С.48–54.
10. Кадыров Р.М. // Молодой ученый. – 2016. – №2 (106). – С.346–348.
11. Крылов В.В., Добровольский Г.Ф., Хуторной Н.В., Винокуров А.Г. Хирургическая анатомия подпаутинного пространства // Хирургия аневризм головного мозга. – Т.1. – М., 2011. – С.195–219.
12. Лебедев В.В., Сарибекян А.С. // Вопр. нейрохир. – 1983. – №4. – С.36–41.
13. Лебедев В.В., Крылов В.В. Неотложная нейрохирургия. – М., 2000. – 567 с.
14. Луцик А.А., Крючков В.В. Дислокационные синдромы головного мозга (диагностика и лечение). – Новокузнецк, 1986. – 26 с.
15. Макаров А.Ю. Клиническая ликворология. – Л., 1984. – 215 с.
16. Плам Ф., Познер Д.Б. Диагностика ступора и комы. – М., 1986. – 544 с.
17. Румянцева С.А., Силина Е.В. Энергокоррекция и качество жизни при хронической ишемии мозга. – М., 2007. – 60 с.
18. Румянцева С.А., Болевич С.Б., Силина Е.В., Федин А.И. Антиоксидантная терапия геморрагического инсульта. – М., 2007. – 69 с.
19. Румянцева С.А., Кузнецов О.Р., Евсеев В.Н. и др. // Вестник интенсивной терапии. Нейрореаниматология. – 2005. – №3. – С.23–26.
20. Сировский Э.Б. // Вопр. нейрохир. – 1987. – №4. – С.9–15.
21. Смирнов Н.А. Дислокационные синдромы при ЧМД // Нейротравматология. Справочник. – М., 1994. – С.64–65.
22. Хоминский Б.С. Патологическая анатомия нервной системы: Многотомное рук-во по патологической анатомии. – Т.2. – М., 1962. – С.143–158.
23. Царенко С.В. Нейрореаниматология. Интенсивная терапия черепно-мозговой травмы. – М., 2009. – 383 с.
24. Щербук Ю.А. Диагностика и дифференцированное лечение травматических внутричерепных гематом с применением эндоскопической видеотехники: Дис. ... канд. мед. наук. – СПб, 1995. – 217 с.
25. Aghi M., Ogilvy C., Carter B. Surgical Management of Intracerebral Hemorrhage // Schmidek and Sweet’s Operative Neurosurgical Techniques: Indications, Methods And Results. – Vol.2. – Philadelphia, 2012. – Р.823–836.
26. Alksne J.F., Lovings E.T. // Arch Neurol. – 1972. – Vol.27. – P.371–377.
27. Ayling O.G.S., Alotaibi N.M., Wang J.Z., et al. // World Neurosurg. – 2018. – Vol.110. – P.450–459.
28. Avecillas-Chasin J.M. // Acta Neurochir (Wien). – 2015. – Vol.157. – P.2121–2123.
29. Broderick J., Connolly S., Feldmann E., et al. // Stroke. – 2007. – Vol.38. – P.2001–2023.
30. Brown P.D., Davies S.L., Speake T., Millar I.D. // Neuroscience. – 2004. – Vol.129. – P.957–970.
31. Carhuapoma J.R., Qureshi A.I., Bhardwaj A., Williams M.A. // J. Neurosurg. Anesthesiol. – 2002. – Vol.14. – P.299–303.
32. Carney N., Totten A.M., O’Reilly C., et al. // Neurosurgery. – 2017. – Vol.80. – P.6–15.
33. Cenciarini M., Valentino M., Belia S., et al. // Front. Mol. Neurosci. – 2019. – Vol.12. – P.65.
34. Chibbaro S., Marsella M., Romano A., et al. // J. Neurosurg. – 2008. – Vol.108. – P.74–79.
35. Duret R.L. // Brux Med. – 1955. – Vol.35. – P.797–800.
36. Dzenis J. Preoperative pharmacoprotection of patients in coma with nontraumatic intracranial hematoma // Mental recovery after traumatic brain injury: a multidisciplinary approach: conference materials. – Moscow, 2008. – P.35.
37. Elshanawany A.M., Essa A.A. // Open J. Mod. Neurosurg. – 2018. – Vol.8. – P.331–341.
38. Fingas M., Penner M., Silasi G., Colbourne F. // Exp. Neurol. – 2009. – Vol.219. – P.156–162.
39. Fisher C.M. // Sem. Neurology. – 1984. – Vol.4, N4. – P.417–421.
40. Fisher C.M. // Can. J. Neurol. Sci. – 1995. – Vol.22. – P.83–91.
41. Gao D., Ding F., Lei G., et al. // Mol. Med. Rep. – 2015. – Vol.11. – P.3009–3014.
42. Gerl A., Tavan S. // Zentralbl. Neurochir. – 1980. – Vol.41. – P.125–138.
43. Greenberg M.S. Handbook of Neurosurgery. – Ed.8. – New York, 2016. – 1664 p.
44. Hahn F.J., Gurney J. // AJNR Am. J. Neuroradiol. – 1985. – Vol.6. – P.844–845.
45. Hemphill J.C. 3rd, Greenberg S.M., Anderson C.S., et al. // Stroke. – 2015. – Vol.46. – P.2032–2060.
46. Holloway K.L., Barnes T., Choi S., et al. // J. Neurosurg. – 1996. – Vol.85. – P.419–424.
47. Inci S., Ozcan O.E., Kilinç K. // Neurosurgery. – 1998. – Vol.43. – P.330–335.
48. Jang S.H., Kim S.H., Chang M.C. // J. Korean Neurosurg. Soc. – 2016. – Vol.59. – P.306–309.
49. Jennett B., Bond M. // Lancet. – 1975. – Vol.1. – P.480–484.
50. Kamijo Y., Soma K., Kishita R., Hamanaka S. // Am. J. Emerg. Med. – 2005. – Vol.23. – P.908–910.
51. Kaufmann C., Clark K. // J. Neurosurg. – 1970. – Vol.33. – P.145–150.
52. Kellie G. // Trans. Med. Chir. Soc. Edinburgh. – 1824. – Vol.1. – Art.84.
53. Kim M.J., Park S.K., Song J., et al. // Stroke. – 2016. – Vol.47. – P.2565–2573.
54. Kollmar R., Staykov D., Durfler A., et al. // Stroke. – 2010. – Vol.41. – P.1684–1689.
55. Kollmar R., Juettler E., Huttner H.B., et al. // Int. J. Stroke. – 2012. – Vol.7. – P.168–172.
56. Langfitt T. // J. Neurosurg. – 1974. – Vol.21, N8. – P.998–1005.
57. Lindeskog D., Lilja-Cyron A., Kelsen J., Juhler M. // Clin. Neurol. Neurosurg. – 2019. – Vol.176. – P.47–52.
58. Lozier A.P., Sciacca R.R., Romagnoli M.F., Connolly E.S.Jr. // Neurosurgery. – 2002. – Vol.51. – P.170–181.
59. Lubillo S.T., Parrilla D.M., Blanco J., et al. // J. Neurosurg. – 2018. – Vol.128. – P.1538–1546.
60. Luney M.S., English S.W., Longworth A., et al. // Neurocrit. Care. – 2016. – Vol.25. – P.365–370.
61. MacLellan C.L., Clark D.L., Silasi G., Colbourne F. // J. Neurotrauma. – 2009. – Vol.26. – P.313–323.
62. Mayer S.A., Chong J.Y. // J. Intensive Care Med. – 2002. – Vol.17. – P.55–67.
63. McHugh D.C., Fiore S.M., Strong N., Egnor M.R. // Pediatr. Neurosurg. – 2019. – Vol.54. – P.6–11.
64. Mehdiratta M., Kumar S., Hackney D., Schlaug G., Selim M. // Stroke. – 2008. – Vol.39. – P.1165–1170.
65. Meng Q., Wei L., Li X., et al. // World Neurosurg. – 2014. – Vol.81. – P.173–176.
66. Monro A. Observation on the structure and functions of the nervous system. – Edinburgh, 1783. – 176 p.
67. Morgenstern L.B., Hemphill J.C. 3rd, Anderson C., et al. // Stroke. –2010. – Vol.41. – P.2108–2129.
68. Mori K., Ishimaru S., Maeda M. // Acta Neurochir. (Wien). – 1998. – Vol.140. – P.1239–1244.
69. Nádvornik P., Duros J., Tertsch D. // Zentralbl. Neurochir. – 1980. – Vol.41. – P.319–326.
70. Nussbaum E.S., Wolf A.L., Sebring L., Mirvis S. // Neurosurgery. – 1991. – Vol.29. – P.62–66.
71. Osborn A.G. // Radiology. – 1977. – Vol.123. – P.93–96.
72. Parizel P.M., Makkat S., Jorens P.G., et al. // Intensive Care Med. – 2002. – Vol.28. – P.85–88.
73. Patil A.A., Hahn F.J., Leibrock L.G. // Clin. Neurol. Neurosurg. – 1991. – Vol.93. – P.65–67.
74. Plum F., Posner J. The diagnosis of stupor and coma. 3rd Ed. – Philadelphia, 1980. – P.87–130.
75. Qiu W., Jiang Q., Xiao G., Wang W., Shen H. // BMC Anesthesiol. – 2014. – Vol.14. – P.112.
76. Rangel-Castilla L., Gopinath S., Robertson C.S. // Neurol. Clin. – 2008. – Vol.26. – P.521–541.
77. Ropper A.H. // N. Engl. J. Med. – 1986. – Vol.314. – P.953–958.
78. Sahuquillo J., Poca M.A., Arribas M., Garnacho A., Rubio E. // J. Neurosurg. – 1999. – Vol.90. – P.16–26.
79. Shah A., Choi D. // Br. J. Neurosurg. – 2004. – Vol.18. – P.273–274.
80. Shima K., Aruga T., Onuma T., et al. // Asian J. Neurosurg. – 2010. – Vol.5. – P.15–23.
81. Slaughter T.F., Greenberg C.S. // Am. J. Hematology. – 1997. – Vol.56. – P.32–36.
82. Staykov D., Wagner I., Volbers B., et al. // Neurocrit. Care. – 2013. – Vol.18. – P.178–183.
83. Mayer S.A., Chong J.Y. // J. Intensive Care Medicine. – 2002. – Vol.17. – P.55–67.
84. Stevens R.D., Shoykhet M., Cadena R. // Neurocrit. Care. – 2015. – Vol.23. – S76–82.
85. Stevens R.D., Cadena R.S., Pineda J. // Neurocrit. Care. – 2015. – Vol.23. – S69–75.
86. Stovring J. // Neuroradiology. – 1977. – Vol.14. – P.101–105.
87. Tagliaferri F., Zani G., Iaccarino C., et al. // Acta Neurochir. (Wien). – 2012. – Vol.154. – P.919–926.
88. Taylor W.R., Chen J.W., Meltzer H., et al. // J. Neurosurg. – 2003. – Vol.98. – P.205–213.
89. Teasdale G., Jennett B. // Lancet. – 1974. – Vol.2. – P.81–84.
90. Tsitsopoulos P.P., Tobieson L., Enblad P., Marklund N. // Acta Neurochir. (Wien). – 2011. – Vol.153. – P.2075–2083.
91. Yang J., Arima H., Wu G., et al. // Stroke. – 2015. – Vol.46. – P.1009–1013.
92. Yao Z., Ma L., You C., He M. // World Neurosurg. – 2018. – Vol.110. – P.121–128.
93. Yasargil M.G. Microneurosurgery, Vol.1. – New York, 1984. – 384 p.
Медицинские новости. – 2020. – №7. – С. 30-38.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.