Внимание! Статья адресована врачам-специалистам
Dzenis Yu.L.
Neurosurgical Clinic, Pauls Stradins Clinical University Hospital, Riga, Latvia
Experimental intracerebral hematomas
(histological studies perihematomal edema by drug therapy)
Резюме. Исследование посвящено патоморфологическому изучению локального применения контрикала и внутримышечных инъекций a-токоферола при лечении экспериментальных внутримозговых гематом (ЭВМГ) и их перигеморрагического отека. В первой части исследования крысам создавали ЭВМГ, включая в содержание кровоизлияния физраствор с контрикалом. У животных контрольной группы ЭВМГ не вводили контрикал. Во второй части работы крысам создавали ЭВМГ, где животные группы исследования получали инъекции антиоксиданта? a-токоферола, а особи контрольной группы – инъекции физраствора. Длительность эксперимента составляла 5 суток. Оценивалось неврологическое состояние крыс и велось патоморфологическое изучение мозга подопытных животных.
Локальное использование контрикала уменьшало степень развития перигеморрагических реакций, что коррелировало с убедительным терапевтическим эффектом. Внутримышечные инъекции ?-токоферола не влияли на морфологию ЭВМГ и их перигеморрагические реакции, несмотря на убедительный клинический эффект лечения, вероятно, за счет антиоксидантной протекции окружающей мозговой ткани.
Ключевые слова: контрикал (апротинин), a-токоферол, перигеморрагический отек, гистологическое исследование, экспериментальная внутримозговая гематома.
Медицинские новости. – 2020. – №9. – С. 83–86.
Summary. This study is dedicated to pathophysiological investigations of local contrical use in treatment of experimental intracerebral hematomas (EICH). During the first part of the study physiological solutions with contrical was injected into EICH in rats. In the second part, rats with EICH were divided in two groups, the first one received antioxidant alpha tocopherol injections, but the second group received only physiological solution injections. Duration of the investigation was 5 days. Neurological status and morphological findings were evaluated. This study showed that the use of local contrical injection decreased perihematomal edema which correlated with significant terapeutical effort. Despite the convincing clinical improvement after the treatment with intramuscular injections of alpha tocopherol, no changes in morphological findings of EICH and perihematomal edema were found. This may be related to the antioxidant features of alpha tocopherol to protect the surrounding tissues of brain.
Keywords: contrical (aprotinin), alpha tocopherol, perihematomal edema, histological studies, experimental intracerebral hematomas (EICH).
Meditsinskie novosti. – 2020. – N9. – P. 83–86.
Нетравматические внутримозговые гематомы (НВМГ) характеризуются высокой (40%) летальностью в течение первого месяца, что служит основой для дальнейшего изучения вопросов патогенеза и лечения этой патологии [29, 42, 46].
Одним из клинически важных факторов возникновения НВМГ является объем кровоизлияния. От его величины зависит степень первичного механического повреждения головного мозга. Вторичное повреждение определяет масс-эффект окружающей мозговой ткани в виде реакции на кровоизлияние, что формирует перигеморрагический отек [14, 38, 44, 57, 64–66].
Одним из основных этиологических факторов перигеморрагического отека является процесс перехода протромбина в тромбин и распад эритроцитов с гемоглобином [14, 43, 50, 51, 53, 59, 65].
Патоморфологически и патофизиологически в области перигеморрагического отека наблюдаются:
а) гипоперфузия, ишемические нарушения, нарушения ГЭБ, вазогенный отек, активация микроглии, плазморрагия, перикапиллярные кровоизлияния, апоптоз [8, 45, 48, 56, 62, 67];
б)свободнорадикальные реакции липидного переокисления [22,24,27];
в) лактат-ацидоз [62];
г) активация кининовой системы [11,23,54];
д) увеличение концентрации Са2+ в цитоплазме клетки, нарушение функции кальциевого насоса, запуск целого ряда патологических реакций, приводящих к повреждению клетки [52,61,62];
е) повышение протеолитической, фосфолипазной, металлопротеазной и NO-синтазной активности [7,26,31,32,39,62].
Объем области перифокальных изменений (перифокального отека) в совокупности с объемом НВМГ создают общий объем поражения, что во многих случаях значительно превышает объем самого кровоизлияния [4,14,21,58].
Важное клиническое значение фактор общего объема поражения приобретает у коматозных больных с НВМГ, протекающего с выраженным дислокационным синдромом, где планируется комплексное лечение [14, 47, 58].
Ряд авторов [1,5,7,10,20,23,60] в комплексное медикаментозное лечение коматозных больных с НВМГ и ЧМТ включают ингибитор протеаз контрикал, что клинически проявляется в виде повышения уровня бодрствования, положительной ЭЭГ-динамикой, нормализацией мышечного тонуса и температуры и пр. В настоящее время недостаточно изучено патоморфологическое подтверждение локального использования контрикала в полости внутримозговых гематом (ВМГ).
В свою очередь, включение в комплексное лечение антиоксидантов, в том числе жирорастворимого a-токоферола, повышает степень функционального исхода пациентов с НВМГ и сокращает сроки лечения коматозных больных в реанимационном отделении при снижении их летальности [12,13,16–19,22,33]. Однако остается неизученным влияние a-токоферола на патоморфологию острой ВМГ и ее перигеморрагического отека.
Цель исследования – клиническая и патоморфологическая оценка лечебного эффекта локального применения раствора контрикала и внутримышечных инъекций ?-токоферола в остром периоде экспериментальных ВМГ и их перигеморрагической области.
Материалы и методы
В исследовании использовали белых крыс весом 200–225 г, которым под нембуталовым наркозом в асептических условиях в правой парасагитально-теменной области пересекали кожу на протяжении 5 мм. В черепе животного делали 2-миллиметровое отверстие, которое локализовали 7 мм спереди от ламбдоидного шва и 3 мм латеральнее сагитальной линии. Из сосудов хвоста животного с помощью шприца извлекали кровь и вводили ее в мозг на глубину 3–4 мм в направлении центральных отделов полушария.
Общий объем ВМГ в нашем исследовании всегда составлял 0,3 мл, что соответствовало 15% объема головного мозга крысы [37]. Увеличение объема кровоизлияния до 0,4 мл (20% объема головного мозга) в предварительных опытах, как правило, приводило к гибели животных.
Продолжительность нашего исследования во всех случаях была равной 5 суткам, учитывая пиковые значения перигеморрагических реакций и отека головного мозга при НВМГ на 4–7-е сутки [25, 30, 48, 58].
В первой части эксперимента животным контрольной группы (8 особей) создавали ВМГ, состоящую из 0,2 мл собственной крови +0,1 мл физраствора. Крысам исследуемой группы (7 особей) физраствор заменяли аналогичным объемом раствора контрикала концентрацией 2000 ед/мл.
Во второй части эксперимента объем кровоизлияния не менялся и также составлял 0,3 мл, однако всю ВМГ (0,3 мл) составляла собственная кровь животного. Крысам контрольной группы (8 особей) ежедневно подкожно вводили 0,1 мл подогретого 10% масляного раствора ?-токоферола, что соответствовало 10 мг чистого веса вещества или около 50 мг/кг веса особи.
Дозирование a-токоферола устанавливали на основании экспериментальных работ по ишемии головного мозга у собак [34], где a-токоферол в качестве антиоксиданта назначали по 10–100 мг/кг, и клинической практики Г.В. Алексеевой (1996) [2], которая коматозным больным с постгипоксической энцефалопатией назначала до 8 мл 30% масляного раствора ?-токоферола (около 50 мг/кг) ежедневно в течение 5 суток.
После завершения эксперимента животные помещались в эксикатор и с помощью эфира забивались. Головной мозг извлекали из черепа, промывали физраствором, фиксировали 10% буферным раствором формалина и подвергали гистологическому изучению, которое было проведено в отделении патоморфологии НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН (руководитель отделения – доктор мед. наук, профессор А.Г. Коршунов).
Результаты и обсуждение
В первой части исследования, где изучалась эффективность локального применения раствора контрикала у крыс контрольной группы, в трех случаях отличалась симптоматика левостороннего гемипареза. Эти особи малоподвижно лежали, вяло реагировали на внешние раздражители, однако остались живы на момент окончания эксперимента. Остальные 5 крыс контрольной группы сохраняли малоподвижное состояние первые 2–3 суток, а далее становились более подвижными и постепенно, к концу опыта, приближались к обычному поведению.
При гистологическом исследовании мозга животных контрольной группы (рис. 1) в белом веществе больших полушарий были выявлены полости неправильной формы, содержащие остатки гемолизированной крови, локализующиеся пристеночно. Вещество мозга, формирующее стенки полости, находилось в состоянии отека в деструктивной фазе, который распространялся в виде языков вглубь мозгового вещества на расстоянии 3–4 мм.
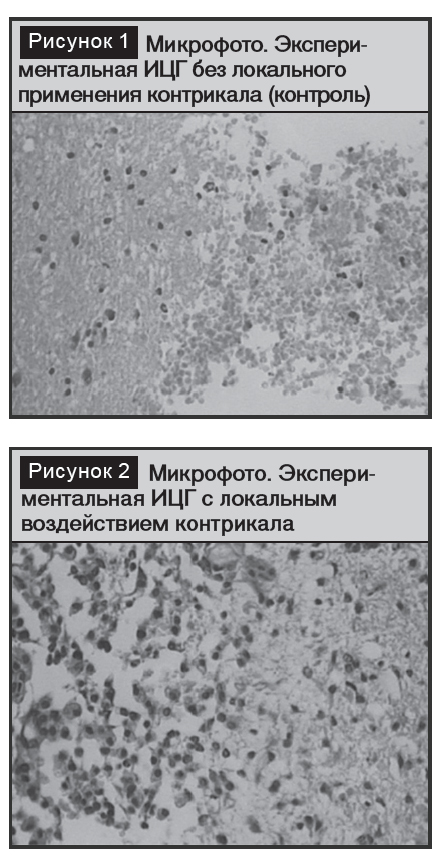
В зоне отека (перигеморрагических изменений) наблюдались сосуды с венчиком периваскулярных кровоизлияний, а также паретически расширенные сосуды с явлениями стаза эритроцитов. Изучение серии срезов позволило выявить распространение зоны перигеморрагического отека на волокна белого вещества, где она принимала периаксональную форму и местами достигала стенок боковых желудочков.
В зоне перигеморрагического отека имели место процессы резорбции деструированной мозговой ткани в виде скопления зернистых шаров, пролиферации клеток макро- и микроглии. Выраженность процессов организации некротически поврежденной ткани мозга по периферии перигеморрагического отека была неравномерной, в каких-либо топографических закономерностей выявить не удалось. В трех случаях зафиксировано проникновение крови в желудочки мозга и в субарахноидальное пространство.
Животные исследуемой группы более легко переносили экспериментальные ВМГ. Проявление кровоизлияния в виде вялости имели место лишь у одной крысы в течение первых двух суток. Поведение остальных особей не отличалось от привычного.
При гистологическом обследовании этих животных (рис. 2) также имелись полости на месте резорбированной ВМГ, но выявлены и следующие морфологические различия: а) зона перигеморрагического отека имела меньшую протяженность и не превышала 1–1,5 мм; б)в зоне перигеморрагического отека отсутствовали периваскулярные кровоизлияния и сосуды с явлениями стаза; в) отек не распространялся периаксонально; г) интенсивность проявления процессов резорбции вещества мозга была более выраженной.
Во второй части эксперимента, где изучалась эффективность внутримышечных инъекций токоферола, крысы контрольной группы были малоподвижны, вяло реагировали на принос корма, звуковые раздражители и пр. Животные не оказывали сопротивление уколам физраствора. У двух особей до конца эксперимента наблюдались признаки лево-стороннего гемипареза. За первые 2-е суток эксперимента погибли 3 крысы из 8.
Крысы исследуемой группы во время всего опыта отличались хорошей подвижностью, живо реагировали на принос корма, звуковые раздражители, сопротивлялись проводимым инъекциям ?-токоферола. Каких-либо проявлений поражения центральной нервной системы не наблюдалось. Летальные исходы отсутствовали.
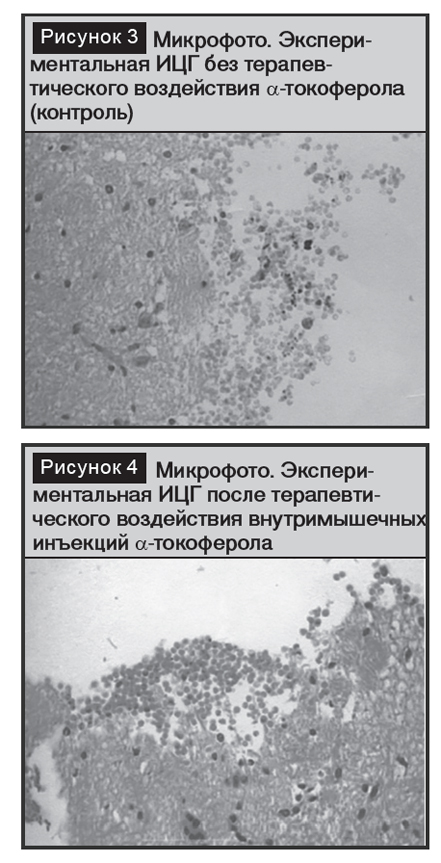
Патоморфологическая картина у животных обеих групп (рис. 3,4) полностью совпала и соответствовала описанным морфологическим изменениям у животных контрольной группы по изучению контрикала.
Наше исследование по контрикалу показало успешное длительное и локальное его применение в полости экспериментальных ВМГ с весомым уменьшением перигеморрагических реакций, что сопровождается убедительным клиническим эффектом у животных. Таким образом, дополняются сведения о возможных способах использования контрикала (кроме внутривенного): локально кратковременно при удалении НВМГ с помощью церебротомии [36]; интракаротидно [3,5]; интратекально [6]; а в качестве компонента в составе биологического клея [17,40] и гемостатического раствора тромбина – контрикала [14,16].
При использовании препарата, особенно длительном, следует учитывать и возможные побочные явления: аллергические реакции, артериальную гипотензию, артериальные и венозные тромбозы [9,60]. В кардиохирургии наблюдались и отдельные летальные исходы [55,63]. Тромбогенные свойства контрикала крайне уместны в хирургии НВМГ в ранние и сверхранние сроки [15].
Полученные результаты по ?-токоферолу показали, что препарат не влияет на патоморфологию острых экспериментальных ВМГ и их перигеморрагическую область, но показывает весомый положительный клинический эффект, по-видимому, за счет антиоксидантной протекции окружающих очаг тканей.
Клиническую эффективность антиоксидантов, в том числе и ?-токоферола, при острых НВМГ и ЧМТ подчеркивают и ряд других авторов [2,18,23,33,35,41,49]. В то же время препарат оказался неэффективным при длительном (годами) применении его с целью профилактики инсульта [28].
Выводы:
1. Локальное использование контрикала в остром периоде экспериментальных ВМГ значительным образом уменьшает степень перигеморрагических реакций, что коррелирует с убедительным терапевтическим эффектом.
2. Применение внутримышечных инъекций антиоксиданта??-токоферола в остром периоде не влияло на морфологическое течение экспериментальных ВМГ и их перигеморрагических реакций, несмотря на убедительный клинический эффект лечения, вероятно, за счет антиоксидантной протекции окружающей мозговой ткани.
Л И Т Е Р А Т У Р А
1. Авакян А.Н. // Лечащий врач. – 1998. – №6. – С.1–6.
2. Алексеева Г.В. Клиника, профилактика и терапия постгипоксических энцефалопатий: Метод. рекомендации. – М., 1996. – 40 c.
3. Алексеева Л.А., Доброгорская Л.Н., Васильева Т.Г. // Всесоюзный съезд нейрохирургов: Тезисы докладов. – М., 1988. – С.5–6.
4. Вавилов С.Б. Компьютерная томография при мозговом инсульте: Дис. ... д-ра мед. наук. – М., 1985. – 487 с.
5. Валеев Е.К. // Всесоюзный съезд нейрохирургов: Тезисы докладов. – М., 1988. – С.17–18.
6. Валеев Е.К. Клиника и лечение тяжелой чеерепно-мозговой травмы в остром периоде: Автореф. дис. ... д-ра мед. наук. – М., 1988. – 40 с.
7. Васильева Т.Г. // Съезд нейрохирургов Российской Федерации: Тезисы докладов. – Екатеринбург, 1995. – С.401.
8. Верещагин Н.В., Брагина Л.К., Вавилов С.Б., Левина Г.Я. Компьютерная томография мозга. – М., 1986. – 256 с.
9. Виленский Б.С. Неотложные состояния в неврологии. – СПб, 2006. – 512 с.
10. Виленский Б.С., Кузнецов А.Н., Виноградов О.И. Геморрагические формы инсульта: кровоизлияние в головной мозг, субарахноидальное кровоизлияние: Справочник. – СПб, 2008. – 70 с.
11. Гусев Е.И., Бурд Г.С., Чиркова Л.Д. // Невропатол. и психиатр. – 1981. – Т.81, вып.1. – С.46–52.
12. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. – М., 2001. – 328 с.
13. Гусев Е.И., Скворцова В.И., Чекнева Н.С. и др. Лечение острого мозгового инсульта (диагностические и терапевтические алгоритмы). – М., 1997. – 240 с.
14. Дзенис Ю.Л., Олманис А.Ю. // Украинский нейрохирургический журнал. – 2018. – №3. – С.5–14.
15. Дзенис Ю.Л. // Украинский нейрохирургический журнал. – 2014. – №2. – С.48–54.
16. Дзенис Ю.Л., Кадыков А.С. // Практическая неврология и нейрореабилитация. – 2008. – №4. – С.11–17.
17. Дзенис Ю.Л., Переседов В.В., Ширшов А.В. // Вопросы нейрохир. –1996. – №3. – С.35–36.
18. Жданов Г.Г., Кулигин А.В. // Вестн. интенсив. тер. – 2003. – №3. – С.40–44.
19. Кармен Н.Б. // Вестн. интенсив. тер. – 2005. – №3. – С.27–30.
20. Лунев Д.К., Лебедева Н.В. Диагностика и лечение острых нарушений мозгового кровообращения: Методические указания. – М., 1987. – 21 c.
21. Переседов В.В. Дифференцированное хирургическое лечение нетравматических супратенториальных внутримозговых кровоизлияний: Дис. ... д-ра мед. наук. – М., 1990. – 368 с.
22. Румянцева С.А., Болевич С.Б., Силина Е.В., Федин А.И. Антиоксидантная терапия геморрагического инсульта. – М., 2007. – 69 с.
23. Салалыкин В.И., Арутюнов А.И. Гипоксия головного мозга. – М., 1978. – 296 с.
24. Федорова Т.Н. Перекисное окисление липидов при ишемии мозга и возможности его фармакологической коррекции: Дис. ... канд. мед. наук. – М., 1995. – 27 c.
25. Ширшов А.В. Наружное вентрикулярное дренирование у больных с гипертензивными внутримозговыми кровоизлияниями: Автореф. дис. ... канд. мед.наук. – М., 1995. – 28 с.
26. Alvarez-Sabin J., Delgado P., Abilleira S., et al. // Stroke. – 2004. – Vol.35. – P.1316–1322.
27. Awasthi D., Church D.F., Torbati D., et al. // Surg. Neurol. – 1997. – Vol.47. – P.575–582.
28. Bath P., Albers G. Controlled Clinical Trials: Stroke. 1st ed. – London, 2001.
29. Broderick J.P., Brott T.G., Duldner J.E., Tomsick T., Huster G. // Stroke. – 1993. – Vol.24. – P.987–993.
30. Broderick J., Connolly S., Feldmann E., et al. // Stroke. – 2007. – Vol.38. – P.2001–2023.
31. Chang J.J., Emanuel B.A., Mack W.J., Tsivgoulis G., Alexandrov A.V. // J. Stroke Cerebrovasc. Dis. – 2014. – Vol.23. – P.2498–2505.
32. Florczak-Rzepka M., Grond-Ginsbach C., Montaner J., Steiner T. // Cerebrovascular Diseases. – 2012. – Vol.34. – P.249–262.
33. Duan X., Wen Z., Shen H., Shen M., Chen G. // Oxid Med Cell Longev. – 2016; 2016:1203285.
34. Fujimoto S., Mizoi K., Yoshimoto T., Suzuki J. // Surgical Neurology. – 1984. – Vol.22. – P.449–454.
35. Gilgun-Sherki Y., Rosenbaum Z., Melamed E., Offen D. // Pharmacological Reviews. – 2002. – Vol.54. – P.271–284.
36. Giromini D., Tzonos T. // Zur Prophylaxe hyperfibrinolytischer Blutungen // Fortschr. Med. – 1981. – Bd.99. – S.1153–1156.
37. Gonzalez-Darder J.M., Duran-Cabral J. Experimental intracerebral haemorrhage in normotensive and spontaneously hypertensive rats // Acta Neurochir. – 1990. – Vol.107. – P.102–107.
38. Grunwald Z., Beslow L.A., Urday S., Vashkevich A., et al. // Neurocrit. Care. – 2017. – Vol.26. – P.205–212.
39. Gu Y., Dee C.M., Shen J. // Front Biosci. (School Ed). – 2011. – Vol.3. – P.1216–1231.
40. Hamm K. -D., Steube D., Beer R., Pothe H. // Zent. bl. Neurochir. – 1987. – Vol.48. – P.206–218.
41. Hanafy K.A., Selim M.H. // Neurotherapeutics. – 2012. – Vol.9. – P.44–55.
42. Hemphill J.C., Greenberg S.M., Anderson C.S., Becker K., et al. // Stroke. – 2015. – Vol.46. – P.2032–2060.
43. Hua Y., Guohua X., Keep R., et al. // J. Neurosurg. – 2000. – Vol.92. – P.1016–1022.
44. Ironside N., Chen C.J., Ding D., Mayer S.A., et al. // Stroke. – 2019. – Vol.50. – P.1626–1633.
45. Katsu M., Niizuma K., Yoshioka H., et al. // J. Cereb. Blood Flow Metab. – 2010. – Vol.30. – P.1939–1950.
46. Keep R.F., Hua Y., Xi G. // Lancet Neurol. – 2012. – Vol.11. – P.720–731.
47. Kidwell C.S., Saver J.L., Mattiello J., Warach S., // Neurology. – 2001. – Vol.57. – P.1611–1617.
48. Kollmar R., Staykov D., Dörfler A., Schellinger P.D. // Stroke. – 2010. – Vol.41. – P.1684–1689.
49. Lapchak P., Araujo D. // Expert Opin Emerging Drugs. – 2007. – Vol.12. – P.389–406.
50. Lee K.R., Betz A.L., Keep R.F., et al. // J. Neurosurg. – 1995. – Vol.83. – P.1045–1050.
51. Lee K.R., Colon G.P., Betz A.L., et al. // J. Neurosurg. – 1996. – Vol.54. – P.91–96.
52. Lipton S.A., Rosenberg P.A. // N. Engl. J. Med. – 1994. – Vol.330. – P.613–622.
53. Lou M., Lieb K., Selim M. // Cerebrovascular Diseases. – 2009. – Vol.27. – P.266–271.
54. Maier-Hauff K., Baethmann A., Lange M., et al. // J. Neurosurg. – 1984. – Vol.61. – P.97–106.
55. Mangano D.T., Tudor I.C., Dietzel C. // New England Journal of Medicine. – 2006. – Vol.354. – P.353–365.
56. Morgenstern L.B., Hemphill J.C., Anderson C., et al. // Stroke. – 2010. – Vol.41. – P.2108–2129.
57. Murthy S.B., Urday S., Beslow L.A., et al. // J. Neurol. Neurosurg. Psychiatry. – 2016. – Vol.87. – P.1169–1173.
58. NINDS ICH Workshop Participants. Priorities for clinical research inintracerebral hemorrhage: report from a National Institute of Neurological Disorders and Stroke workshop // Stroke. – 2005. – Vol.36. – e23–41.
59. Nishino A., Suzuki M., Ohtani H., et al. // J. of Neurotrauma. – 1993. – Vol.10. – P.167–179.
60. Quiñones-Hinojosa A. Schmidek and Sweet’s Operative Neurosurgical Techniques, Sixth Edition, Elsevier Health Sciences. – 2012. – 2592 p.
61. Siesjo B.K. // J. Neurosurg. – 1992. – Vol.77. – P.169–184.
62. Siesjö B.K. // Journal of Neurosurgery. – 2008. – Vol.108. – P.616–631.
63. Slaughter T.F., Greenberg C.S. // American journal of Hematology. – 1997. – Vol.56. – P.32–36.
64. Urday S., Kimberly W.T., Beslow L.A., et al. // Nat. Rev. Neurol. – 2015. – Vol.11. – P.111–122.
65. Venkatasubramanian C., Mlynash M., Finley-Caulfield A., et al. // Stroke. – 2011. – Vol.42. – P.73–80.
66. Wu T.Y., Sharma G., Strbian D., et al. // Stroke. – 2017. – Vol.48. – P.873–879.
67. Zazulia A.R., Diringer M.N., Videen T.O., et al. // J. Cereb. Blood Flow Metab. – 2001. – Vol.21. – P.804–810.
Медицинские новости. – 2020. – №9. – С. 83-86.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.