Внимание! Статья адресована врачам-специалистам
Julia Benesh, Dentist of the 11th City Clinical Dental Clinic, Minsk, Belarus
Lyudmila Kazeko, PhD, Associate Professor, Head of the 1st Department of Therapeutic Dentistry
of the Belarusian State Medical University, Minsk
Matrix metalloproteinases as a potential diagnostic marker in oncopathology of the oral mucosa. Part 1
Резюме. В настоящее время исследования рака направлены на понимание функциональных механизмов, лежащих в основе трансформации клеток и прогрессирования опухоли, которые могут быть использованы для разработки новых маркеров и методов лечения. Риск предракового прогрессирования связан с гистологической оценкой, однако невозможно точно предсказать, какие поражения малигнизируются, более того, легкие формы дисплазии могут быть не выявлены, что диктует необходимость разработки более точных методов ранней диагностики новообразований слизистой оболочки полости рта.
Ключевые слова: матриксные металлопротеиназы, злокачественная трансформация, онкомаркер, плоскоклеточный рак.
Современная стоматология. – 2020. – №4. – С. 6–9.
Summary. Cancer research is currently focused on understanding the functional mechanisms underlying cell transformation and tumor progression, which can be used to develop new markers and therapies. The risk of precancerous progression is associated with histological assessment, it is currently impossible to accurately predict which lesions become malignant, moreover, mild forms of dysplasia may not be detected. This dictates the need to develop more accurate methods for early diagnosis of the oral mucosa neoplasms.
Keywords: matrix metalloproteinases, malignant transformation, tumor marker, squamous cell carcinoma.
Sovremennaya stomatologiya. – 2020. – N4. – P. 6–9.
Карцинома (рак) – это вид злокачественной опухоли, развивающейся из клеток эпителиальной ткани различных органов (кожи, слизистых оболочек и многих внутренних органов). Рак является второй из основных причин смерти после сердечно-сосудистых заболеваний во всем мире. По данным Всемирной организации здравоохранения, в 2018 году число смертей от рака составило 9,6 млн. Так, данный вид злокачественной опухоли становится причиной практически каждой шестой смерти в мире. Рак слизистой оболочки полости рта среди злокачественных новообразований занимает 6-е место по распространенности [2].
Среди различных стран заболеваемость злокачественными новообразованиями губы, языка, рта и глотки колеблется в достаточно широких пределах. В Беларуси уровень заболеваемости выше, чем в других государствах Европы, Канаде и США. В структуре злокачественных опухолей органов полости рта ведущее место занимают эпителиальные, в 90–95% случаев они имеют строение плоскоклеточного ороговевающего рака [1, 3].
Беларусь за счет достаточно быстрого роста заболеваемости вошла в группу стран с высоким риском развития злокачественных новообразований губы, языка, полости рта и глотки. При этом отмечаются низкие уровни заболеваемости среди женщин и высокие – среди мужчин [3].
В структуре общей онкологической заболеваемости доля пациентов со злокачественными новообразованиями губы, языка, рта и глотки в Беларуси в 2018 году составила 3,34% среди всех злокачественных опухолей. Наиболее высокую заболеваемость продолжает представлять рак слизистой оболочки рта, включая дно, небо и десны (21,2%), языка (16,5%), ротоглотки (14,5%), миндалин (11,1%) [3].
Несмотря на значительный прогресс в лечении в последние десятилетия, прогноз выживаемости пациентов напрямую зависит от того, на какой стадии было выявлено заболевание. Хотя полость рта и является доступной зоной для визуального осмотра, наиболее часто новообразование обнаруживают на последних стадиях, что является основной причиной высокой летальности данной группы пациентов. Напротив, при свое-временной диагностике рак можно выявить на потенциально излечимой стадии, что повысит выживаемость и улучшит качество жизни.
Согласно данным канцер-регистра, в последнем пятилетии уменьшилась доля случаев ранней и своевременной диагностики (32% выявлено на 1-й и 2-й стадиях) и значительно, в 1,4 раза, увеличилось число новообразований в терминальных стадиях (35,8% в 4-й стадии). Указанные изменения свидетельствуют о необходимости принятия неотложных мер по организации своевременного выявления опухолей губы, языка, рта и глотки [3].
Во многих странах отношение показателей смертности к заболеваемости весьма высокое, что свидетельствует о?сложности радикального лечения злокачественных новообразований большинства указанных локализаций. В Беларуси данный показатель составил 53,6%, что в 1,5–2 раза выше, чем в ряде европейских стран, но ниже, чем в восточно-европейском регионе [3].
Успех в борьбе с раком в большей степени зависит от уровня диагностики злокачественных опухолей. Согласно руководству Всемирной организации здравоохранения по ранней диагностике рака, наиболее эффективными с точки зрения благоприятного исхода лечения и экономической эффективности является ранняя диагностика и скрининг.
Злокачественному новообразованию обычно предшествуют предраковые поражения, такие как лейкоплакия, эритроплакия, плоский лишай, оральный субмукозный фиброз и др., протекающие с различной скоростью трансформации, в зависимости от типа поражения и предрасполагающих факторов [9].
Малигнизации новообразования предшествует период, в течение которого в пораженном эпителии можно обнаружить гистологические признаки эпителиальной дисплазии. Рак полости рта проходит через ряд гистопатологических стадий от доброкачественной гиперплазии и дисплазии до карциномы in situ и инвазивной карциномы. Было доказано, что риск малигнизации некоторых предраковых заболеваний коррелирует со степенью эпителиальной дисплазии. Традиционным методом диагностики патологии, помимо клинического обследования, является гистологическое исследование биоптатов. Однако метод не лишен недостатков, которые сказываются на точности исследования. Сложность забора материала для исследования и субъективная оценка биоптата влекут за собой возможные диагностические ошибки. Это диктует необходимость разработки более точных методов ранней диагностики новообразований слизистой оболочки полости рта.
В последние годы внимание исследователей сместилось на внутренние факторы, связанные с организмом, которые играют ключевую роль в определении злокачественной трансформации. Сегодня в современной литературе предложены более 100 потенциальных биомаркеров плоскоклеточного рака слизистой оболочки полости рта [4]. Одним из важных факторов, влияющих на злокачественную прогрессию и последующую инвазию, является семейство белков, называемых матриксными металлопротеиназами (ММП).
Таблица. Классификация и субстратная специфичность ММП
|
Наименование
|
Расщепляемый субстрат
|
|
Коллагеназы
|
ММП-1
(коллагеназа-1)
|
Коллаген I, II, III, VII, X типа, желатин, ММП-2, ММП-9
|
|
ММП-8
(коллагеназа-2)
|
Коллаген I, II, III, V, VII, VIII, X типа, аггрекан, эластин, фибронектин, желатин, ламинин, фибриноген
|
|
ММП-13
(коллагеназа-3)
|
Коллаген I, II, III, IV, XIV типа, аггрекан, желатин
|
|
Стромелизины
|
ММП-3
(стромелизин-1)
|
Фибронектин, ламинин, желатин I, III, IV, V типа, аггрекан, коллаген II, III, IV,IX, XI типа, протеогликан, ММП-7, ММП-8, ММП-13
|
|
ММП-10
(стромелизин-2)
|
Фибронектин, желатин I, III, IV, V типа, коллаген III, IV, V типа, аггрекан, эластин, ламинин, ММП-1, ММП-8
|
|
Желатиназы
|
ММП-2
(желатиназа А)
|
Желатин I типа, коллаген I, II, III, IV, V, VII, X, XI типа, аггрекан, эластин, фибронектин, ламинин, протеогликан, ММП-9, ММП-13
|
|
ММП-9
(желатиназа В)
|
Желатин I, V типа, коллаген IV, V типа, фибронектин, аггрекан, эластин
|
|
Матрилизины
|
ММП-7
(матрилизин-1)
|
Казеин, желатин I, III, IV, V типа, фибронектин, коллаген IV, X типа, аггрекан, эластин, ламинин, протеогликан, ММП-1, ММП-2, ММП-9
|
|
ММП-26
(матрилизин-2)
|
Коллаген IV типа, фибронектин, желатин I типа
|
Дляпоискалитературы, посвященнойисследованиямвлиянияММПнаонкогенез, былаиспользованаэлектроннаясистема PubMed/MEDLINE, содержащаябазыданных National Center for Biotechnology Information, U.S. National Library of Medicine, Institute for Clinical Systems Improvement (ICSI), National Institute for Health and Clinical Excellence. Поиск отдельных данных в интернете проводился с помощью поисковой системы www.google.com. Поиск осуществлялся по ключевым словам: «матриксные металлопротеиназы», «ММП», «карцинома», «экспрессия». Для анализа были отобраны современные научные источники не старше 10–15 лет. В результате из 3 356 найденных в системе источников для исследования было отобрано и проанализировано 34.
Матриксные металлопротеиназы: классификация, строение, секреция и?регуляция
ММП представляют собой семейство кальций- (Ca2+) и цинк-(Zn2+) зависимых протеолитических ферментов, участвующих в физиологических и патологических процессах в организме человека. ММП имеют широкий спектр биологических субстратов (таблица). Известно, что многие протеазы участвуют в ремоделировании внеклеточного матрикса, но главенствующая роль принадлежит ММП [10].
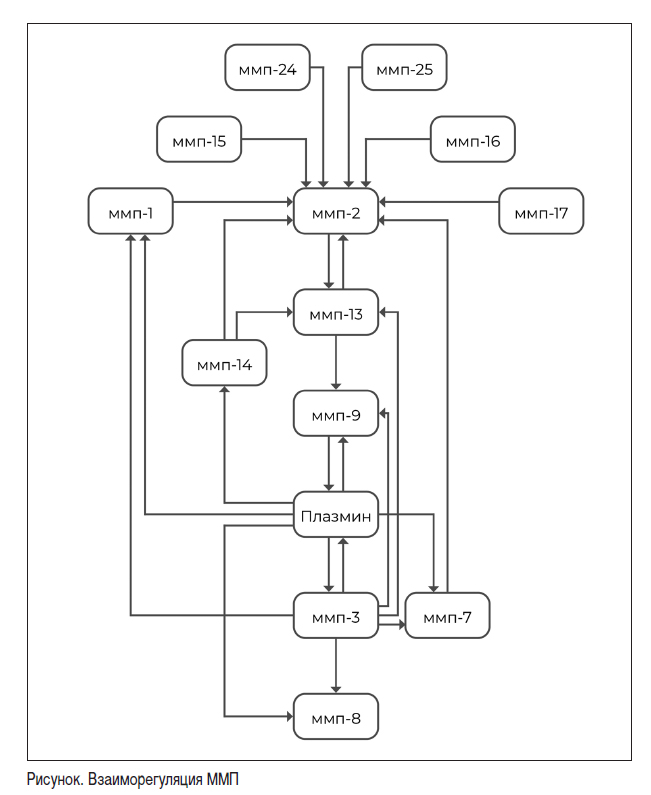
ММП были впервые обнаружены в 1962 году Gross и Lapiere в хвосте головастика во время метаморфоза лягушки. Эти ферменты были признаны основными протеолитическими ферментами для регуляции деградации экстрацеллюлярного матрикса. Первоначально считалось, что они разрушают только компоненты экстрацеллюлярного (внеклеточного) матрикса (ЭЦМ), но в настоящее время хорошо известно, что они обладают более широкой субстратной специфичностью, которая включает нематриксные белки, подавляющее большинство которых представляют собой биоактивные молекулы. Помимо их функции ремоделирования тканей, ММП также участвуют в регуляции многих нематриксных мишеней, таких как рецепторы клеточной поверхности, молекулы клеточной адгезии, цитокины, факторы свертывания крови, хемокины и другие протеиназы (рисунок) [10, 18].
До настоящего времени было идентифицировано около 26 ММП, и большинство из этих ферментов присутствуют в протеоме человека [6]. Наиболее распространенная классификация основана на их субстратной специфичности и базовой доменной структуре. В соответствии с этими критериями ММП подразделяются на коллагеназы (ММП-1, ММП-8 и ММП-13), желатиназы (ММП-2 и ММП-9), стромелизины (ММП-3, ММП-10 и ММП-11), матрилизины (ММП-7 и ММП-26), ММП мембранного типа (ММП-14, ММП-15, ММП-16, ММП-17, ММП-24 и ММП-25) и другие (ММП-12, ММП-19, ММП-20, ММП-21, ММП-23, ММП-27 и ММП-28) [10, 19].
Типичная структура ММП состоит из N-концевого зимогенного пропептидного домена (около 80 аминокислот), металлзависимого каталитического домена (около 170 аминокислот), линкерной области (около 15–65 аминокислот) и С-концевого гемопексин-подобного домена (?200 аминокислот).
Все ММП продуцируются в виде проферментов и требуют протеолитического расщепления в физиологических условиях, чтобы способствовать высвобождению пропептидного домена (активация зимогена). Это означает, что активность ММП регулируется посттрансляционным протеолитическим расщеплением и эндогенными ингибиторами [13].
Роль ММП в физиологических процессах
ММП играют важную роль в различных физиологических процессах, включая развитие, заживление ран, ремоделирование тканей, морфогенез органов, ангиогенез и т.д. В нормальном физио-логическом состоянии ММП строго регулируются и экспрессируются на низком уровне. Нарушение регуляции и избыточная экспрессия этих ферментов связаны с различными заболеваниями, включая нейродегенеративные, сердечно-сосудистые заболевания, болезни легких, артрит, расстройства центральной нервной системы, включая эпилепсию и т.д. [15].
Роль ММП в онкогенезе
В настоящее время исследования рака направлены на понимание функциональных механизмов, лежащих в основе трансформации клеток и прогрессирования опухоли, которые могут быть использованы для разработки новых маркеров и методов лечения. Молекулярные механизмы, участвующие в неопластических процессах, по-прежнему изучены недостаточно. Развитие опухоли зависит от нескольких этапов, включая деградацию базальной мембраны и внеклеточного матрикса, ангиогенез. Кроме того, процесс злокачественной трансформации из предраковых состояний в плоскоклеточный рак сложен и?регулируется многими факторами.
Регулируя структуру и состав ЭЦМ, ММП участвуют в доступности факторов роста и играют основную роль в функционировании систем сигнализации на клеточной поверхности, таким образом, влияют на пролиферацию, миграцию, дифференцировку и апоптоз [5].
Экспрессия ММП в опухолевых клетках способствует ремоделированию ЭЦМ и высвобождает мембраносвязанные факторы роста для формирования микроокружения для онкогенеза. Раковые клетки паракринным способом, секретируя интерлейкин, интерферон, факторы роста и внеклеточные MMП-индукторы, стимулируют окружающие клетки к секреции необходимых MMП. ММП, секретируемые нормальными клетками, могут быть связаны на поверхности раковых клеток и использоваться опухолевыми клетками. Они участвуют во всех этапах канцерогенеза [11, 12].
Ангиогенез необходим для роста и развития опухолевых клеток. Некоторые компоненты ЭЦМ, такие как фибронектин, тромбоспондин-1, ламинин и остеопонтин, влияют на фенотип опухоли путем модуляции миграции раковых клеток и ангиогенеза. ММП стимулируют ангиогенез, разрушая базальную мембрану и компоненты ЭЦМ. Из-за разрушения базальной мембраны эндотелиальная клетка мигрирует из существующего сосуда и воспроизводит новый кровеносный сосуд [8].
ММП могут ингибировать механизм ангиогенеза путем деградации плазминогена с высвобождением ангиостатина, а также расщепляя коллаген XVIII типа с образованием эндостатина. ММП-2, -7, -9 и -12 помогают в расщеплении плазминогена для высвобождения ангиостатина. Полученный ангиостатин может усиливать апоптоз в опухолевых клетках [8].
Метастазирование рака, последний этап прогрессирования опухоли и ведущая причина заболеваемости и смертности от рака, включает распространение раковых клеток из первичной опухоли в близлежащие ткани и отдаленные органы; оно опосредовано сложными молекулярными изменениями регуляции клеточного цикла [13, 14, 17]. Молекулярные изменения, которые регулируют морфологию клеток и функции эпителиальных клеток, то есть эпителиально-мезенхимальный переход (ЭМП), включают разрушение межклеточных связей и адгезионных характеристик клеточного матрикса, разрушение внеклеточного матрикса (ЭЦМ) и расщепление компонентов базальной мембраны с помощью секреции ММП. Когда эпителиальные клетки теряют свою полярность из-за ЭМП, теряются плотные соединения между клетками и адгезивные соединения, что приводит к инфильтрации и повышению способности этих клеток к миграции [13, 16, 20]. Следовательно, ЭМП позволяет злокачественным клеткам становиться подвижными и инвазивными, что является фундаментальной предпосылкой для метастазирования рака [7, 13].
Разработка новых методов диагностики на основании изучения уровня экспрессии ММП при патологии слизистой оболочки полости рта является перспективным направлением исследований. Обнаружение в биоптатах и оценка экспрессии матриксных металлопротеиназ в измененном эпителии потенциально могут быть использованы в качестве диагностических онкомаркеров для определения риска малигнизации и метастазирования опухолей.
ЛИТЕРАТУРА / REFERENCES
1. Belocerkovskij I.V., Zhukovec A.G., Tatchihin V.V. Rak slizistoj obolochki polosti rta (sovremennye principy diagnostiki i lechenija) [Oral mucosa cancer (modern principles of diagnosis and treatment)]. Stomatologicheskij zhurnal, 2006, vol.2, pp.120–123. (in Russian).
2. Jatin P. Sha, Sneal G. Patel, Singh Buvanesh. Hirurgija i onkologija golovy i shei [Head and Neck Surgery and Oncology]. Pod red. I.V. Reshetova. M.: Tehnologija, 2016, 838 p. (in Russian).
3. Rak v Belarusi: cifry i fakty. Analiz dannyh Belorusskogo kancer-registra za 2009—2018 gg. [Cancer in Belarus: figures and facts. Analysis of data of the Belarusian cancer register for 2009?2018] / A.E. Okeanov [i dr.]; pod red. O.G. Sukonko. Minsk: Nac. b-ka Belarusi, 2019, 420 p. (in Russian).
4. Cheng Y.S., Rees T., Wright J. A review of research on salivary biomarkers for oral cancer detection. Clin Transl Med, 2014, vol.3, no.1, p.3.
5. Egeblad M., Werb Z. New functions for the matrix metalloproteinases in cancer progression. Nature Reviews Cancer, 2002, vol.2, pp.161–174.
6. Fields G.B. New strategies for targeting matrix metalloproteinases. Matrix Biol, 2015, pp.239–246.
7. Horejs C.M. Basement membrane fragments in the context of the epithelial-to-mesenchymal transition. Eur J Cell Biol, 2016, vol.95, pp.427–440.
8. Jablonska-Trypuc A., Matejczyk M., Rosochacki S. Matrix metalloproteinases (MMPs), the main extracellular matrix (ECM) enzymes in collagen degradation, as a target for anticancer drugs. J Enzym Inhib Med Chem, 2016, vol.31, pp.177–183.
9. Kuffer R., Lombardi T. Premalignant lesions of the oral mucosa. A discussion about the place of oral intraepithelial neoplasia (OIN). Oral Oncol, 2002, vol.38, pp.125–130.
10. Li K., Tay F.R., Yiu C.K.Y. The past, present and future perspectives of matrix metalloproteinase inhibitors. Pharmacology & Therapeutics, 2020, vol.207, p.107465.
11. Liu Y., Liu H., Luo X., et al. Overexpression of SMYD3 and matrix metalloproteinase-9 are associate with poor prognosis of patients with gastric cancer. Tumor Biol, 2015, vol.36, pp.4377–4386.
12. Mondal S., Adhikari N., Banerjee S., Amin S.A., Jha T. Matrix metalloproteinase-9 (MMP-9) and its inhibitors in cancer: A minireview. Eur J Med Chem, 2020, vol.194, p.112260.
13. Quintero-Fabián S., Arreola R., Becerril-Villanueva E., et al. Role of Matrix Metalloproteinases in Angiogenesis and Cancer. Front Oncol, 2019, vol.9, p.1370.
14. Seyfried T.N., Huysentruyt L.C. On the origin of cancer metastasis. Crit Rev Oncog, 2013, vol.18, pp.43–73.
15. Shiomi T., Lemaitre V., D’Armiento J., Okada Y. Matrix metalloproteinases, a disintegrin and metalloproteinases, and a disintegrin and metalloproteinases with thrombospondin motifs in non-neoplastic diseases. Pathology International, 2010, vol.60, pp.477–496.
16. Thiery J.P. Epithelial-mesenchymal transitions in tumour progression. Nat Rev Cancer, 2002, vol.2, pp.442–454.
17. Valastyan S., Weinberg R.A. Tumor metastasis: molecular insights and evolving paradigms. Cell, 2011, vol.147, pp.275–292.
18. Vanlaere I., Libert C. Matrix metalloproteinases as drug targets in infections caused by gram-negative bacteria and in septic shock. Clinical Microbiology Reviews, 2009, vol.22, pp.224–239.
19. Visse R., Nagase H. Matrix metalloproteinases and tissue inhibitors of metalloproteinases: structure, function and biochemistry. Circulation Research, 2003, vol.92, pp.827–839.
20. Yu D., Ye T., Xiang Y., Shi Z., Zhang J., Lou B., et al. Quercetin inhibits epithelial-mesenchymal transition, decreases invasiveness and metastasis, and reverses IL-6 induced epithelial-mesenchymal transition, expression of MMP by inhibiting STAT3 signaling in pancreatic cancer cells. Onco Targets Ther, 2017, vol.10, pp.4719–4729.
Конфликт интересов
Согласно заявлению автора, конфликт интересов отсутствует.
Современная стоматология. – 2020. – №4. – С.6-9.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.