Внимание! Статья адресована врачам-специалистам
Mozejko L.F., Poukh M.A.
Belarusian State Medical University, Minsk
The use of estradiol metered-dose transdermal spray in clinical practice
Резюме. Обследованы 34 женщины с менопаузальной симптоматикой. Все пациентки получали трансдермальный точнодозированный спрей «Лензетто» (эстрадиол гемигидрат 1,53 мг (1,7%) от одной (1,53 мг) до трех (4,59 мг) доз в сутки в течение 6 месяцев). Эффективность терапии оценивалась на 1-м (до начала лечения), 2-м (после 1 месяца) и 3-м (после 6 месяцев применения спрея) визитах с помощью балльной оценки по опроснику «Менопаузальная рейтинговая шкала» (MRS).
Выявлена эффективность терапии трансдермальным спреем «Лензетто» – на протяжении полугода составила 76,23%. Проведенное наблюдение позволило сделать вывод о высоком терапевтическом эффекте в отношении соматовегетативной и урогенитальной симптоматики. Серьезных нежелательных явлений зафиксировано не было.
Ключевые слова: менопауза, менопаузальная гормональная терапия, эстрадиол, дозированный трансдермальный спрей.
Медицинские новости. – 2020. – №12. – С. 52–55.
Summary. The main aim of the study was the evaluation of the efficacy and drug safety of estradiol metered-dose transdermal spray Lenzetto (estradiol hemihydrate 1.53 mg (1.7%)). Thirty-four women with menopausal symptoms were enrolled in the study. Lenzetto was administrated from 1 to 3 doses per day during 6 months. The efficacy was evaluated using a score the Menopausal Rating Scale (MRS).
The results indicate the efficacy of Lenzetto in outpatients with menopausal symptoms. It was demonstrated that Lenzetto led to reduce somatic and urogenital symptoms. Clinical effect was higher in patients after stroke. Lenzetto was well tolerated.
Keywords: menopause, menopausal hormone therapy, estradiol, metered-dose transdermal spray.
Meditsinskie novosti. – 2020. – N12. – P. 52–55.
Наряду с увеличением продолжительности жизни женского населения возрастает актуальность и медико-социальная значимость проб-лемы эстроген-дефицитных состояний у женщин, на фоне которых возрастает общая заболеваемость и смертность. Несмотря на то, что переход женщин из репродуктивного периода в постменопаузальный является естественным и необратимым процессом, не у всех он протекает физиологично. Вследствие эстроген-дефицитного состояния, в первую очередь, страдает функционирование эстроген-зависимых органов и систем [1].
Время наступления естественной менопаузы для населения европеоидной расы составляет в среднем 50–52 года. Установлено, что менопаузе предшествует период менопаузального перехода, начинающийся в среднем в возрасте 45,5–47,5 лет, во время которого происходят изменения чувствительности рецепторов к гонадотропным гормонам, вариабельная секреция гонадотропинов с широким диапазоном уровней гормонов [15]. Наиболее значительные гормональные изменения происходят в последние 2 года менопаузального перехода и первые 2 года после менопаузы, что проявляется резким снижением циркулирующего эстрадиола [10, 19]. Вместе с тем, ввиду несовершенной адаптации организма к физиологическому выключению функции яичников, именно в период менопаузального перехода происходит манифестация менопаузальной клинической симптоматики, которая может появляться за 5–6 лет до последней менструации и сохраняться на протяжении 10–15 лет постменопаузального периода [10, 15, 19]. В этот период до 80% женщин испытывают характерные проявления вазомоторной симптоматики – приливы жара и ночную потливость. Причем, в течение первых 2 лет после менопаузы приливы жара сохраняются у большинства женщин, на протяжении 8–10 лет, варьируя от умеренной до тяжелой степени, оказывая негативное влияние на здоровье и качество жизни [4, 5]. Кроме типичных вазомоторных проявлений, наблюдаются изменения центральной нервной системы, включающие беспокойство, раздражительность, снижение концентрации внимания, бессонницу, депрессию, болезнь Альцгеймера, характерны проблемы с кожей и ее придатками (сухость кожи, появление морщин, ломкость ногтей, сухость и выпадение волос), урогенитальные расстройства (сухость влагалища, диспареуния, зуд и жжение, уретральный синдром, цисталгия, нередко недержание мочи). Постменопаузальный период также связан с высоким риском развития сердечно-сосудистой патологии и остеопороза. При этом потеря костной массы ускоряется в конце менопаузального перехода и продолжается в течение первых нескольких лет после менопаузы [6, 12].
С целью коррекции эстроген-дефицитных состояний патогенетически обосновано назначение менопаузальной гормональной терапии (МГТ) [12]. Доказано, что МГТ является наиболее эффективной в лечении вазомоторных симптомов и урогенитальной атрофии, а также способствует облегчению других менопаузальных симптомов (эмоциональная лабильность, суставные и мышечные боли, нарушение сна и др.) [8]. Кроме того, применение МГТ способствует профилактике остеопороза, колоректального рака, сахарного диабета 2-го типа. Также отмечено уменьшение риска развития ишемической болезни сердца и болезни Альцгеймера при своевременном назначении терапии во время «окна терапевтических возможностей», которое включает менопаузальный переход и 10 лет после наступления менопаузы [6, 12, 13, 16].
Эффективным компонентом МГТ в указанных случаях является эстрогеновый компонент. Необходимо достичь таких оптимальных концентраций гормонов в крови, которые улучшили бы общее состояние, обеспечили профилактику поздних обменных нарушений и не вызвали побочных эффектов. Тем не менее, вероятность возникновения побочных эффектов при МГТ обусловливает необходимость использования минимально эффективной дозы гормонов [6].
Женщинам с интактной маткой необходима эстроген-прогестагенная гормональная терапия, поскольку как стандартные, так и низкие дозы эстрогенов способствуют гиперплазии эндометрия. Прогестины вводят циклически или непрерывно. При циклическом применении фаза прогестагена должна составлять 12–14 дней за цикл, чтобы обеспечить достаточную защиту эндометрия [16]. Среди пероральных форм наиболее благоприятным профилем безопасности обладает дезогестрел в дозе 150 мкг (2 таблетки лактинета в сутки) на протяжении 14-ти дней или дезогестрел в дозе 75 мкг (1 таблетка лактинета в сутки) в непрерывном режиме. Следует отметить, что прием дезогестрела в непрерывном режиме (75 мкг дезогестрела в сутки) кроме профилактики гиперплазии эндометрия (при МГТ) обеспечивает женщине надежную контрацептивную защиту от наступления нежелательной беременности и использование каких-либо дополнительных средств или методов контрацепции в этом случае не требуется. Женщинам с удаленной маткой назначается монотерапия эстрогенами [6, 12].
Эстрогены можно вводить перорально, трансдермально, внутримышечно, интраназально, подкожно или местно (вагинально) с дозами и сроками, адаптированными к каждому пациенту. В свою очередь имеются отличия во влиянии на организм экзогенных эстрогенов в зависимости от пути введения. Предпочтительным считается применение трансдермальных форм эстрогенов, когда активное вещество попадает непосредственно в большой круг кровообращения [2, 3]. Преимущества заключаются в отсутствии эффекта первичного прохождения через печень, что предотвращает ее повреждение, способствует большей биодоступности лекарственного средства, долгосрочному балансу эстрогенов и сохранению физиологического соотношения эстрадиола и эстрона (0,7), когда при пероральном приеме происходит повышенное образование эстрона [14]. Прием пероральных эстрогенов сопряжен с небольшим увеличением массы тела и уменьшением мышечной массы, в то время как применение трансдермальных форм не влияет на мышечную массу и жировую ткань. Трансдермальные формы эстрогенов можно назначать пациентам с непереносимостью перорального применения, нарушениями функционирования печени, гипертриглицеридемией, сахарным диабетом. Трансдермальные эстрогены практически не влияют на факторы свертывания крови, липопротеины, глобулин, связывающий половые гормоны, печеночные ферменты и С-реактивный белок [14]. Ряд исследований свидетельствует о снижении или даже отсутствии риска развития тромбоэмболических осложнений при применении трансдермального эстрадиола в сравнении с использованием пероральных форм [7, 11].
Трансдермальные системы обеспечивают терапевтические уровни циркулирующего эстрадиола и демонстрируют клиническую эффективность в более низких, чем при пероральном приеме, дозах эстрогенов, что может быть связано с меньшим количеством взаимопревращений в пулы эстрона и эстрона сульфата. Таким образом, трансдермальный эстрадиол в настоящее время является лучшим в стратегии достижения стандарта «минимально возможная доза» при лечении менопаузальной симптоматики [9, 17, 18].
Проведено выборочное проспективное открытое исследование с целью оценки эффективности трансдермального спрея эстрадиола (Лензетто). Обследовано 34 женщины, из них 9 находились в перименопаузе, 25 – в постменопаузе. Возраст женщин варьировал от 45 до 57 лет (в среднем – 52,7±2,11 года). Средний возраст наступления менопаузы составил 50,4±0,5 года, средняя продолжительность эстроген-дефицитного состояния – 3,5±1 (от 2 до 5 лет). У женщин в перименопаузе в течение года были нерегулярные менструации с периодами аменореи 65±5,8 дня, средний уровень ФСГ составил 56 МЕ/л.
Критериями включения в исследование являлись возраст 45–57 лет, наличие жалоб климактерического характера, отсутствие психических расстройств и заболеваний, требующих госпитализации в период наблюдения. В исследование не включались женщины при наличии противопоказаний к назначению менопаузальной гормональной терапии.
До начала лечения всем пациенткам проводилось цитологическое исследование мазков, УЗИ органов малого таза, обследование молочных желез (пальпация, маммография), биохимический анализ крови (липидограмма, глюкоза, печеночные ферменты), гемостазиограмма с D-димерами, определение уровня витамина D, остеоденситометрия, гормональное исследование по показаниям.
Тяжесть климактерического синдрома оценивалась по опроснику «Менопаузальная рейтинговая шкала» (MRS), который включает в себя балльную оценку (от 0 до 4 баллов) соматовегетативных, психоэмоциональных и урогенитальных проявлений (табл. 1).
Таблица 1. Менопаузальная рейтинговая шкала (MRS)
|
Симптом
|
Выраженность
|
|
Соматовегетативные симптомы
Приливы жара, потливость
Дискомфорт в области сердца
Нарушение сна
Мышечно-суставные боли
|
Очень сильно – 4 балла
Сильно – 3 балла
Средняя – 2 балла
Минимальная – 1 балл
Нет – 0
|
|
Психоэмоциональные симптомы
Депрессивное настроение
Раздражительность
Тревога
Физическое и психическое истощение
|
|
Урогенитальные симптомы
Сексуальные проблемы
Расстройства мочеиспускания
Сухость влагалища
Средний менопаузальный индекс
|
|
Результатом является суммарная выраженность симптомов: 33–44 балла – климактерический синдром тяжелой степени тяжести; 23–32 балла – климактерический синдром средней степени тяжести; 1–22 – климактерический синдром легкой степени тяжести
|
Оценку состояния пациенток проводили до лечения, через 1 и 6 месяцев применения лензетто. Оценку переносимости лензетто проводили с использованием шкалы побочной симптоматики.
Вне зависимости от длительности эстроген-дефицитного состояния и степени тяжести климактерического синдрома всех женщин беспокоили приливы жара и ночная потливость (от 10 до 30 раз в сутки), а также психоэмоциональная симптоматика (раздражительность, сонливость, тревога, депрессия).
Кроме того, женщины в перименопаузе (с сохраненным менструальным циклом) часто предъявляли жалобы обменно-эндокринного характера: прибавку массы тела на три и более килограмма отметили 7 из 9 (77,78%) женщин, боли в мышцах и суставах – 6 из 9 (66,6%) женщин. Пациентки в постменопаузе испытывали проявления генитоуринарного синдрома: зуд и жжение в области вульвы и влагалища – у 22 из 25 (88%) женщин, диспареуния – у 14 (56%), учащенное и болезненное мочеиспускание – у 8 (32%) женщин, цисталгия – у 5 (20%), недержание мочи (стрессовое, ургентное) – у 3 (12%).
Согласно менопаузальной шкале MRS, симптоматика средней степени тяжести имела место у 20 (58,8%) пациенток, легкой – у 14 (41,2%). В среднем тяжесть течения по шкале составила 22,03±2,5 балла, что указывало на легко-среднюю степень выраженности климактерического синдрома (табл. 2).
Таблица 2. Менопаузальная симптоматика в баллах по менопаузальной шкале MRS
|
Менопаузальная
рейтинговая шкала
|
Начало лечения
|
1 месяц лечения
|
6 месяцев лечения
|
Общее
улучшение через
6 месяцев (%)
|
p
|
|
Соматовегетативные симптомы
|
9,74
|
5,50
|
1,911
|
80,37%
|
<0,001
|
|
Приливы жара, потливость
|
3,15
|
1,38
|
0,47
|
85,06%
|
<0,001
|
|
Дискомфорт в области сердца
|
1,85
|
1,38
|
0,44
|
76,15%
|
<0,001
|
|
Нарушение сна
|
2,76
|
1,68
|
0,44
|
84,02%
|
<0,001
|
|
Мышечно-суставные боли
|
1,97
|
1,06
|
0,56
|
71,63%
|
<0,001
|
|
Психоэмоциональные симптомы
|
8,29
|
5,68
|
2,38
|
71,26%
|
<0,001
|
|
Депрессивное настроение
|
1,62
|
1,09
|
0,53
|
67,32%
|
<0,001
|
|
Раздражительность
|
2,21
|
1,68
|
0,68
|
69,39%
|
<0,001
|
|
Тревога
|
2,44
|
1,29
|
0,56
|
77,10%
|
<0,001
|
|
Физическое и психическое истощение
|
2,03
|
1,62
|
0,62
|
69,57%
|
<0,001
|
|
Урогенитальные симптомы
|
4,0
|
2,18
|
0,94
|
76,50%
|
<0,001
|
|
Сексуальные проблемы
|
1,24
|
0,94
|
0,38
|
69,17%
|
<0,001
|
|
Расстройства мочеиспускания
|
0,62
|
0,47
|
0,29
|
52,56%
|
<0,001
|
|
Сухость влагалища
|
2,14
|
0,76
|
0,26
|
87,63%
|
<0,001
|
|
Средний менопаузальный индекс
|
22,03
|
13,35
|
5,24
|
76,23%
|
<0,001
|
Всем женщинам было показано применение 1 дозы лензетто (1,53 мг эстрадиола) 1 раз в сутки в непрерывном режиме. В случае недостаточной эффективности в течение месяца рекомендовалось увеличить дозу до 2 нанесений (3,06 мг), а также до 3 нанесений (4,59 мг) через месяц после применения двух доз. В 28 (85,3%) случаях женщинам с интактной маткой назначали дезогестрел 150 мкг в течение 14 дней ежемесячно с целью профилактики гиперплазии эндометрия.
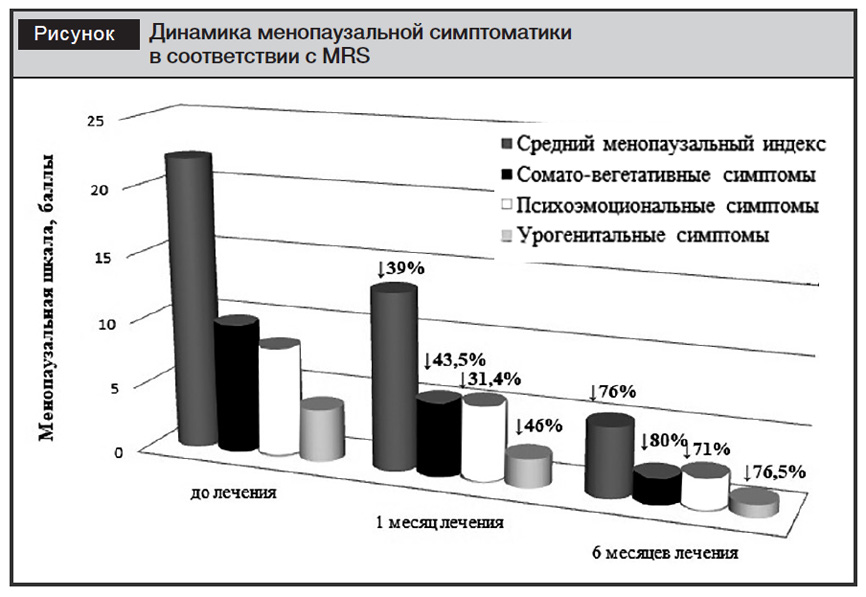
К концу первого месяца терапии трансдермальным спреем «Лензетто» у всех женщин отмечено облегчение менопаузальной симптоматики, степень выраженности которой уменьшилась на 39,4% и составила 13,35±2,94 балла по шкале MRS (p<0,001). Высокая эффективность наблюдалась в отношении соматовегетативной симптоматики – облегчение симптомов на 43,53%, что, в первую очередь, проявлялось существенным уменьшением количества приливов (с 20–30 до 8–10 раз в сутки), их интенсивности и продолжительности – по шкале MRS облегчение на 56% (табл. 2).
В то же время большинство обследованных женщин отметили значительное облегчение урогенитальных проявлений – на 45,5% по шкале MRS (p<0,001), наибольший клинический эффект наблюдался в отношении сухости, зуда и жжения во влагалище – улучшение на 64,5%.
У всех пациенток к концу первого месяца терапии улучшился сон, уменьшились раздражительность, плаксивость, тревожность, однако в отношении указанной симптоматики наблюдалась менее выраженная положительная динамика – улучшение на 31,6% по шкале MRS.
Только одна пациентка (женщина 53 лет с интактной маткой, продолжительность постменопаузального периода 5 лет, ранее МГТ не проводилась, климактерический синдром средней степени тяжести по шкале MRS) не отметила выраженной динамики менопаузальной симптоматики в течение месяца, ввиду чего было рекомендовано увеличение дозы трансдермального эстрадиола.
Обследование женщин, проведенное через 6 месяцев продолжающейся МГТ, показало облегчение менопаузальных симптомов на 76,23% – 5,24±3,77 балла по шкале MRS (p<0,001). Следует отметить, что наибольшая эффективность выяв-лена в отношении соматовегетативной симптоматики – 80,37%. Вазомоторные проявления, как самый тревожащий женщин симптом, уменьшились на 85,06%: у 19 (55,9%) женщин приливы жара отсутствовали к концу 6 месяца терапии, а у 15 (44,1%) сохранялись редкие (1–3 раза в неделю) приливы жара, незначительной интенсивности и продолжительности, отмечаемые женщинами как очень слабые – 1 балл по MRS. Пациенток практически не беспокоили дискомфорт в области сердца, в мышцах и суставах, практически не было проблем со сном.
Высокоэффективной терапия также оказалась в отношении урогенитальных симптомов. Проявления сухости и зуда во влагалище уменьшилось на 87,63% по MRS: сохранялось у 8 из 25 (32%) пациенток (1 балл по MRS).
Значительно улучшилось психоэмоциональное состояние женщин к концу 6 месяца лечения – проявления уменьшились на 71,26% по шкале MRS (рисунок).
Только в одном случае из 34 (2,9%) для достижения желаемого результата понадобилось увеличить дозу до 3 нанесений спрея.
Таким образом, эффективность терапии трансдермальным спреем «Лензетто» на протяжении полугода составила 76,23%. Проведенное наблюдение позволило сделать вывод о высоком терапевтическом эффекте в отношении соматовегетативной и урогенитальной симптоматики. В свою очередь, облегчение эмоционально-вегетативных проявлений требует более длительного времени использования. Достоинством препарата «Лензетто» явилось не только отсутствие побочных эффектов, но и стабильность массы тела у всех наблюдаемых нами женщин.
Л И Т Е Р А Т У Р А
1. Сметник В.П. Эстрогены: от синтеза до клинического применения. – М., 2012. – 176 с.
2. Algin-Yapar E., Inal Ö. // Tropical Journal of Pharmaceutical Research. – 2014. – Vol.13, N3. – P.469–474. doi:10.4314/tjpr.v13i3.23
3. Archer D. // Nature Clinical Practice Endocrinology & Metabolism. – 2009. – Vol.5, N1. – P.18–19. doi:10.1038/ncpendmet1024
4. Avis N.E., Crawford S.L., Green R. // Obstetrics and Gynecology Clinics of North America. – 2018. – Vol.45, N4. – P.629–640. doi:10.1016/j.ogc.2018.07.005
5. Avis N.E., Crawford S.L., Greendale G., et al. // JAMA Internal Medicine. – 2015. – Vol.175, N4. – P.531–539. doi:10.1001/jamainternmed.2014.8063
6. Baber R.J., Panay N., Fenton A. // Climacteric. – 2016. – Vol.19, N2. – P.109–150. doi:10.3109/13697137.2015.1129166
7. Bachmann G.A., Schaefers M., Uddin A., et al. // Obstetrics & Gynecology. – 2007. – Vol.110, N4. – P.771–779. doi:10.1097/01.aog.0000284450.51264.31
8. Brunner R.L., Aragaki A., Barnabei V., et al. // Menopause. – 2010. – Vol.17, N5. – P.946–954. doi:10.1097/gme.0b013e3181d76953
9. Buster J.E., Koltun W.D., Pascual M.L.G., et al. // Obstetrics & Gynecology. – 2008. – Vol.111, N6. – P.1343–1351. doi:10.1097/aog.0b013e318175d162
10. Butler L., Santoro N. // Steroids. – 2011. – Vol.76, N7. – P.627–635. doi:10.1016/j.steroids.2011.02.026
11. Canonico M., Oger E., Plu-Bureau G. // Circulation. – 2007. – Vol.115, N7. – P.840–845. doi:10.1161/circulationaha.106.642280
12. Fait T. // Drugs in Context. – 2019. – Vol.8. – P.1–9. doi:10.7573/dic.212551
13. Conway G.S. // Advanced Practice in Endocrinology Nursing. – 2019. – P.803–815. doi:10.1007/978-3-319-99817-6_41
14. Kuhl H. // Climacteric. – 2005. – Vol.8, N1. – P.3–63. doi:10.1080/13697130500148875
15. McKinlay S.M., Brambilla D.J., Posner J.G. // Maturitas. – 1992. – Vol.14, N2. – P.103–115. doi:10.1016/0378-5122(92)90003-m
16. Mueck A.O., Römer T. // Hormone Molecular Biology and Clinical Investigation. – 2018. – Vol.37, N2. – P.22. doi:10.1515/hmbci-2018-0033
17. Samsioe G., Boschitsch E., Concin H.// Climacteric. – 2006. – Vol.9, N5. – P.368–379. doi:10.1080/13697130600953661
18. Santoro N.F., Clarkson Th.B., Freedman R.R., et al. // Menopause. – 2004. – Vol.11, N1. – P.11–33. doi:10.1097/01.gme.0000108177.85442.71
19. Santoro N., Randolph J.F. // Obstetrics and Gynecology Clinics of North America. – 2011. – Vol.38, N3. – P.455–466. doi:10.1016/j.ogc.2011.05.004
Медицинские новости. – 2020. – №12. – С. 52-55.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.