Внимание! Статья адресована врачам-специалистам
KostiukS.A.
Belarusian Medical Academy of Post-Graduate Education, Minsk
Laboratory errors and risk management in the molecular genetic laboratory
Резюме. Тема лабораторных ошибок при проведении молекулярно-генетических исследований, в том числе методом ПЦР в режиме реального времени, очень сложна и не изучена специалистами лабораторной диагностики в виде отдельного направления в системе менеджмента качества. Она не обсуждается в практических кругах, не освещается в специальной медицинской литературе, научных публикациях. Разрозненные знания, отсутствие навыков аналитического анализа и участия в решении научных задач не позволяют специалистам молекулярно-генетических лабораторий практического здравоохранения эффективно организовать работу по выявлению лабораторных ошибок, которые могут быть на любом из этапов, носить методический или аналитический характер. Разработать единую типовую модель борьбы с лабораторными ошибками при проведении ПЦР-исследований сложно, поскольку каждая лаборатория может отличаться по организационной структуре, видам оборудования, используемым реагентам, перечню исследований. В этой связи необходимо на основе научного анализа возможных лабораторных ошибок сформировать профессиональное мышление у врачей лабораторной диагностики, работающих в практическом здравоохранении.
Ключевые слова: полимеразная цепная реакция в режиме реального времени, преаналитический, аналитический и постаналитический этапы, методические и аналитические лабораторные ошибки.
Медицинские новости. – 2021. – №1. – С.6–10.
Summary. The topic of laboratory errors in molecular genetic researches, including real-time PCR, is very complex and has not been studied by laboratory diagnostics specialists as a separate area in the quality management system: it is not discussed in practical circles, it is not covered in special medical literature or scientific publications. Scattered knowledge, lack of analytical analysis skills and lack of participation in solving scientific problems do not allow the specialists of practical health care molecular genetic laboratories to effectively organize the work to identify laboratory errors, which can be at any stage, of a methodical or analytical nature. It is difficult to develop a single standard model for fighting laboratory errors during PCR studies, since each laboratory may differ in organization structure, types of equipment, reagents and the list of studies. In this regard, it is necessary, on the basis of a scientific analysis of possible laboratory errors, to form professional thinking among laboratory diagnostics doctors working in practical health care.
Keywords: real-time PCR, preanalytical, analytical and postanalytical stage, methodological and analytical laboratory errors.
Meditsinskie novosti. – 2021. – N1. – P.6–10.
Лабораторные методы диагностики сложно унифицировать, поскольку каждый из них имеет свои технические и диагностические особенности. Это в полной мере относится и к молекулярно-биологическим методам лабораторной диагностики в практическом здравоохранении, которые включают в себя полимеразную цепную реакцию (ПЦР) с электрофоретической детекцией, с детекцией по конечной точке, в режиме реального времени [7, 8]. Современный уровень технического прогресса в лабораторной медицине способствует снижению количества лабораторных ошибок, и если при внедрении в клиническую практику первого молекулярно-биологического метода – ПЦР с электрофоретической детекцией – исследователи сталкивались с проблемой контаминации, то есть с ложноположительными результатами, в настоящее время наиболее востребованным в практическом здравоохранении является ПЦР в режиме реального времени, что позволило создать для этого метода репутацию очень надежного исследования [4, 6]. Однако в реальности данное убеждение не является верным по своей формулировке.
Многие врачи лабораторной диагностики считают, что правильное выполнение исследований не должно приводить к ошибкам, и потому соблюдение инструкций к диагностическим тест-системам – это порой единственное, чем руководствуется сотрудник клинико-диагностической лаборатории. Однако не все тест-системы могут быть одинаково устойчивы к контаминации, могут иметь разный предел обнаружения. В этой связи врач лабораторной диагностики должен знать слабые стороны используемой тест-системы и организовать свою работу так, чтобы свести к минимуму вероятность возникновения недостоверного результата. Важно также учитывать материально-техническую базу, количество производимых исследований, копийность биологического материала.
Причины и механизмы формирования лабораторным ошибок при проведении исследований методом ПЦР в режиме реального времени слишком сложны, чтобы их интуитивно понимать. Учитывая, что в практическом здравоохранении в ПЦР-лабораториях трудятся не научные сотрудники, а врачи, то им будет важно понимать, что происходит на их конкретном рабочем месте, и планировать свою работу над ошибками. В условиях рутинной ежедневной практики ошибка не воспринимается как научный феномен со своими причинами и механизмами формирования, это вопрос поиска виноватых. В этом случае, поскольку речь идет о качестве работы лаборатории, всю ответственность возлагают на сотрудников лаборатории [5].
Диагностические ошибки могут быть различные, это зависит как от природы исследуемого биологического материала, так и от технологических особенностей исследования. Например, при использовании в диагностической медицинской лаборатории методического подхода к анализу результатов на основе флуоресцентной детекции по конечной точке и ПЦР в режиме реального времени выявление нуклеиновых кислот одних и тех же микроорганизмов может сопровождаться разными результатами, обусловленными различным пределом обнаружения данных диагностических тест-систем.
Всегда ли использование диагностикумов с высоким пределом обнаружения является достаточным дополнительным «защитным» фактором от недостоверных результатов? Считаем, что нет, и число допускаемых ошибок в диагностической лаборатории можно уменьшить только путем повышения профессионализма сотрудников. Неподготовленному специалисту трудно разобраться в преимуществах и недостатках различных технологий, определиться с их выбором, оценить правильность и рациональность организации технологического процесса, а также поддержать его на приемлемом уровне. Проблема образования становится более очевидной в связи с тем, что сотрудники, пройдя краткосрочное обучение на курсах повышения квалификации (1 месяц), проводят исследования не только по детекции нуклеиновых кислот возбудителей инфекционных заболеваний, но и занимаются медицинской генетикой. Также одним из популярных направлений в молекулярной лабораторной диагностике стало создание «домашних» тест-систем – inhouse тест-систем, которые в лабораториях самостоятельно разрабатываются и валидируются, а для этого, безусловно, важна квалификация специалиста [7].
Ошибками можно считать:
1) оказание некачественной лабораторной услуги, сопровождающееся возникновение ложного результата, которые могут быть ложноположительными и ложноотрицательными;
2) оказание некачественной диагностической услуги, например, в случае использования метода ПЦР при верификации диагноза, когда он не является диагностически обоснованным методом исследования.
Опыт появления ПЦР в 2000-х годах в Республике Беларусь сопровождался ложноположительными результатами, что было существенным ограничением широкого распространения этого метода в клинической лабораторной диагностике. В настоящее время после 20 лет применения ПЦР-исследований ситуация изменилась: для установления многих заболеваний, уточнения фазы течения заболевания, оценки эффективности лечения, клинической и микробиологической излеченности ПЦР является важным диагностическим инструментом [4, 7, 8]. Однако данную ситуацию не следует рассматривать как проявление наступившей безупречности молекулярно-биологических методов исследования.
Понятие «ложноположительный» результат определяется понятием «диагностическая специфичность», которая рассчитывается по формуле [1, 5]:
Диагностическая специфичность
(ДС)= 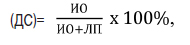
где ИО – истинно отрицательный результат теста, ЛП – ложноположительный результат теста.
Эта формула характеризует вероятность отрицательного результата при отсутствии болезни. При 100% специфичности тест не относит здоровых людей к категории больных и ложноположительные результаты отсутствуют.
Однако «специфичность» не является однозначной лабораторной характеристикой, поскольку в зависимости от причин ложноположительных результатов принято разделять аналитическую и диагностическую специфичность, что особенно важно для ПЦР-исследований [2, 3]. Под 100% аналитической специ-фичностью понимают отсутствие амплификации нуклеиновых кислот других микроорганизмов и человека, способность детектировать специфический флуоресцентный сигнал выше порогового значения в положительных образцах и отсутствие его в отрицательных образцах, то есть неспособность тест-системы выявлять исследуемый фрагмент ДНК, характерный для возбудителя инфекционного заболевания, у здорового человека [3, 5, 7]. Аналитическая специфичность может меняться при применении различных олигонуклеотидных последовательностей праймеров и молекулярных зондов, тогда как диагностическая специфичность обусловлена совокупностью причин, действующих в условиях лабораторной практики, среди которых наиболее важной является контаминация.
Аналитическая специфичность – обязательный параметр валидации тест-системы и должна составлять 100%, но методы ее определения не совершенны. Каким образом происходит выбор последовательности праймеров и молекулярных зондов при разработке новой тест-системы? Первый этап: выбор осуществляется in silico с использованием электронных баз данных для исключения перекрестных реакций с известными ДНК и РНК других микроорганизмов. Вторым этапом выбранные последовательности проходят тестирование in vitro с использованием узкого числа возбудителей инфекционных заболеваний, что, однако, не может полностью исключить перекрестные реакции и, соответственно, ложноположительные результаты. Безусловно, это явление не распространенное и зависит от вида исследуемого биологического материала. В литературе можно встретить информацию о перекрестных реакциях при выявлении ДНК Neisseria gonorrhoeae, так как для вируса гепатита С таких публикаций нет [1, 13]. Это можно объяснить присутствием в исследуемом биологическом материале из урогенитального тракта комменсальных диплококков рода Neisseria spp., обменивающихся генетическими элементами с Neisseria gonorrhoeae, и появлением таким образом популяций Neisseria spp., обладающих генетической гомологией, критичной для использования данной тест-системы. Такая ситуация исключена для РНК вируса гепатита С. Ряд авторов объясняет снижение аналитической специфичности, обусловленное биовариацией микроорганизма [11], поэтому некоторые коммерческие тест-системы с течением времени при длительном их использовании могут терять свою аналитической специфичность.
Диагностическая специфичность обратно пропорционально отражает частоту ложноположительных результатов при реальном использовании тест-системы. Диагностическая специ-фичность зависит от аналитической специфичности. Однако существуют другие причины ее снижения. Одной из возможных причин ложноположительных результатов в ряде случаев может быть использование интеркалирующих красителей, особенность которых заключается в их способности без дифференциации связываться с любой ДНК. При этом накопление неспеци-фических продуктов амплификации может повлечь за собой заблуждение об истинном результате исследования в данном биологическом материале. При образовании димеров праймеров могут синтезироваться короткие ампликоны, при этом регистрация накопления продуктов амплификации возникает даже без участия целевой специфической нуклеиновой кислоты. В этом случае типичная положительная S-образная флуоресцентная кривая формируется только на поздних циклах амплификации (после 30-го цикла), поэтому следует исключить регистрацию и использование диагностических тест-систем для ПЦР в режиме реального времени на основе интеркалирующих красителей.
Наиболее часто причиной появления ложноположительных результатов выступает контаминация [9]. Возможная контаминация не является оцениваемым техническим параметром при клинических испытаниях и регистрации тест-системы, поскольку это показатель, по которому следует оценивать качество работы сотрудников лаборатории. В то же время устойчивость к контаминации диагностической тест-системы является важным техническим показателем, который следует определять при проведении межлабораторных испытаний или тестировании диагностикума в референтной лаборатории [10]. Частота ложноположительных результатов при проведении ПЦР-исследований зависит от «человеческого фактора» в выполнении технологического процесса в лаборатории, поэтому важно предусмотреть некоторые особенности использования тест-системы, которые позволят снизить влияние этого фактора и уменьшат вероятность получения ложноположительных результатов. По данным H. Zitzer, G. Heilek, K. Truchon и соавт. [15], возможно создать тест-системы, устойчивые к контаминации. Данные технологические особенности следует рассматривать как их бесспорное преимущество. В этой связи диагностическая специфичность может являться важным критерием для оценки качества тест-системы, и только более высокая себестоимость выполнения данных тестов является для многих лабораторий непреодолимым препятствием для их широкого практического применения.
Определение диагностической специ-фичности является сложным процессом, поскольку ложноположительные результаты могут регистрироваться не сразу, а по прошествии некоторого времени работы с данной тест-системой, поэтому диагностическая специфичность имеет очень неоднозначную оценку. Данный показатель должен определяться в ходе клинических испытаний в рамках государственной регистрации, в то же время методы ее оценки не совершенны.
Уровень возможной контаминации можно выражать в проценте постановок реакций амплификации, при которых выявлен хотя бы один положительный результат, или как доля ложноположительных результатов среди контрольных отрицательных образцов, или как доля ложноположительных результатов среди клинических биологических образцов, не содержащих специфическую нуклеиновую кислоту, которая является матрицей для амплификации [11, 15].
С практической точки зрения важно знать не только то, что тест-система эффективно детектирует конкретный микроорганизм с минимальным количеством ложноположительных результатов, что и определяется понятием «специфичность», но и иметь уверенность, что выявленный микроорганизм является этиологическим фактором заболевания в каждом конкретном клиническом случае при положительном результате теста. В качестве примера можно вспомнить условно-патогенные микроорганизмы, которые при концентрации выше диагностически значимой (пороговой), являются этиологической причиной воспалительного процесса. Специалисту клинического профиля необходимо иметь представление, насколько выявленный микроорганизм способен выступать в качестве этиологического фактора в данном конкретном клиническом случае при положительном результате теста. Для этого важно иметь высококопийный положительный результат (более 103 копий/мл), в то время как низкокопийные образцы не имеют диагностической ценности. Для этого важно использовать лабораторный показатель – предсказательная ценность положительного результата.
Выявление ложноположительных результатов в практике является единственным способом визуализации процесса контаминации на практике. Но всегда ли контаминация в лаборатории сопровождается появлением ложноположительных результатов? По-нашему мнению, контаминация может быть скрытой и не приводить к появлению ложноположительных результатов. Поскольку каждая тест-система имеет свой порог (предел) обнаружения специфической ДНК, установка производителем высокого порога обнаружения искомой молекулы ДНК для своего диагностического набора позволит не определить низкие концентрации контаминационной молекулы ДНК как положительный результат лабораторного исследования. Ложноположительные результаты в данном случае следует воспринимать как надводную, меньшую часть айсберга. В процессе работы клинико-диагностической или научной лаборатории персонал может столкнуться с проблемой контаминации лабораторных поверхностей, дозаторов и даже лабораторного оборудования. Помня о возможности перемещения контаминационной молекулы ДНК с потоками воздуха, через контакты с одеждой, кожные и волосяные покровы, следует понимать, что контаминация – это неприятное, но, в то же время вполне возможное лабораторное событие.
Поэтому работа в лаборатории, использующей молекулярно-биологические методы диагностики, должна проводиться в режимных условиях с целым комплексом профилактических мер, направленных на недопущение возникновения контаминации и препятствие ее распространения, включая мониторинг для своевременного выявления неконтролируемой контаминации, тщательно фиксируя случаи ложноположительных результатов. В случае отсутствия ложноположительных результатов можно заключить, что, даже если контаминация и есть, ее распространение находится под контролем. Если в деятельности лаборатории регистрируются ложноположительные результаты, это указывает на то, что проводимых мероприятий недостаточно, необходимо выявить причины и принять меры, направленные на их устранение и на клиренс уже распространившейся контаминанты. Неоспоримым фактором контаминации является регистрация положительного результата в отрицательном контрольном образце.
Персонал лаборатории должен уметь своевременно отличить истинно положительные результаты от ложноположительных, а также определить причину и механизм возникшей контаминации. Для того чтобы устранить контаминацию, необходимо понять, что послужило контаминантой: ампликоны или нативная ДНК. Решить данный вопрос весьма проблематично, поскольку нет патогномоничных признаков. Ампликоны можно признать наиболее контагиозной из всех возможных контаминант, при этом происходит их ретроградный перенос из зоны ПЦР или пост-ПЦР в пре-ПЦР – это вертикальная, или внутренняя контаминация. При контаминации нативной ДНК задействуются ресурсы пре-ПЦР-зоны, когда контаминанта, не нарушая правил поточности, проходит этап амплификации – это горизонтальная, или внешняя контаминация. Важно охарактеризовать контаминацию посимптомно: низкокопийная или высококопийная, спорадическая или тотальная. Признаком тотальной контаминации является фиксация положительного результата в двух и более отрицательных контрольных образцах, спорадической – появление искомой ДНК лишь в одном отрицательном контрольном образце данной постановки. В случае, если контаминация вызвана нативной нуклеиновой кислотой, необходимо понять, каков механизм распространения контаминанта, чтобы конкретизировать свою тактику и наиболее эффективно провести мероприятия ликвидации контаминации.
Важно помнить, что контаминанта не может существовать сама по себе и ассоциирована с каким-либо носителем. Исключение составляют случаи, когда контаминанта переносится в воздухе, но это временное ее состояние, обязательно заканчивающееся осаждением на какой-либо объект. Любая контаминанта имеет первичный источник, то есть объект, который содержит ее в наиболее максимальном состоянии, это может быть пробирка с биологическим материалом или пробирка с ампликонами. Персоналу необходимо четко представлять, какой из объектов в лаборатории может выступать в качестве первичного источника контаминанты, чтобы с особым вниманием отнестись к нему во время проведения исследования с соблюдением всех мер предосторожности при обращении с ним. По мере распространения контаминанты в пределах лаборатории она охватывает новые территории, но ее концентрация при этом снижается. Те ареолы лаборатории, которые обсеменены контаминантой, являются очагом контаминации. Если первоначально не ликвидировать наиболее концентрированные скопления контаминанты в очаге – первичный источник, высококопийные вторичные источники контаминации, то итоговая эффективность деконтаминационных мероприятий будет низкой. Это устанавливает порядок деконтаминации, которую следует проводить поочередно: в начале – мероприятия в отношении наиболее концентрированных, а затем – в отношении менее концентрированных источников контаминации. Частота высококопийных контаминаций значительно ниже частоты низкокопийных. Наиболее часто контаминация проявляется регистрацией ложноположительного результата на поздних циклах амплификации. Более точная дифференцировка ложно- и истинно положительного результата возможна при повторном исследовании с проведением дублирования амплификации.
Для того, чтобы определить зоны с наиболее высокой концентрацией контаминанты, необходимо проводить внеплановые смывы, тестирование которых оправдано как в целях расследования механизмов контаминации, так и при оценке эффективности деконтаминационных мероприятий.
У каждой контаминации есть свой предел обнаружения, то есть та концентрация контаминанты, которая является максимально возможной в ложноположительном образце. Все результаты, когда регистрируемая концентрация искомой ДНК ниже предела обнаружения контаминации, должны рассматриваться как потенциально ложные, их следует повторно исследовать из резервного образца биологического материала – аликвоты. Считаем, что значения предела обнаружения внешней контаминации должен определять производитель тест-систем и предоставлять эти данные в инструкции к ней.
Риск контаминации биологических проб снижается при регулярных превентивных деконтаминационных мероприятиях, включая проведение текущей и генеральной уборки, ультрафиолетовое облучение рабочих зон. Поскольку существуют объекты труднодоступны для деконтаминации – штативы для наконечников, медицинский вакуумный отсасыватель, емкости для сбора наконечников, бумажные носители информации, следует проводить их периодическую замену, так как они являются местом сорбции и способны стать вторичным источником контаминанты.
Термин «перекрестная контаминация» обозначает внешнюю контаминацию в случае распространения от биологической пробы к биологической пробе. «Перекрестное реагирование» происходит в случае, если праймеры и зонды тест-системы сконструированы таким образом, что тест-система способна выявлять и детектировать не только заявленный возбудитель, но и другие виды микроорганизмов. Это указывает на то, что «перекрестное реагирование» не является синонимом термина «перекрестная контаминация».
В некоторых случаях источником контаминации может стать сотрудник клинико-диагностической лаборатории, особенно если объектом исследования является участок генома человека, поэтому следует соблюдать особую осторожность при проведении диагностических манипуляций. Обязательным является использование масок, медицинской шапочки, перчаток, исключение прикосновения к пробиркам, содержащим компоненты тест-систем без перчаток, поскольку ДНК самого сотрудника может стать контаминантой.
В коммерческих тест-системах контрольные образцы искомой (положительной) ДНК содержатся в невысоких концентрациях и укладываются в диапазон линейности теста. В этой связи их можно рассматривать как обычные биологические образцы, а контаминацию с их участием считать горизонтальной. Контаминацию реагентов следует рассматривать как возможное явление при любой контаминации, это вторичный источник контаминации, который может включать контаминацию воды и расходного материала. В качестве превентивных деконтаминационных мероприятий важно использовать пластик и реагенты с маркировкой DNA-free.
Профилактика контаминации должна включать общелабораторные меры, которые включают:
– отказ от открытых систем детекции результатов, использование тест-систем на основе ПЦР в режиме реального времени;
– соблюдение требований по организации работ в ПЦР-лаборатории, зонирование лабораторных этапов в соответствии с принципами поточного движения исследуемых биологических проб согласно последовательности прохождения ими этапов анализа; запрет на использование оборудования и расходных материалов за пределами той зоны, в которой предусмотрена их эксплуатация; разделение видов работ в отношении риска инициации контаминации и выполнение их в особых помещениях, смена спецодежды и гигиеническая обработка рук при перемещении между зонами;
– использование тест-систем с пределом обнаружения от 102 копий ДНК;
– использование одноразового пластика и других расходных материалов для проведения ПЦР-исследований;
– регулярная текущая и генеральная уборка с проведением мероприятий по дезактивации контаминанты;
– проведение внутрилабораторного контроля качества и участие во внешнем контроле качества.
Специальные меры профилактики контаминации.
1. Наличие отлаженной системы утилизации пробирок с ампликонами.
2. Использование UNG-протокола на основе урацил-N-гликозилазы – фермента, участвующего в репарации ДНК и вызывающего гидролиз цепи ДНК по остаткам урацила. При этом в ПЦР-смесь дезокситимидинфосфат заменяется на дезоксиуридинфосфат, поэтому ампликоны становятся чувствительными к UNG-гидролизу, после чего ампликоны не способны быть матрицей для последующей реакции амплификации. В случае неполной денатурации UNG, это может сопровождаться гидролизом исследуемых фрагментов положительной пробы и снижением чувствительности метода. Неполностью разрушенные с помощью UNG ампликоны, контаминируя пробы биологического материала пациентов, способны конкурировать с искомой нуклеиновой кислотой за праймеры, что обусловливает снижение чувствительности тест-системы и появление ложноотрицательных результатов.
3. Автоматизация процедуры экстракции нуклеиновых кислот, которая позволяет сократить частоту ложноположительных результатов до 1/400 [14]. Автоматизация ПЦР способствует уменьшению требуемых производственных площадей лаборатории, устранению дефицита кадров.
4. Сокращение числа этапов ПЦР, при выполнении которых требуется открывать пробирки. Современные тест-системы позволяют выполнять этап обратной транскрипции и амплификации в объединенной амплификационной смеси как один единый этап.
5. Ограничение количество исследуемых образцов в одну постановку до 12.
6. Ограничение количества циклов амплификации.
Л И Т Е Р А Т У Р А
1. Костюк С.А. // Медицинские новости. – 2012. – №4. – С.16–19.
2. Костюк С.А. Клиническая лабораторная диагностика ассоциированных инфекций урогенитального тракта: Монография. – Минск, 2012. – 306 с.
3. Костюк С.А. // ARS medica (клин. лаборатор. диагностика). – 2010. – №4. – С.43–50.
4. Костюк С.А. Молекулярно-биологические методы в медицине: Монография. – Минск, 2013. – 327 с.
5. Костюк С.А., Коломиец Н.Д. // Медицинские новости. – 2008. – №15. – С.96–101.
6. Костюк С.А. // Весцi Нац. Акад. навук Беларусi. Сер. бiял. навук. – 2006. – №4 – С.103–112.
7. Костюк С.А. // Медицинские новости. – 2016. – №4. – С.11–14.
8. Теоретические и прикладные вопросы применения методов анализа нуклеиновых кислот: монография / С.А. Костюк, Н.Д. Коломиец, Т.В. Руденкова, О.С. Полуян. – Минск, 2014. – 272 с.
9. Borst A., Box A.T., Fluit A.C. // Eur. J. Clin. Microbiol. Infect. Dis. – 2004. – Vol.23, N4. – P.289–299.
10. Burd E.M. // Clin. Microbiol. Rev. – 2010. – Vol.23, N3. – P.550–576.
11. Greub G., Sahli R., Brouillet R., et al. // Future Microbiol. – 2016. – Vol.11, N3. – P.403–525.
12. Tabrizi S.N., Unemo M., Limnios A.E., et al. // J. Clin. Microbiol. – 2011. – Vol.49, N10. – P.3610–3615.
13. Upton A., Bromhead C., Whiley D.M. // J. Clin. Microbiol. – 2013. – Vol.51, N5. – P.1609–1610.
14. Wilke W.W., Jones R.N., Sutton L.D. // Diagn. Microbiol. Infect. Dis. – 1995. – Vol.21, N4. – P.181–185.
15. Zitzer H., Heilek G., Truchon K., et al. // J.Clin. Microbiol. – 2013. – Vol.51, N2. – P.571–577.
Медицинские новости. – 2021. – №1. – С. 6-10.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.