Внимание! Статья адресована врачам-специалистам
Mohort T.V.1, Karlovich N.V.2
1Belarusian State Medical University, Minsk
2Republican Center for Medical Rehabilitation and Balneotherapy, Minsk, Belarus
Vitamin D in the practice of an endocrinologist: facts and assumptions
Резюме. Витамин Д не является классическим витамином, а может быть назван Д-гормоном. Это заключение основано на понимании доказательств синтеза в организме человека, стероидной структуры, наличия специфического рецептора, способности к саморегуляции посредством обратной связи, регуляторной связи с другими гормонами – паратгормоном, кальцитонином, альдостероном. В обзоре проводится анализ эндокринной патологии, ассоциированной с классическими эффектами витамина Д (накопление кальция в скелете, регуляция синтеза паратгормона, минерального обмена (кальция и фосфора) в почках, дифференциацией и функцией остеобластов и остеокластов), а также патологии, обусловленной плейотропными эффектами витамина Д. Подробно рассмотрены связи заболеваний паращитовидных желез (гипопаратиреоз, первичный и вторичный гиперпаратиреоз), остеопороза с дефицитом витамина Д. Проведен анализ связи недостаточности витамина Д с сахарным диабетом, ожирением, нарушениями метаболизма тестостерона, синдромом поликистозных яичников. Представлены современные критерии диагностики, профилактики и лечения дефицита витамина Д.
Ключевые слова: витамин Д, эндокринная патология, гипопаратиреоз, гиперпаратиреоз, остеопороз, сахарный диабет, ожирение, тестостерон, синдром поликистозных яичников.
Медицинские новости. – 2021. – №4. – С. 25–33.
Summary. Vitamin D is not a classic vitamin, but it can be called a D-hormone. This conclusion based on an understanding of the evidence it’s synthesis in the human body, the steroid structure, the presence of a specific receptor, the ability to self-regulate through feedback, regulatory communication with other hormones – PTH, calcitonin, aldosterone. The review analyzes the endocrine pathology associated with the classical effects of vitamin D (storage of calcium in the skeleton, regulation of PTH synthesis, mineral metabolism (calcium and phosphorus) in the kidneys, differentiation and function of osteoblasts and osteoclasts), as well as the pathology caused by the pleiotropic effects of vitamin D. The connections of parathyroid diseases (hypoparathyroidism, primary and secondary hyperparathyroidism), osteoporosis with vitamin D deficiency is considered in detail. The association of vitamin D deficiency with diabetes mellitus, obesity, impaired testosterone metabolism, and polycystic ovary syndrome was analyzed. Modern criteria for the diagnosis, prevention and treatment of vitamin D deficiency are presented.
Keywords: vitamin D, endocrine pathology, hypoparathyroidism, hyperparathyroidism, osteoporosis, diabetes mellitus, obesity, testosterone, polycystic ovary syndrome.
Meditsinskie novosti. – 2021. – N4. – P. 25–33.
Самые древние школы медицины знали о целительной силе солнечного света: солнечные ванны принимали египтяне и ассирийцы, участники Олимпийских игр в Древней Греции. О лечебном воздействии солнца неоднократно упоминается в рукописях Гиппократа (лечебное действие, психологическое воздействие и влияние на мышечную силу). Современная история витамина Д начинается с открытия в 1920 году его антирахитического действия и последующих исследований по конверсии 7-дегидротахистерола в коже в витамин Д, регулирующего влияния паратгормона (ПТГ), к доказательствам его дефицита в широких популяциях, выявлению рецепторов витамина Д (VDR), определению плейотропных эффектов, полногеномного анализа сайтов связывания рецептора витамина Д.
Данный обзор проведен на основании результатов, полученных из баз PubMed и Google Scholar. Для поиска использовались специфические слова: витамин Д, заболевания эндокринной системы, остеопороз, гипопаратиреоз, гиперпаратиреоз, сахарный диабет. Все найденные статьи были тщательно оценены, а полученные данные проанализированы.
Согласно общепринятому определению, витамин Д – это группа биологически активных веществ, объединяющая витамины Д1, Д2, Д3, Д4, Д5, из которых только две формы, Д2 (или эргокальциферол) и Д3 (или холекальциферол), имеют важное биологическое значение. На самом деле термин «витамин Д» не является корректным, так как витамин Д3 синтезируется у человека в коже под действием ультрафиолетовых лучей диапазона «B». А классические представления о витаминах базируются на факте, что это биологически активные вещества, которые организм получает в качестве составной части пищи и в подавляющем большинстве являющиеся коферментами или их предшественниками. Определение понятия «гормон» базируется на понимании того, что гормоны – это сигнальные химические вещества, вырабатываемые клетками тела и влияющие на клетки других частей тела, связывающиеся с рецепторами клеток-мишеней и оказывающие регулирующее влияние на обмен веществ и физиологические функции. Витамин Д имеет структуру, сходную со стероидными гормонами (кортизолом, тестостероном, эстрадиолом, альдостероном и др.), не является кофактором ни одного из известных ферментов, может самостоятельно синтезироваться в организме. Имеет специфический ядерный (цитозольный) рецептор в клетках различных органов и тканей (VDR), что характерно исключительно для гормонов, способен к саморегуляции посредством обратной связи, регуляторно связан с другими гормонами – ПТГ, кальцитонином, альдостероном [1, 2]. Гормональная природа Д-гормона, или, как более принято, витамина Д, диктует необходимость исследования связи нарушений его содержания в организме с эндокринной патологией посредством вовлечения в патологический процесс различных патофизиологических механизмов (рис. 1) [3].
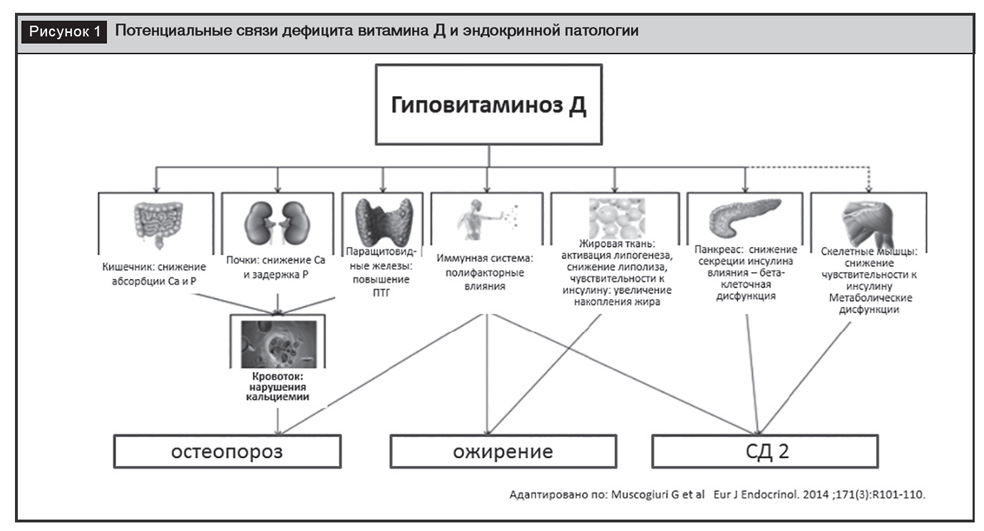
Анализ связи нарушений обеспеченности витамином Д и эндокринной патологии можно разделить на 2 блока:
– 1-й – патология, ассоциированная с классическими эффектами витамина Д (накопление кальция в скелете, регуляция синтеза ПТГ, минерального обмена (кальция и фосфора) в почках, дифференциацией и функцией остеобластов и остеокластов);
– 2-й – патология, обусловленная плейотропными эффектами витамина Д.
Эндокринная патология, ассоциированная с классическими эффектами витамина Д
Гипопаратиреоз – гетерогенный синдром, обусловленный нарушением синтеза, секреции паращитовидными железами (ПЩЖ) ПТГ или его периферического действия и проявляющийся гипокальциемией и гиперфосфатемией. Современные клинические рекомендации включают:
– восполнение дефицита витамина Д при планировании хирургического вмешательства на шее;
– необходимость облигатного тестирования 25(ОН)D наряду с определением уровня ПТГ, кальция и фосфора;
– устранение клинической симптоматики и поддержание концентрации общего кальция в сыворотке крови в пределах 2,1–2,4 ммоль/л посредством использования препаратов кальция в дозе 800–2000 мг и витамина Д в суточной дозе 400–800 МЕ (в условиях адекватной обеспеченности) или аналогами витамина Д [4, 5].
Препараты витамина Д, используемые в лечении гипопаратиреоза, не обеспечивают быстрое начало действия. Поэтому обосновано использование препаратов кальция для купирования тетанических приступов. Лекарственные средства витамина Д необходимы для достижения долгосрочного эффекта. При наличии дефицита витамина Д его дозы существенно увеличиваются (табл. 1).
Таблица 1. Препараты витамина Д, используемые в лечении гипопаратиреоза
|
Препарат
|
Средняя доза*
|
Время начала
действия (сутки)
|
Длительность действия (сутки)
|
|
Кальцитриол (1,26(ОН)2D3)
|
0,25–2 мкг
1–2 раза/сутки
|
1–2
|
2–3
|
|
Альфакальцидол (1?(ОН)D3)
|
0,5–4 мкг
1 раз/сутки
|
1–2
|
5–7
|
|
Дигидротахистерол
|
0,3–1,0 мг/сутки
|
4–7
|
7–21
|
|
Витамин Д2
(эргокальциферол) или Д3 (холекальциферол)
|
25 000–200 000 МЕ/сутки
|
10–14
|
14–75
|
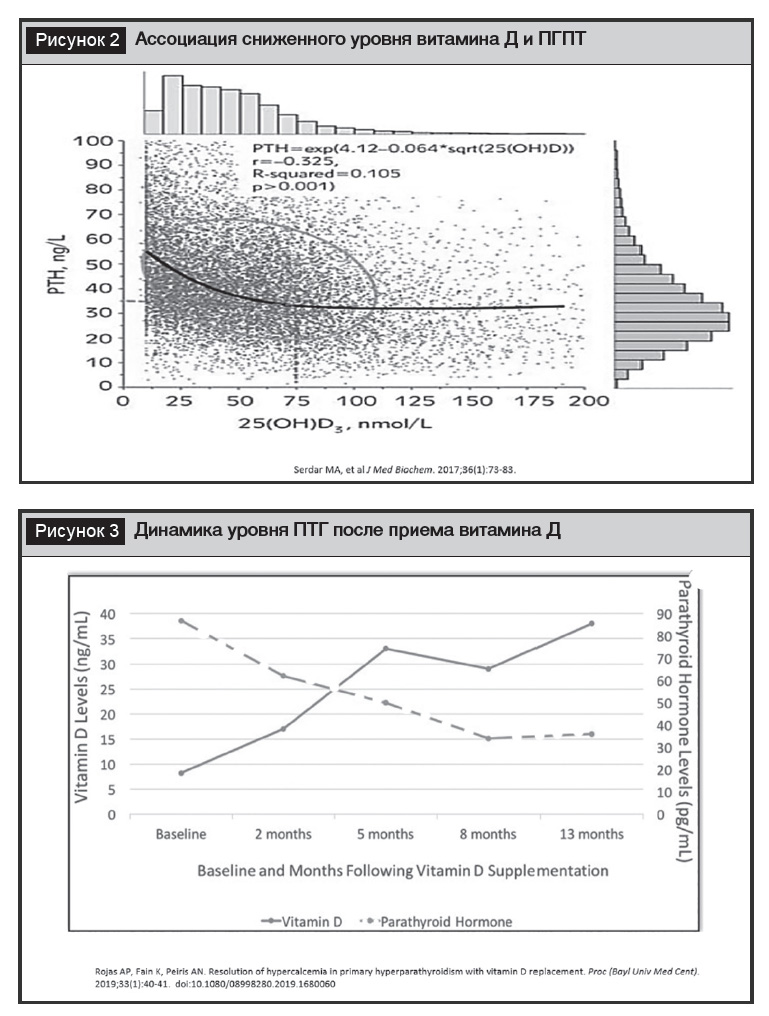
Первичный гиперпаратиреоз (ПГПТ) – заболевание, обусловленное избыточной продукцией ПТГ вследствие первичной патологии ПЩЖ, нечувствительное или малочувствительное к супрессивному влиянию гиперкальциемии. В связи с увеличением доступности рутинного определения кальциемии значимо увеличивается доля форм ПГПТ c верхне-нормальным или незначительно повышенным уровнем кальция крови. Причиной нормокальцемических форм ПГПТ наряду с использованием тиазидных диуретиков, лития, гиперкальцийурии может быть дефицит витамина Д [6–8].
На рисунке 2 приведен график, демонстрирующий взаимосвязь между уровнем ПТГ и обеспеченностью витамином Д. Доказательство связи дефицита витамина Д и ПГПТ обосновывает применение первого в качестве добавок или продуктов, обогащенных витамином Д, для разрешения легкой гиперкальциемии (рис. 3) [9]. Назначение витамина Д допустимо при легкой гиперкальциемии – 2,6–3,0 ммоль/л по уровню общего кальция. При уровне альбумина крови менее 40 г/л (в случае патологии печени, почек и других состояний) рекомендуется скорректировать уровень кальция по альбумину по формуле. Очевидно, что нагрузочные дозы в таких ситуациях недопустимы и оптимальным является использование ежедневного приема витамина Д с титрованием дозы под контролем уровня кальция [10, 11]. Применение витамина Д является альтернативной опцией на пути к выбору радикальной паратиреоидэктомии, которая, как известно, является основным методом лечения ПГПТ.
Вторичный гиперпаратиреоз (ВГПТ) – заболевание, характеризующееся избыточной секрецией ПТГ гипертрофированными ПЩЖ в ответ на нарушение фосфорно-кальциевого обмена или дефицит витамина Д. Развивается при хронической болезни почек (ХБП), остром повреждении почек, синдроме мальабсорбции, рахите, дефиците витамина Д. Заболевание характеризуется гипокальциемией или низко-нормальными уровнями кальция, а также нарушениями, связанными с основным заболеванием. Наиболее часто ВГПТ является следствием дефицита витамина Д или ХБП.
В случае развития ВГПТ вследствие дефицита витамина Д восстановление его нормального уровня приводит к снижению ПТГ и разрешению ВГПТ. Наиболее часто ВГПТ на фоне дефицита витамина Д встречается у пожилых людей.
При развитии ВГПТ на фоне ХБП основными патогенетическими факторами являются тенденция к гипокальциемии и гиперфосфатемии, нарушение гидроксилирования витамина Д в почках в связи с дефицитом 1?-гидроксилазы и снижение кальцитриола, повышение концентрации фактора роста фибробластов-23 (FGF -23) и снижение белка Клото в ответ на задержку фосфатов.
Распространенность дефицита витамина Д среди пациентов с ХБП очень высока, увеличивается с прогрессией почечной недостаточности и достигает 70–85% [12–14]. В нашем исследовании уровень распространенность дефицита витамина Д3 составила 92,1%, что выше, чем в опубликованных исследованиях. Содержание в крови витамина Д3 30 нг/мл и выше было определено только у 7,9% пациентов с ХБП, недостаточность витамина Д3 – у 36,8%, дефицит – у 55,3% пациентов [15].
Ранее считалось, что одним из основных патогенетических механизмов формирования ВГПТ при ХБП является дефицит кальцитриола, возникающий при снижении почечной функции вследствие снижения активности фермента 1?-гидроксилазы в почечной ткани. В настоящее время известно, что дефицит кальцидиола также оказывает значимое влияние. В исследовании у 929 пациентов с додиализными стадиями ХБП была изучена взаимосвязь между уровнями ПТГ и 25(OH)D. Среднее пороговое значение витамина Д, при котором происходит рост ПТГ, составило 8 нг/мл, с верхним пределом 95% ДИ 20 нг/мл. В ходе линейной регрессии были учтены скорость клубочковой фильтрации (СКФ), возраст, раса, уровень ионизированного кальция. Cделан вывод, что уровень 25(OH)D выше 20 нг/мл достаточен для контроля уровня ПТГ, при снижении концентрации витамина Д ниже данного предела уровень ПТГ начинает быстро расти [16].
Плейотропные эффекты витамина Д у пациентов с ХБП имеют более важное значение, чем в общей популяции. Так, известно, что при ХБП риск развития сердечно-сосудистых осложнений в 3,5 раза выше, сердечно-сосудистые заболевания являются наиболее частыми причинами заболеваемости и смертности данной категории [17]. Доказано, что ХБП – независимый фактор сердечно-сосудистых заболеваний [18]. Низкий уровень витамина Д ассоциирован у пациентов с ХБП с эндотелиальной дисфункцией и высокой смертностью по причине сердечно-сосудистых осложнений. В ряде исследований продемонстрирован положительный эффект лечения витамином Д в течение 6–8 недель на показатели эндотелиальной функции сосудов [19].
Важным плейотропным эффектом витамина Д является модуляция адаптивности иммунной системы. В экспериментальных исследованиях он снижает активность Th1- и Th17-лимфоцитов, созревание дендритных клеток, что приводит к общему эффекту снижения системного воспалительного ответа, в том числе в сосудах и сердце [20]. Пациенты с ХБП имеют иммунные нарушения [21]. В результате повышается предрасположенность к инфекциям, а также к хроническому системному воспалению, что, как известно, негативно сказывается на кардиоваскулярной системе.
В ряде исследований показано, что дефицит витамина Д ассоциирован с ускорением прогрессирования снижения функции почек, почечной анемией и ее ответом на лечение препаратами эритропоэтина. Также показано, что применение витамина Д снижает прогрессию альбуминурии у пациентов с диабетической нефропатией [22].
На основании анализа 708 случаев терминальной ХБП и 650 случаев смерти в течение средних периодов наблюдения 4,9–6,5 года было обнаружено, что более низкий уровень 25(ОН)D был связан с незначительным повышением риска смертности [23].
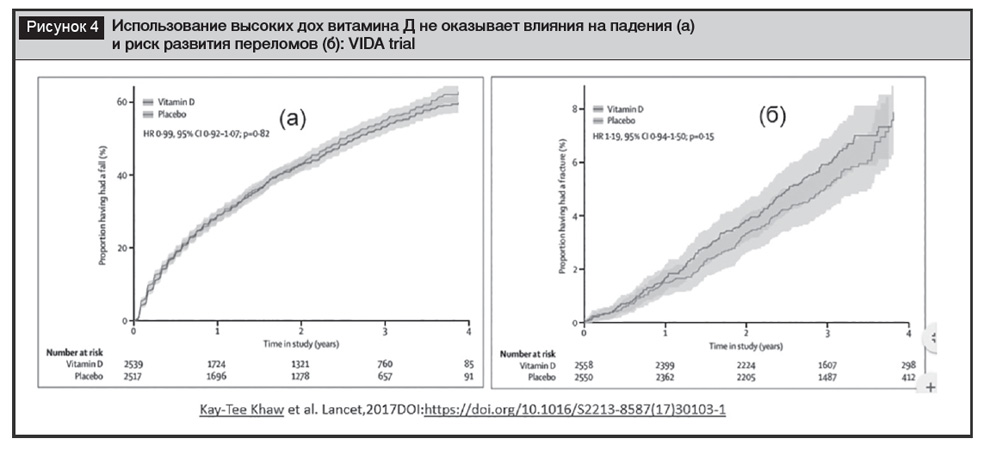
Остеопороз. Основной причиной самой распространенной формы первичного постменопаузального остеопороза является гипергонадотропный гипогонадизм, являющийся характерным проявлением физиологической менопаузы. Позитивные влияния использования добавок кальция и витамина Д повторяются на протяжении многих лет в различных рекомендациях [24–26]. Обновленные в 2020 году практические рекомендации по диагностике и лечению постменопаузального остеопороза указывают, что всем женщинам с постменопаузальным остеопорозом и высоким риском переломов показано обследование для выявления сопутствующих заболеваний, которые вызывают или способствуют потере костной массы. Среди них значимое место занимают заболевания эндокринной системы (акромегалия, сахарный диабет, дефицит гормона роста, гиперкортизолизм, гиперпаратиреоз, гипогонадизм, гипертиреоз, гипофосфатемия, порфирия). Эта рекомендация основана на вкладе перечисленных патологий в развитие остеопороза и необходимости дополнительных лечебных мероприятий. Лечение и профилактика посменопаузального остеопороза включают рекомендации по модификации образа жизни (регулярные упражнения с весовой нагрузкой, равновесием и сопротивлением для минимизации падений, отказ от курения и чрезмерного употребления алкоголя, адекватное потребление кальция и витамина Д, поддержание уровня 25(OH)D ≥30 нг/мл (предпочтительно 30–50 нг/мл), потребление кальция с пищей 1200 мг/сутки для женщин в возрасте ≥50 лет) [27]. Важно отметить, что многолетняя дискуссия о влиянии высоких доз витамина Д (100 000 МЕ/месяц в течение 2,5–4,2 года) на снижение риска падений и переломов завершилась доказательством отсутствия преимуществ высоких доз (рис. 4) [28]. Согласно результатам исследования STURDY (Study to Understand Fall Reduction and Vitamin D in You), у пожилых людей с повышенным риском падений и низким уровнем 25(OH)D добавка витамина Д3 в дозе 1000 МЕ/сутки или выше не предупреждает риск падения в сравнении с дозой 200 МЕ/сутки [29].
Также следует помнить, что при использовании бисфосфонатов или деносумаба риск возникновения гипокальциемии увеличивается при уровне 25(ОН)D менее 20 нг/мл, а оптимальный ответ на антирезорбтивную терапию отмечается при уровне 25(ОН)D более 33 нг/мл [30].
Подход к применению витамина Д, разработанный на модели постменопаузального остеопороза, может быть использован при лечении других форм первичного и вторичного остеопороза (при гипогонадизме, дефиците гормона роста, избытке глюкокортикостероидов и др.) [31, 32].
Эндокринная патология, ассоциированная с плейотропными влияниями витамина Д
Сахарный диабет 1-го типа (СД1). Cо второй половины XX века, после публикации результатов EURODIAB ACE по оценке заболеваемости СД1, были подтверждены предположения о градиенте юг-север и увеличении заболеваемости в северных регионах Европы (за исключением Сардинии), что в итоге привело ученых к пониманию потенциальных эффектов инсоляции и опосредованному влиянию витамина Д на иммунную систему [33].
В результате мeта-анализов исследований по заболеваемости СД1 и обеспеченности 25(ОН)D доказана высокодостоверная связь между дефицитом витамина Д с манифестацией СД1 [34, 35].
Проведены многочисленные исследования, подтвердившие, что молекулярное действие витамина Д связано с поддержанием нормальных уровней активных форм кислорода и Са2+ в состоянии покоя не только в ?-клетках поджелудочной железы, но и в тканях, чувствительных к инсулину. В результате установлены следующие эффекты витамина Д:
– иммуномодулирующее действие, опосредованное наличием VDR на иммунных клетках;
– участие в регуляции генов, участвующих в клеточной пролиферации, дифференциации и функционировании клеток иммунной системы;
– прямое влияние на функцию ?-клеток и повышение секреции инсулина (влияние на комплекс 1,25(ОН)2D3 – VDR – RXR в промоторе гена инсулина), апоптоз (супрессия экспрессии FasL) и модуляцию стимулированной секреции инсулина через внутриклеточную регуляцию потока ионов кальция;
– влияние на чувствительность к инсулину (увеличение количества рецепторов инсулина и др.) [36].
Данные наблюдательных исследований на людях по оценке влияния добавок витамина Д для предупреждения СД1 ограничены и противоречивы. Определено, что раннее применение витамина Д в дозе 400 МЕ/сутки или менее не влияет на риск развития СД1, но дозы 2000 МЕ/сутки и выше могут оказывать протективный эффект [37].
В рандомизированном исследовании Diabetes Autoimmunity Study in the Young (DAISY) была проведена оценка связи между потреблением витамина Д и риском развития островкового аутоиммунитета с последующей манифестацией СД1. Доказано, что ни потребление витамина Д, ни уровень 25(OH)D в течение всего детства не связаны с риском развития островкого аутоиммунитета или СД1 [38]. Сделан вывод, что для окончательного ответа на вопрос о потенциально-превентивном влиянии витамина Д на развитие СД1 необходимы дополнительные исследования.
Сахарный диабет 2-го типа (СД2). Доказано влияние витамина Д на чувствительность к инсулину за счет потенциальной реализации различных патофизиологических механизмов:
– увеличение количества рецепторов инсулина (комплекс 1,25(ОН)2D – VDR – RXR в промоторе гена инсулина);
– регуляция содержания внутриклеточного кальция в клетках скелетных мышц, адипоцитах и др.;
– влияние дефицита витамина Д на увеличение секреции ПТГ и повышение резистентости к инсулину за счет уменьшения GLUT1 и GLUT4 в клеточных мембранах и снижение поглощения глюкозы клетками-мишенями;
– снижение активности ренин-альдостерон-ангиотензиновой системы и ингибирование действия инсулина в тканях [39].
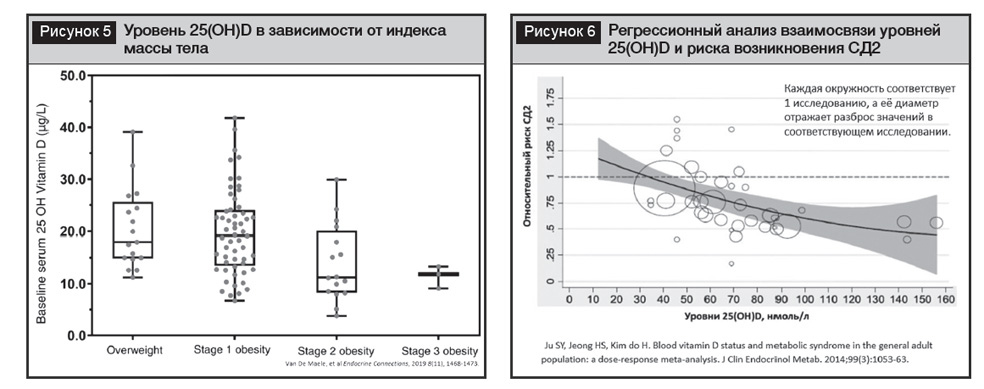
Интересным является факт глобального роста распространенности ожирения, в том числе висцерального, СД2 и дефицита витамина Д. Общие факторы, способствующие развитию этой закономерности, связаны с изменениями образа жизни, включая изменение потребления легкоусвояемых углеводов, ограничение физической активности и дефицит воздействия солнечного света. Связь перечисленных заболеваний может иметь в основе дефицит витамина Д. Сочетание более высокой окружности талии и более низкого уровня 25(ОН)D является доказанным фактом (рис. 5) [41].
На рисунке 6 представлены данные мета-анализа 18 исследований по оценке взаимосвязи уровней 25(OH)D и риска развития СД2, подтверждающие снижение риска СД2 при адекватной обеспеченности витамином Д [42]. С другой стороны, существуют неоспоримые факты, доказывающие нарушения биодоступности витамина Д2 и Д3 при ожирении [43, 44].
Представленное в литературе патогенетическое обоснование связи инсулинорезистентности и дефицита витамина Д позволяет предположить наличие взаимосвязи между уровнем витамина Д и развитием СД2. По данным мета-анализа 18 исследований, доказано, что увеличение уровня 25(OH)D на каждые 10 нмоль/л приводит к снижению риска СД2 на 4% (см. рис. 6) [42].
Представляет интерес возможность использования витамина Д для предупреждения СД2 у лиц с предиабетом. Мета-анализ 9 рандомизированных исследований (43 559 участников) с перио-дом наблюдения 6,7 года позволил заключить, что у пациентов с предиабетом прием витамина Д в умеренных и высоких дозах (≥1000 МЕ/сутки) значительно снижал риск развития СД2 по сравнению с плацебо и более низкими дозами [45].
Подтверждается влияние витамина Д на факторы развития хронических осложнений СД, такие как формирование конечных продуктов гликирования, провоспалительных цитокинов, TNF -? [46, 47]. Низкий уровень 25(ОН)D ассоциирован с развитием заболеваний периферических артерий, диабетических язв и инфекций стопы, а также протеинурии и прогрессией снижения СКФ, использование добавок витамина Д способствует снижению активности немикробного воспаления по уровню СРБ и фактора некроза опухолей ? [48, 49].
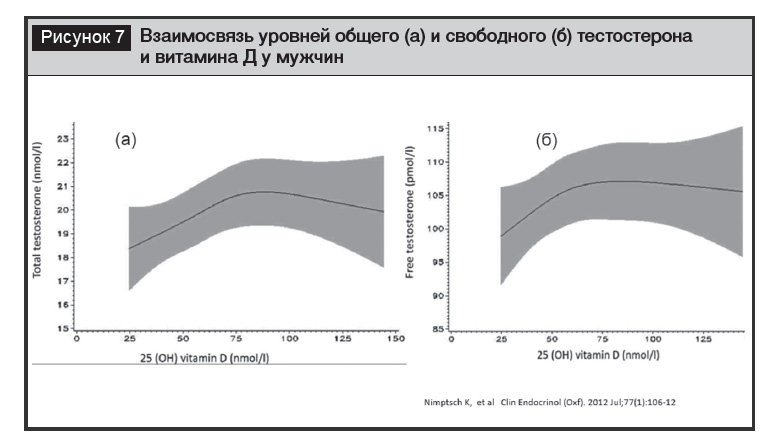
Тестостерон у мужчин. Адекватный уровень 25(OH)D ассоциирован с максимальным значением тестостерона (общего и свободного), а терапия витамином Д и достижение его целевых уровней приводит к увеличению вероятности положительного результата лечения эректильной дисфункции (International Index of Erectile Function) (рис. 7) [50, 51]. Вместе с тем в другом рандомизированном исследовании, в которое включены мужчины с исходно низким уровнем тестостерона, не было продемонстрировано влияние добавок витамина Д на уровень андрогенов [52]. Потенциальное влияние применения витамина Д на содержание тестостерона эксплуатируются в спортивной медицине и у танцоров, но доказательная база требует дополнительных исследований.
Гиперандрогения при синдроме поликистозных яичников (СПКЯ) у женщин. В течение нескольких лет активно обсуждается потенциальная роль витамина Д в патогенезе СПКЯ. Выявляемое снижение ароматазной активности фолликулов, свидетельствующее о роли первично-овариальных факторов в патогенезе заболевания, может быть связано с нарушениями в стероидогенезе и системными метаболическими влияниями. В условиях дефицита витамина Д снижается продукция стероид-секс-связывающего глобулина, что способствует гиперандрогении [53, 54]. По данным рандомизированного исследования, у молодых женщин с СПКЯ и избытком массы тела использование добавок витамина Д способствовало повышению чувствительности к инсулину и снижению веса, что позволяло предположить влияние на репродуктивный потенциал [55]. Более поздние исследования были противоречивы, некоторые из них не подтвердили влияние на репродуктивный потенциал [56].
Другой мета-анализ девяти исследований показал противоположный результат: витамин Д оказал значительное влияние на улучшение развития фолликулов, увеличение количества доминантных фолликулов (OR, 2,34; 95% ДИ 1,39–3,92). Также было выявлено его позитивное влияние при использовании метформина [57]. Важно, что использование добавок витамина Д у пациенток с СПКЯ и ожирением наряду с благотворным влиянием на овуляторные дисфункции и увеличение овариального резерва оказывает позитивное действие на суррогатные маркеры инсулинорезистентности и уровни гликемии, способствуя их нормализации [58]. Поскольку СПКЯ является частой причиной ановуляторных циклов, представляет интерес небольшое исследование в параллельных группах, в котором при проведении стимуляции овуляции кломифеном добавки витамина Д повышали индекс овуляции [59].
Таким образом, подтверждена роль витамина Д в развитии вышеперечисленных эндокринопатий. Это определяет необходимость понимания критериев диагностики его недостаточности и дефицита.
Критерии диагностики недостаточности и дефицита витамина Д
В настоящее время не существует единой позиции по оценке обеспеченности витамином Д. В таблице 2 приведены критерии оценки обеспеченности витамином Д по уровню 25(ОН)D различных экспертных организаций [60–65].
Таблица 2. Критерии определения недостаточности витамина Д по уровню 25(ОН)D
|
Организация
|
Обеспеченность витамином Д, нг/мл
|
|
недостаточность
|
оптимальное содержание
|
|
тяжелая
|
умеренная
|
|
Endocrine Society Clinical Practice
Guideline (2011)
|
<20
|
21–29
|
35–50
|
|
Global Consensus Recommendations on Prevention and Management of Nutritional Rickets, Endocrine Society, 2016
|
<12
|
12–20
|
>12
|
|
Mayo Clinic, 2010
|
<10
|
10–24
|
25–80
|
|
The American Association of Clinical Endocrinologists, 2016
|
|
<30
|
30–50
|
|
The Institute of Medicine (Health and Medicine Division of the National Academies)
|
<12
|
12–20
|
>12
|
|
European Society for Pediatric Gastroenterology, Hepatology, and Nutrition and North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition, 2013
|
<10
|
|
>20
|
|
European Food Safety Authority Panel on Dietetic Products, Nutrition and Allergies, 2016
|
|
|
>20
|
|
Клинические рекомендации Российской ассоциации эндокринологов по диагностике, лечению и профилактике дефицита витамина Д у взрослых, 2016
|
<20
|
20–30
|
30–100
|
Обзор рекомендаций показал, что выраженному дефициту витамина Д соответствует содержание 25(ОН)D в крови <10–12 нг/мл, нижний предел оптимальной обеспеченности – 20–30 нг/мл, верхний – 80–100 нг/мл.
Понимание критериев недостаточности и дефицита витамина Д важно с позиций выбора тактики профилактических или лечебных мероприятий. Резюмируя данные различных рекомендаций по оценке статуса витамина Д, можно заключить, что в большинстве из них в качестве оптимального интервала предлагается считать 30–50 нг/мл.
Определены следующие группы риска по развитию недостаточности или дефицита витамина Д:
– нарушения метаболизма витамина Д (патология печени и почек с нарушением их функции);
– синдром мальабсорбции;
– эндокринные заболевания (гипер- и гипопаратиреоз, гипер- и гипотиреоз, дефицит гормона роста, СД1, аутоиммунный полиэндокринный синдром, нервная анорексия);
– ожирение и кахексия;
– аллергические и аутоиммунные заболевания (бронхиальная астма, атопический дерматит, ревматоидный артрит, коллагенозы и др.);
– лейкозы, лимфомы, злокачественные опухоли;
– кардиоваскулярные болезни (артериальная гипертензия, хронический коронарный синдром);
– использование некоторых лекарственных средств (глюкокортикостероиды, кетоконазол, противовирусные и противоэпилептические препараты) [62].
Все категории пациентов групп риска нуждаются в проведении профилактики дефицита витамина Д. При этом контроль уровня 25(ОН)D не является обязательным для назначения профилактических доз и для контроля их использования. В условиях потенциального увеличения поступления витамина Д в организм (летом, за счет увеличения времени пребывания на солнце с открытыми частями тела) доза может быть уменьшена или вовсе отменена. В случае контроля обеспеченности 25(ОН)D целевой уровень – не менее 30 нг/мл.
Профилактика и лечение недостаточности и дефицита витамина Д
Для поддержания нормальной обеспеченности витамином Д в рекомендациях Эндокринологического общества США предложено использовать 600 ЕД витамина Д у лиц в возрасте 1–70 лет и 800 ЕД – 71 год и старше (табл. 3). Однако, как минимум, 50% людей для достижения уровня витамина Д 75 нмоль/л (30 нг/мл) требуется применение более 1000 ЕД витамина Д в сутки. В рекомендациях IOF принято, что для поддержания уровня более 30 нг/мл людям в возрасте 60 лет и старше необходим ежедневный прием 800–1000 ЕД витамина Д. Показано, что каждые назначенные 100 МЕ повышают уровень 25(OH)D на 1 нг/мл. Недавние исследования выявили, что потребление витамина Д (холекальциферола, эргокальциферола), превышающее рекомендованную норму, имеет ряд положительных эффектов, безопасно, не приводит к гиперкальциемии. Американский институт медицины определил верхний предел суточной дозы витамина Д – 4000 МЕ. В рекомендациях Эндокринологического общества указано, что назначение витамина Д в дозе до 4000 МЕ не требует контроля уровня витамина Д в крови, а максимальная суточная доза для взрослых – 10 000 МЕ [62, 66, 67].
Таблица 3. Рекомендуемые профилактические и лечебные дозы витамина Д
|
Возраст
|
Доза
|
|
Профилактические
|
|
19–70 лет
|
600 МЕ, можно до 1500–2000 МЕ/сут
до достижения уровня >30 нг/мл
|
|
Более 70 лет
|
800 МЕ можно до 1500–2000 МЕ/сут
до достижения уровня > 30 нг/мл
|
|
Лечебные
|
|
Взрослые
|
6000 МЕ/cутки или 50 000 МЕ/неделю в течение 8 недель для достижения уровня 25(OH)D в крови >30 нг/мл.
Затем – поддерживающая терапия: 1500–2000 МЕ/сутки
|
|
Особые случаи
|
Тучные пациенты, или пациенты с синдромом мальабсорбции, или приеме лекарств, влияющих на метаболизм витамина Д: от 6000 до 10 000 МЕ/сутки для достижения уровня >30 нг/мл.
Затем – поддерживающая доза 3000–6000 МЕ/сутки
|
Считается, что имеется большая разница между дозой, необходимой для восполнения дефицита, и дозой, вызывающей токсические эффекты. Известно, что порогом безопасной концентрации в крови витамина Д является 100 мг/мл, что многократно превышает нормальный уровень, до достижения данной концентрации признаки токсичности, в том числе гиперкальциемии, не проявляются. Период полувыведения витамина Д составляет 480 часов (20 суток). С учетом данных о безопасности применения высоких доз витамина Д, а также длительный период полувыведения применение препаратов витамина Д возможно 1 раз в день, 1 раз в неделю, 1 раз в несколько недель с соответствующим увеличением разовой дозы. Европейское эндокринологическое общество при установленном дефиците витамина Д рекомендует применение 50 000 МЕ 1 раз в неделю в течение 8 недель, далее – 1500–2000 МЕ ежедневно [62].
Рекомендуемые в настоящее время лечебные дозы для устранения недостаточности витамина Д составляют от 800 до 1500–2000 МЕ в сутки до достижения уровня более 30 нг/мл без обязательного контроля. У тучных пациентов, или лиц с синдромом мальабсорбции, или при приеме лекарств, влияющих на метаболизм витамина Д, доза может быть увеличена в 2–3 раза. В случае доказанной недостаточности (дефиците) витамина Д рекомендуемая лечебная доза (см. табл. 3) составляет 6000 МЕ в день или 50 000 МЕ в неделю в течение 8 недель для достижения уровня 25(OH)D в крови выше 30 нг/мл. Затем следует поддерживающая терапия с использованием профилактической дозы (1500–2000 МЕ/сутки) для предотвращения рецидива развития дефицита витамина Д. В особых случаях (тучные пациенты, или лица с синдромом мальабсорбции, или при приеме лекарств, влияющих на метаболизм витамина Д) лечебная доза увеличивается и составляет от 6000 до 10 000 МЕ/сутки для достижения уровня выше 30 нг/мл с последующим приемом поддерживающей дозы 3000–6000 МЕ/сутки. При использовании лечебных доз время года не имеет значения, а контроль обеспеченности проводится в обязательном порядке через 6 недель с последующим решением вопроса о коррекции дозы. Кратность исследования 25(ОН)D определяется динамикой изменения его уровня в крови на фоне лечения [62, 64].
В настоящее время рекомендации по диагностике, лечению и профилактике дефицита витамина Д при ХБП не отличаются от рекомендаций в общей популяции. Однако в силу ряда особенностей метаболизма и действия витамина Д у пациентов с ХБП данный подход является дискутабельным. В нашем исследовании показано, что у лиц с ХБП 2–5, дефицитом витамина Д и ВГПТ применение холекальциферола в дозе 1000–3000 МЕ в сутки позволяет ликвидировать дефицит витамина Д. Вместе с тем, несмотря на достоверный рост уровня витамина Д крови в группе пациентов, получавших холекальциферол, в целом по группе не было выявлено статистически значимого снижения уровня ПТГ. Также не установлено статистически значимых эффектов на частоту встречаемости жалоб, характерных для ВГПТ, и ассоциированных минеральных и костных нарушений, а также на уровни маркеров костного метаболизма. Не выявлено негативных эффектов в отношении фосфорно-кальциевого обмена и иных нежелательных реакций, связанных с применение холекальциферола. При этом по истечении 12 месяцев терапии в группе пациентов, получавших витамин Д, отмечена тенденция к снижению СКФ [68]. На основании проведенного исследования был разработан метод лечения недостаточности витамина Д, в соответствии с которым при уровне витамина Д крови <20 нг/мл рекомендуется ежедневный прием 2000 МЕ, при 25(OH)D <10 нг/мл – 3000 МЕ холекальциферола [69].
Дискутабельным является вопрос о предпочтительности использования режима ежедневного приема или «больших» доз в режиме приема 1 раз в неделю. Как следует из приведенных рекомендаций, мнение экспертов свидетельствует об отсутствии различий, но это неоднозначно. Поскольку общеизвестным противопоказанием для использования витамина Д является гиперкальциемия, очевидно, что у лиц с высоким риском гиперкальциемии оптимально использование не нагрузочных, а ежедневных доз. При проведении сплошного скрининга было установлено, что частота встречаемости гиперкальциемии у взрослых составила 2,6±0,15 на 100 человек (с увеличением у женщин 51–70 лет до 5,3±1,15 на 100 человек) [70]. Также выявлено, что факторами, ассоциированными с развитием гиперкальциемии, являются наличие переломов в анамнезе, мочекаменной болезни, язвенной болезни 12-перстной кишки или желудка, желчнокаменной болезни, гастрита, СД2, артериальной гипертензии.
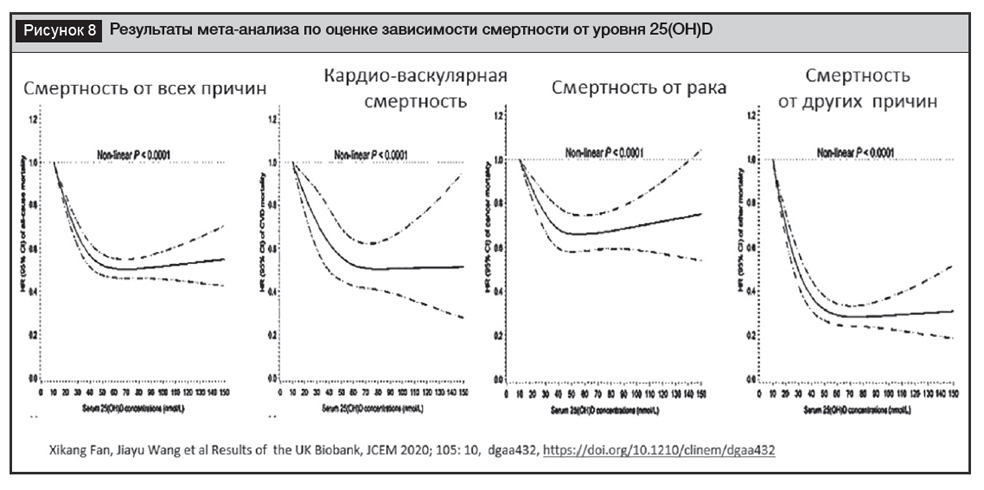
Опубликованы данные рандомизированных исследований по оценке плейотропных эффектов витамина Д, не связанных с патологией легких, сердечно-сосудистой системы, раком и др., не являющихся предметом данного обзора. Однако, суммируя данные о потенциале витамина Д, важно оценивать его влияние на смертность. Несколько различных мета-анализов демонстрируют связь между низким уровнем 25(OH)D и повышенным риском смертности от всех причин, а также снижение смертности от всех причин на приблизительно 7% и смертности от рака на примерно 13% у пациентов, получавших витамин Д3 [71–73]. Последний и наиболее масштабный мета-анализ, проведенный по данным Биобанка Великобритании, включавший наблюдение за 500 000 пациентов без диагностированной кардиоваскулярной патологии в течение 8,9 (8,3–9,5) года и зарегистрировавший 10 175 смертельных исходов, позволил доказать снижение смертности от всех причин, от рака, кардиоваскулярной патологии и других причин у лиц с адекватной обеспеченностью витамином Д (25(ОН)D более 40 нг/мл) (рис. 8) [74].
Заключение
Приведенные факты свидетельствуют о связи дефицита витамина Д с различными эндокринопатиями и о потенциальных влияниях на их течение. Получены доказательства пользы поддержания адекватной обеспеченности витамином Д, в том числе снижения смертности от всех причин. До сих пор обсуждается, какой диапазон концентрации витамина Д в крови считать оптимальным и насколько оправдано достижение концентраций в крови 50 нг/мл и выше. В настоящее время большинство исследований проводится в области нижних пределов обеспеченности данным важным витамином.
С учетом фармакодинамики и фармакокинетики витамина Д, а также основного противопоказания (гиперкальцие-мии) оптимальным вариантом является ежедневный прием. Применение больших доз с периодичностью реже 1 раза в неделю является нефизиологичным и неоправданным в большинстве случаев.
Л И Т Е Р А Т У Р А
1. The Vitamins (Second Edition) / Eds: W.H. Sebrell, R.S. Harris. – eBook ISBN: 9781483220130.
2. Norman A.W. // Am. J. Clin. Nutr. – 2008. – Vol.88, N2. – P.491S–499S.
3. Muscogiuri G., Mitri J., Mathieu C., et al. // Eur. J. Endocrinol. – 2014. – Vol.171, N3. – P.101–110.
4. Bollerslev J., Rejnmark L., Marcocci C., et al. // Eur. J. Endocrinol. – 2015. – Vol.173, N2. – G1–G20.
5. Patel K.N., Yip L., Lubitz C.C., et al. // Ann. Surg. – 2020. – Vol.271, N3. – e21–e93.
6. Silverberg S.J. // J. Bone Miner. Res. – 2007. – Vol.22, Suppl.2. – P.100–104.
7. Silverberg S.J., Clarke B.L., Peacock M., et al. // JCEM. – 2014. – Vol.99, N10. – P.3580–3594.
8. Serdar M.A., Batu Can B., Kilercik M., et al // J. Med. Biochem. – 2017. – Vol.36, N1. – P.73–83.
9. Rojas A.P., Fain K., Peiris A.N. // Bayl. Univ. Med. Cent. – 2019. – Vol.33, N1. – P.40–41.
10. Wilhelm S.M., Wang T.S., Ruan D.T., et al. // JAMA Surg. – 2016. – Vol.151, N10. – P.959–968.
11. Hyperparathyroidism (primary): diagnosis, assessment and initial management [NG132]. National Institute for Health and Care Excellence. 2019. https://www.nice.org.uk/guidance/ng132
12. Kandula P., Dobre M., Schold J.D., et al. // Clin. J. Am. Soc. Nephrol. – 2011. – Vol.6, N1. – P.50–62.
13. Obi Y., Hamano T., Isaka Y. // Dis Markers. – 2015. doi: 10.1155/2015/868961.
14. Williams S., Malatesta K., Norris K. // Ethn. Dis. – 2009. – Vol.19, N4, Suppl.5. – S5–11.
15. Карлович Н.В. // Леч. дело – 2016. – №5 (51). – С.35–39.
16. Tonelli M., Muntner P., Lloyd A., et al. // Lancet. – 2012. – Vol.380. – P.807–814.
17. Chitalia N., Ismail T., Tooth L., et al. // PLoS One. – 2014. – Vol.9, N3. – e91363.
18. Scamps-Latscha B., Herbelin A., Nguyen A.T., et al. // Semin. Nephrol. – 1994. – N14. – P.253–260.
19. Barrat F.J., Cua D.J., Boonstra A., et al. // J. Exp. Med. – 2002. – Vol.195. – P.603–616.
20. Lou Y.R., Molnar F., Perakyla M., et al. // J. Steroid Biochem. Mol. Biol. – 2010. – Vol.118. – P.162–170.
21. Muller K., Bendtzen K. // J. Investig Dermatol. Symp. Proc. – 1996. – N1. – P.68–71.
22. Карлович Н.В., Мохорт Т.В. // Леч. дело. – 2016. – №4 (50). – С.73–80.
23. Bansal N., Katz R., Appel L., et al. // Kidney Int. Rep. – 2019. – Vol.4, N11. – P.1598–1607.
24. Heike A. Bischoff-Ferrari H.A, Walter C., et al. // NEJM. – 2012. – Vol.367. – P.40–49.
25. Autier P., Gandini S. // Arch. Intern. Med. – 2007. – Vol.167. – P.1730–1737.
26. Hansen K.E., Johnson R.E., Chambers K.R., et al. // JAMA Intern. Med. – 2015. – Vol.175. – P.1612–1621.
27. Camacho P.M., Petak S.M., Binkley N., et al. // Endocrine Practice. – 2020. – Vol.26, Suppl.1. – P.1–46.
28. Khaw K.T., Stewart A.W., Waayer D., et al. // Lancet Diabetes Endocrinol. – 2017. – Vol.5, N6. – P.438–447.
29. Appel L.J., Michos E.D., Mitchell C.M. // Ann. Int. Med. – 2020. doi:10.7326/m20-3812.
30. Carmel A.S., Shieh A., Bang H., Bockman R.S. // Osteoporos. Int. – 2012. – Vol.23, N10. – P.2479–2487.
31. Watts N.B., Adler R.A., Bilezikian J.P., et al. // JCEM. – 2012. – Vol.97, N6. – P.1802–1822.
32. Adami G., Saag K.G. // Osteoporos. Int. – 2019. – Vol.30, N6. – P.1145–1156.
33. Green A., Gale E.A.M., Patterson C.C. // Lancet. – 1992. – Vol.339 (8798). – P.905–909.
34. Liu C., Lu M., Xia X., et al. // Nutr. Hosp. – 2015. – Vol.32, N4. – P.1591–1594.
35. de Oliveira V.R.L.S., Domingueti C.P. // Int. J. Diabetes Dev. Ctries. – 2018. – N38. – P.280–288.
36. Szymczak-Pajor I., Sliwinska A. // Nutrients. – 2019. – Vol.11, N4. – P.794.
37. Harris S.S. // J. Nutr. – 2005. – Vol.135, N2. – P.323–325.
38. Simpson M., Brady H., Yin X., et al. // Diabetologia. – 2011. – Vol.54, N11. – P.2779–2788.
39. Szymczak-Pajor I., Sliwinska A. // Nutrients. – 2019. – Vol.11, N4. – P.794.
40. Wimalawansa S.J. // J. Diabetes Metab. Disord. Control. – 2016. – Vol.3, N1. – P.6–13.
41. Van De Maele K., De Schepper J., Vanbesien J., et al. // Endocr. Connect. – 2019. – N8 (11). – P.1468–1473.
42. Ju S.Y., Jeong H.S., Kim do H. // JCEM. – 2014. – Vol.99, N3. – P.1053–1063.
43. Wortsman J., Matsuoka L.Y., Chen T.C., et al. // Am. J. Clin. Nutr. – 2000. – Vol.72, N3. – P.690–693.
44. Zhou J.C., Zhu Y.M., Chen Z., et al. // Public Health Nutr. – 2015. – Vol.18, N12. – P.2211–2219.
45. Barbarawi M., Zayed Y., Barbarawi O., et al. // JCEM. – 2020. – Vol.105, N8. – P.335.
46. Talmor Y., Golan E., Benchetrit S., et al. // Am. J. Physiol. Renal. Physiol. – 2008. – Vol.294, N5. – P.1059–1064.
47. Mousa A., Misso M., Teede H., et al. // BMJ Open. – 2016. – Vol.6, N4. – e010804.
48. Greenhagen R.M., Frykberg R.G., Wukich D.K. // Diabet Foot Ankle. – 2019. – Vol.10, N1. – e.1579631.
49. Mousa A., Naderpoor N., Teede H., et al. // Nutr. Rev. – 2018. – Vol.76, N5. – P.380–394
50. Nimptsch K., Platz E.A., Willett W.C., Giovannucci, E. // Clin. Endocrinol. (Oxf.). – 2012. – Vol.77, N1. – P.106–112.
51. Tirabassi G., Sudano M., Salvio G., et al. // Int. J. Endocrinol. – 2018.
52. Lerchbaum E., Trummer C., Theiler-Schwetz V., et al. // Eur. J. Nutr. – 2019. – N58. – P.3135–3146.
53. Irani M., Merhi Z. // Fertil. Steril. – 2014. – Vol.102, N2. – P.460–468.
54. Kumar A., Barki S., Raghav V., et al. // J. Fam. Med. Prim. Care. – 2017. – Vol.6, N1. – P.115–119.
55. Belenchia A.M., Tosh A.K., Hillman L.S., Peterson C.A. // J. Clin. Nutr. Am. – 2013. – Vol.97, N4. – P.774–781.
56. Miao C.Y., Fang X.J., Chen Y., Zhang Q. // Exp. Ther. Med. – 2020. – Vol.19, N4. – P.2641–2649.
57. Fang F., Ni K., Cai Y., et al. // Complem. Ther. Clin. Priact. – 2017. – N26. – P.53–60.
58. Gupta T., Rawat M., Gupta N., Arora S. // J. Obstet. Gynaecol. India. – 2017. – Vol.67, N5. – P.349–355.
59. Rasheedy R., Sammour H., Elkholy A., et al. // Endocrine. – 2020. – N69. – P.393–401.
60. Kennel K.A., et al. // Mayo Clin. Proc. – 2010. – N85. – P.752–758.
61. Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D and Calcium. Dietary Reference Intakes for Calcium and Vitamin D / A.C. Ross, C.L. Taylor, A.L. Yaktine, et al. – Washington, 2011. PMID: 21796828.
62. Holick M.F., Binkley N.C., Bischoff-Ferrari H.A., et al. // J. Clin. Endocrinol. Metab. – 2011. – Vol.96. – P.1911–1930.
63. Camacho P.M., Petak S.M., Binkley N., et al. // Endocr. Pract. – 2016. – Vol.22, Suppl.4. – P.1–42.
64. Amrein K., Scherkl M., Hoffmann M., et al. // Eur. J. Clin. Nutr. – 2020. – Vol.74, N11. – P.1498–1513.
65. Пигарова Е.А., Рожинская Л. Я. [и др.] // Пробл. эндокр. – 2016. – №4. – С.60–84.
66. World Health Organization Scientific Group on the Prevention and Management of Osteoporosis. Prevention and management of osteoporosis: report of a WHO scientific group. – Geneva, 2003. – N921. – P.9.
67. Dawson-Hughes B., Mithal A., Bonjour J.P., et al. // Osteoporos. Int. – 2010. – Vol.21, N7. – P.1151–1154.
68. Карлович Н.В., Сазонова Е.Г., Валовик О.Э. [и др.] / Леч. Дело. – 2019. – №4 (68). – С.34–40.
69. Карлович Н.В., Мохорт Т.В., Сазонова Е.Г., Валовик О.Э., Юреня Е.В. Метод лечения недостаточности витамина Д / Инструкция по применению. – №154-1220, 16.12.2020.
70. Бруцкая-Стемпковская Е.В. Характеристики костных проявлений первичного гиперпаратиреоза у женщин в постменопаузальном периоде, обоснование ранней диагностики заболевания: Автореф. дисс. на соискание уч.ст. к.м.н. – Минск, 2019. – 20 c.
71. Bjelakovic G., Gluud L.L., Nikolova D., et al. // Cochrane Datab. Syst. Rev. – 2014. https:// doi.org/10.1002/14651858.CD007470.pub370.
72. Gaksch M., Jorde R., Grimnes G., et al. // PLoS One. – 2017. – N12. – e0170791.
73. Aspelund T., Grübler M.R., Smith A.V., et al. // Nutrients. – 2019. – N11. – P.74.
74. Fan X., Wang J., Song M., et al. // JCEM. – 2020. – Vol.105, Iss.10. – e3606–3619.
Медицинские новости. – 2021. – №4. – С. 25-33.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.