Внимание! Статья адресована врачам-специалистам
Sujayeva V.A.
Republican Scientific and Practical Center “Cardiology”, Minsk, Belarus
General principles of physical trainings and optimal drug therapy
in patients with chronic coronary syndromes and heart failure
Резюме. Приведен обзор Рекомендаций Европейского общества кардиологов (ESC) по спортивной кардиологии и физическим тренировкам у пациентов с сердечно-сосудистыми заболеваниями (2020). Рассмотрены принципы оценки риска развития осложнений, связанных с физическими тренировками, у пациентов с хроническими коронарными синдромами и сердечной недостаточностью. Представлены основные принципы оптимальной медикаментозной терапии, без которой не могут осуществляться физические тренировки у указанных категорий пациентов. Рекомендации по занятиям спортом на профессиональном и любительском уровне, а также по физическим тренировкам приведены с учетом принципов доказательной медицины.
Ключевые слова: физические тренировки, риск, хронические коронарные синдромы, сердечная недостаточность, стресс-тесты, оптимальная медикаментозная терапия, ивабрадин.
Медицинские новости. – 2021. – №5. – С. 29–34.
Summary. The article provides an overview of the European Society of Cardiology Guidelines on Sport cardiology and exercise in patients with cardiovascular disease (2020). The principles of assessing the risk of complications associated with physical training in patients with chronic coronary syndromes and heart failure are considered. The basic principles of optimal drug therapy, without which physical training cannot be carried out in these categories of patients, are given. Recommendations for professional, recreational sports and exercise are based on evidence-based medicine principles.
Keywords: exercise, risk, chronic coronary syndromes, heart failure, stress tests, optimal medical therapy, ivabradine.
Meditsinskie novosti. – 2021. – N5. – P. 29–34.
Сердечно-сосудистые заболевания (ССЗ) являются неотъемлемым спутником цивилизации, приводящим к снижению физической работоспособности (ФРС), качества жизни и зачастую – к утрате профессии. В настоящий момент ССЗ выступают одной из основных причин смертности у взрослого населения, протекающие бессимптомно ССЗ приводят к внезапной сердечной смерти (ВСС) как профессиональных спортсменов, так и занимающихся физкультурой и спортом на любительском уровне. И те, и другие могут иметь недиагностированные или недооцененные факторы риска – артериальную гипертензию (АГ), сахарный диабет (СД), дислипидемию, которые при отсутствии адекватного лечения приводят к развитию атеросклероза коронарных артерий.
Для обеспечения безопасности физических тренировок (ФТ) профессионалов и спортсменов-любителей хронические коронарные синдромы (ХКС) должны быть выявлены предварительно, перед началом регулярных занятий и участием в соревнованиях у здоровых спортсменов, а также перед назначением комплексной кардиологической реабилитации с включением ФТ у лиц, имеющих диагностированные ССЗ. И в первом, и во втором случае используются различные стресс-тесты: с физической нагрузкой (велоэргометрическая проба (ВЭП) или тредмил-тест) или пробы с фармакологической нагрузкой (стресс-тест с допамином или добутамином). Выбор вида нагрузки и способа визуализации определяется в каждом конкретном случае с учетом цели исследования (допуск к участию в соревнованиях, возврат к ФТ после перенесенного заболевания или комплексная кардиологическая реабилитация с включением ФТ), наличия и степени выраженности факторов риска, исходной ЭКГ, данных анамнеза, оснащенности учреждения, опыта врача-исследователя.
Стресс-тесты с физической нагрузкой и электрокардиографической (ЭКГ) визуализацией – это наиболее дешевые и общедоступные функциональные пробы, позволяющие выявить стресс-индуцируемые нарушения ритма и проводимости, ишемию миокарда, оценить реакцию частоты сердечных сокращений (ЧСС) и артериального давления (АД) на нагрузку, оценить общую ФРС и индивидуальную толерантность к физической нагрузке (ТФН), которые используются в дальнейшем для построения индивидуальных программ ФТ.
При наличии технической возможности во время стресс-теста одновременно определять содержание кислорода и углекислого газа во вдыхаемом и выдыхаемом воздухе (спироэргометрия) можно определить аэробную ФРС максимальное потребление кислорода – VO2 peak), что позволит еще больше индивидуализировать режим ФТ, сделав их аэробными.
Однако при использовании ЭКГ-визуализации стресс-тесты имеют более низкую специфичность в выявлении ишемии миокарда, чем другие функциональные пробы, особенно у бессимптомных и лиц из группы низкого риска. Кроме того, при наличии исходных изменений на ЭКГ (мерцательная аритмия, прием дигиталиса, гипертрофия желудочков, блокада ножек пучка Гиса, имплантация электрокардиостимулятора – ЭКС и т.д.) результаты теста в выявлении ишемических изменений на нагрузку будут неинформативны или мало информативны. В этом случае целесообразно использовать другие методы визуализации – эхокардиографию (ЭхоКГ), компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ), однофотонную эмиссионную компьютерную томографию (ОФЭКТ) или позитронную эмиссионную томографию (ПЭТ) (табл. 1).
Таблица 1. Инструментальная диагностика у пациентов с подозрением на БКА (согласно Рекомендациям Европейского общества кардиологов по хроническим коронарным синдромам, 2019) [10]
|
Рекомендация
|
Класс
|
Уровень
|
|
Неинвазивные функциональные тесты для выявления ишемии миокарда или КТА КА рекомендованы
в качестве начальных тестов для диагностики БКА у симптомных пациентов, у которых БКА не может быть исключена только клинически
|
I
|
В
|
|
Выбор неинвазивного теста для начальной диагностики рекомендован с учетом клинической вероятности наличия БКА, характеристик пациента, влияющих на выполнение теста, особенностями выполнения теста, опыта и доступности
|
I
|
С
|
|
Рекомендовано проводить функциональные тесты для визуализация ишемии миокарда, если по данным КТА КА получены неоднозначные данные
|
I
|
В
|
|
Стресс-тест с ЭКГ рекомендован для оценки толерантности к физической нагрузке, симптомов ишемии, аритмий, АД и риска у отдельных категорий пациентов
|
I
|
С
|
|
Стресс-тест с ЭКГ можно рассмотреть в качестве альтернативы для исключения/подтверждения наличия БКА в том случае, когда другие неинвазивные/инвазивные функциональные тесты не доступны
|
IIb
|
В
|
|
Стресс-тесты с ЭКГ могут рассматриваться у пациентов, получающих лечение, для оценки эффективности для контроля симптомов/ишемии миокарда
|
IIb
|
С
|
|
Выполнение стресс-тестов с ЭКГ не рекомендовано у принимающих дигиталис
|
III
|
С
|
Примечание: КТА КА – компьютерная томографическая ангиография коронарных артерий.
Таблица 2. Рекомендации для пациентов с длительно существующими ХКС (по European Society of Cardiology Guidelines on Sport cardiology and exercise in patients with cardiovascular disease, 2020) [13]
|
Рекомендация
|
Класс
|
Уровень
|
|
Стратификация риска возникновения побочных эффектов, вызванных физической нагрузкой, рекомендуется у лиц с установленным диагнозом ХКС (длительно существующим) до начала занятий спортом
|
I
|
С
|
|
Соревновательные занятия спортом не рекомендуются лицам с высоким риском нежелательных явлений, вызванных ФТ, или пациентам с верифицированной остаточной ишемией миокарда,
за исключением индивидуально рекомендованных видов спорта, связанных с навыками
|
III
|
С
|
В зависимости от выбранного протокола исследования стресс-тесты могут быть максимальными (когда достигается максимальная для данного возраста ЧСС) или субмаксимальными (когда достигается ЧСС, составляющая 75–85% от рассчитанной по номограммам максимальной для данного пола и возраста). Максимальные стресс-тесты следует проводить после стратификации риска у лиц с возможными субклиническими ХКС, если они намереваются участвовать в регулярных ФТ или спортивных соревнованиях [10].
Маркеры высокого риска развития осложнений, связанные с физической нагрузкой (ФН) [13].
1. Критический стеноз >70% одной из основных КА или >50% ствола левой КА и/или фракционный резерв кровотока (ФРК) <0,8 или моментальный резерв кровотока (МРК) <0,9.
2. Фракция выброса (ФВ) левого желудочка (ЛЖ) ≤50% или зоны нарушения локальной сократимости миокарда по данным трансторакальной ЭхоКГ.
3. Индуцируемая при максимальном стресс-тесте с ФН ишемия миокарда.
4. Неустойчивые пароксизмы суправентрикулярной тахикардии (СВТ), полиморфная или очень частая желудочковая экстрасистолия (ЖЭС) в состоянии покоя или при максимальной ФН.
5. Недавно (<12 месяцев) перенесенный ОКС, чрескожные коронарные вмешательства (ЧКВ) или хирургическая реваскуляризация миокарда.
Рекомендации ESCпо спортивной кардиологии (2020) с учетом принципов доказательной медицины представлены в таблице 2. Так, в Рекомендациях ESC (2020) предложена оптимальная тактика по принятию решения о занятиях ФТ на профессиональном и любительском уровне (рис. 1).
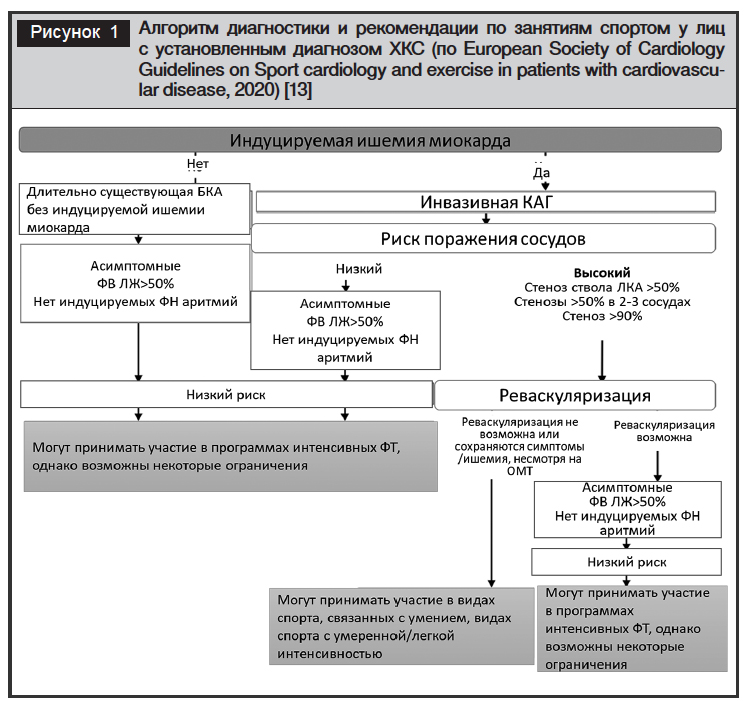
Согласно Рекомендациям ESCпо ведению ХКС (2019), кардиологическая реабилитация, основанная на ФТ, рекомендована в качестве средства поддержания здорового образа жизни и влияния на факторы риска у пациентов со стабильной болезнью коронарных артерий (БКА) (I, A) [10].
Однако ФТ у лиц, имеющих диагностированные ХКС, должны проводиться только на фоне оптимальной медикаментозной терапии (ОМТ), которая, с одной стороны, обеспечивает удовлетворительный контроль симптомов стенокардии/ишемии миокарда, с другой стороны – способствует предотвращению развития неблагоприятных сердечно-сосудистых событий, ассоциированных с ХКС, при максимальной приверженности пациента к лечению и развитии минимальных побочных эффектов [10, 13].
Согласно действующим Рекомендациям (2019), ОМТ симптомных пациентов с ХКС предполагает назначение, как минимум, одного лекарственного средства (ЛС) для уменьшения выраженности стенокардии/ишемии миокарда в совокупности с ЛС для предотвращения неблагоприятных сердечно-сосудистых событий (I, С) [10].
Антиангинальными/антиишемическими препаратами 1-й линии являются ?-адреноблокаторы (БАБ) или антагонисты ионов кальция (АК), которые должны назначаться для контроля ЧСС и симптомов стенокардии (I, А) [10].
Если симптомы стенокардии недостаточно контролируются на фоне терапии БАБ или АК, следует рассмотреть комбинацию двух антиангинальных ЛС (IIа, С).
Никорандил, ранолазин или ивабрадин следует рассматривать в качестве терапии 2-й линии для уменьшения частоты приступов стенокардии и улучшения ТФН у пациентов с ХКС, которые не переносят, имеют противопоказания или не достигают контроля симптомов на фоне приема БАБ, АК и нитратов пролонгированного действия (IIа, В).
У отдельных пациентов в качестве терапии 1-й линии можно рассмотреть комбинацию БАБ или АК с препаратами 2-й линии (ранолазин, никорандил, ивабрадин, триметазидин) с учетом ЧСС, АД и переносимости (IIb, В) [10].
Следует также помнить, что для профессиональных спортсменов БАБ, в отличие от ивабрадина, внесены в список Всемирного антидопингового агентства как субстанции, запрещенные в отдельных видах спорта как в соревновательный период (автоспорт, бильярдный спорт, дартс, гольф, лыжный спорт/сноубординг, подводное плавание), так и во внесоревновательный период (стрельба из лука, стрельба) [1].
Эффективность ивабрадина при стенокардии достигается за счет нескольких механизмов. Наиболее очевидным является уменьшение потребности миокарда в кислороде за счет отрицательного хронотропного действия, причем, как в состоянии покоя, так и при нагрузке. При этом за счет удлинения фазы диастолы увеличивается субэндокардиальный кровоток [4] и улучшается перфузия миокарда [3]. В этом состоит одно из важнейших отличий ивабрадина от БАБ, которые также обладают отрицательным хронотропным эффектом, но способствуют пролонгированию фазы систолы. Также ивабрадин имеет свойство поддерживать коронарную вазодилятацию во время физической нагрузки, в то время, как БАБ оказывают вазоконстрикторное действие на коронарные артерии за счет блокады ?-адренорецепторов [4]. Очень важно, что ивабрадин в отличие от ?-блокаторов не приводит к другим гемодинамическим эффектам: не ухудшает проводимость, сократимость, диастолическую функцию миокарда и метаболический профиль, не снижает АД и не увеличивает периферическое сосудистое сопротивление.
Взаимосвязь между уменьшением ЧСС на фоне приема ивабрадина и улучшением коллатерального коронарного кровотока у пациентов со стабильной стенокардией выявлена S. Gloeklerи соавт. (2014). У 46 пациентов со стабильной стенокардией инвазивно определялся индекс коллатерального кровотока (ИКК) во время баллонной окклюзии коронарной артерии исходно и через 6 месяцев приема ивабрадина или стандартной антиангинальной терапии. Установлено, что в группе ивабрадина имел место достоверный прирост ИКК на 41% (р=0,0461), в то время, как в группе стандартного лечения наметилась тенденция к его снижению на 28% (р=0,12) [9].
В исследовании P. Colinи соавт. (2004) установлено, что после внутривенного введения ивабрадина в дозе 0,25, 0,5 и 1,0 мг/кг массы тела наблюдалось дозозависимое уменьшение тахикардии при нагрузке на тредмиле, которое не сопровождалось нарушениями как локальной, так и глобальной контрактильной способности миокарда [6]. Также выявлена линейная закономерность между ЧСС и VO2peakво время теста с чреспищеводной стимуляцией предсердий [15]. Ивабрадин не уступал атенололу в уменьшении стресс-индуцированной ишемии миокарда при наличии гемодинамически значимых стенозов КА [20].
K. Werdanи соавт. провели анализ эффективности ивабрадина для лечения стабильной стенокардии различной степени выраженности по данным обсервационных исследований. В анализ включены данные 8555 пациентов со стабильной стенокардией напряжения I–IVфункциональных классов (ФК), из них 19% составили лица старше 75 лет, 41% имели ИМ в анамнезе, 91% страдали АГ, 80% – дислипидемией. При включении в исследование 96% пациентов имели, как минимум, 2 приступа стенокардии в неделю, у 27% тяжесть стенокардии соответствовала ФК I, у 53% – ФК II, у 20% – ФК IIIи IV. Через 4 месяца приема ивабрадина 9 из 10 пациентов отмечали отсутствие стенокардии, исчезла тяжелая стенокардия ФК IIIи IV, удельный вес лиц с наиболее легкой стенокардией ФК Iувеличилось до 67%, доля пациентов с более выраженной стенокардией ФК IIснизилась до 29%. Таким образом, прием ивабрадина в дозе 7,5 мг 2 раза в день через 4 месяца приводил к уменьшению удельного веса лиц с тяжелой стенокардией в 5 раз за счет перехода в более легкие формы [21].
В исследовании J. Zarifisи соавт. (2016) доказана эффективность ивабрадина для лечения стенокардии у прооперированных пациентов. В исследование включено 926 пациентов после АКШ/ЧКВ. Через 4 месяца число приступов резидуальной стенокардии уменьшилось в 7,3 раза от 2,2±2,3 до 0,3±0,6 приступов (р<0,001) соответственно, потребность в дополнительном приеме нитроглицерина снизилась в 15 раз – от 1,5±2,2 до 0,1±0,4 таблетки (р<0,001) [22].
Таким образом, назначение ивабрадина при ХКС показано:
– пациентам со стабильной стенокардией ЧСС ≥70 уд./мин. при непереносимости или наличии противопоказаний к применению БАБ;
– пациентам со стабильной стенокардией ЧСС ≥70 уд./мин. в комбинации с БАБ при недостаточном контроле симптомов стабильной стенокардии на фоне оптимальной дозы БАБ.
Для вторичной профилактики у лиц с ХКС должны назначаться препараты, положительно влияющие на прогноз:
– липидснижающие ЛС (в первую очередь, статины);
– препараты, влияющие на активность ренин-ангиотензин-альдостероновой системы – ингибиторы ангиотензинпревращающего фермента (иАПФ), а при их непереносимости – блокаторы рецепторов к ангиотензину II (БРА) у лиц с АГ, СД и СН;
– антитромботические ЛС (дезагреганты, антикоагулянты).
В отношении последних, согласно Рекомендациям ESC (2020), имеется ряд ограничений по занятиям контактными видами спорта: пациентам, которые принимают двойную антитромботическую терапию (особенно антикоагулянты), следует избегать видов спорта, связанных с телесным контактом, из-за высокого риска развития кровотечений [13].
Еще одним состоянием, которое может оказывать влияние на прогноз у лиц, длительно и интенсивно занимающихся спортом и физкультурой, является ишемия миокарда при отсутствии гемодинамически значимых стенозов коронарных артерий. Выявление такого рода изменений при проведении стресс-тестов зачастую ставит в тупик, когда решается вопрос о пригодности к занятиям определенными видами спорта у профессионалов и у бессимптомных пациентов, желающих регулярно заниматься интенсивными ФТ. Как правило, и профессиональные спортсмены, и любители высокомотивированы на продолжение ФТ. Однако, несмотря на недостаточную изученность влияния данного состояния на прогноз, появление ишемии миокарда при стресс-тестах в отсутствии обструкции КА сопряжено с повышением риска развития неблагоприятных исходов и осложнений, сопряженных с ФТ. В соответствии с современными представлениями у таких пациентов рекомендовано проводить стресс-тесты с использованием для визуализации МРТ или ПЭТ, при которых возможно выявить нарушение резерва коронарного кровотока вследствие микрососудистой коронарной дисфункции. Так как общепринятых методов лечения микрососудистой стенокардии, обладающих достаточным уровнем доказанности, в настоящий момент не существует, согласительное мнение экспертов рекомендует придерживаться тех же рекомендаций по ФТ, что и при длительно существующих ХКС [10, 13].
В этой связи ивабрадин может выглядеть более выигрышно в качестве антиишемического препарата, чем БАБ, учитывая описанные выше механизмы улучшения коллатерального кровотока и коронарной перфузии за счет удлинения фазы диастолы и отсутствия вазоспастического эффекта, свойственного БАБ.
Все формы ХКС, в том числе стабильная болезнь коронарных артерий, могут протекать бессимптомно. Пациентов с бессимптомным течением БКА следует вести так же, как и с болевыми формами, то есть принципы ОМТ и вторичной профилактики у этой категории пациентов аналогичны изложенным выше. В этой когорте пациентов ФТ должны назначаться с учетом оценки потенциального риска развития осложнений (ишемия мио-карда, аритмии, ВС, острый коронарный синдром (ОКС) и т.д.) (рис. 2).
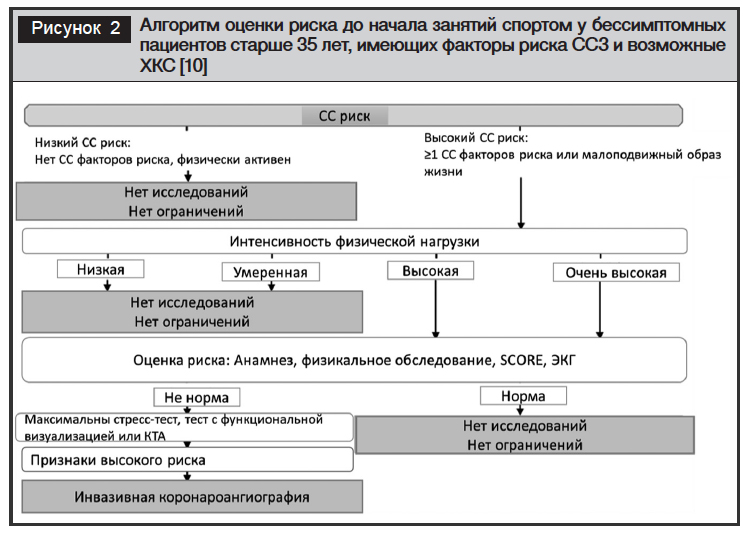
Диспансерное наблюдение с перио-дической переоценкой риска с учетом изменяющихся инструментальных данных также должно осуществляться согласно Рекомендациям по ведению ХКС (2019) [10].
Исходом всех ССЗ является формирование СН различной степени выраженности. По данным крупных мета-анализов [7, 8, 14, 16–18], регулярные ФТ способствуют существенному улучшению качества жизни, ТФН, а также снижению потребности в госпитализации, общей смертности и смертности от СН у стабильных пациентов, получающих ОМТ (I, А – для стабильных пациентов со сниженной и умеренно сниженной фракцией выброса левого желудочка).
У пациентов с СН любой этиологии ключевым является обеспечение безопасности при занятиях ФТ. Критериями исключения ФТ или противопоказаниями для их назначения у лиц с СН являются:
1. гипотензия или гипертензия в состоянии покоя или при ФТ;
2. нестабильное течение основного ССЗ;
3. ухудшение симптомов СН;
4. ишемия миокарда, несмотря на проводимую терапию;
5. тяжелые или субоптимально леченные заболевания легких [13].
Перед началом ФТ у лиц с СН следует провести тщательное клиническое и инструментальное обследование с оценкой наличия, степени выраженности и компенсации коморбидных заболеваний, объективизировать тяжесть СН с помощью лабораторных и инструментальных данных (определение натрийуретических пептидов и ЭхоКГ). Для оценки функциональных возможностей лучше всего подходит максимальный стресс-тест (предпочтительно с оценкой вентиляции – спироэргометрия). При спироэргометрии выявляются не только стресс-индуцируемые ишемия миокарда и нарушения ритма, но и VO2peak – важнейший показатель, на основании которого строятся программы ФТ аэробной направленности.
Перед началом ФТ рекомендована предварительная оптимизация медикаментозной терапии, включая имплантацию устройств, если она показана (I, C) [13]. ОМТ при СН должная проводиться в соответствии с современными рекомендациями [14].
Согласно Рекомендациям ESC (2016), цель ОМТ при СН – улучшить клиническое состояние, функциональную активность и качество жизни, предотвратить госпитализации и снизить смертность [14]. ОМТ при СН должна проводиться дифференцированно, с учетом наличия и степени выраженности нарушения систолической функции левого желудочка. У пациентов со сниженной фракцией выброса (ФВ) наивысший уровень и класс доказанности имеют:
– иАПФ (или БРА при их непереносимости) и БАБ рекомендованы у симптомных пациентов для уменьшения риска госпитализаций и смерти (I, A);
– антагонисты минералокортикоидных рецепторов (АМР) рекомендованы у пациентов со сниженной ФВ ≤35%, у которых сохраняются симптомы, несмотря на прием иАПФ и БАБ для уменьшения риска госпитализации и смерти (I, A);
– диуретики рекомендованы для улучшения симптомов и ТФН у пациентов, имеющих симптомы/признаки задержки жидкости (I, В), для уменьшения риска госпитализации у пациентов, имеющих симптомы/признаки задержки жидкости (IIa, B);
– антагонисты рецепторов к ангио-тензину и неприлизину сакубитрил/валсартан рекомендованы вместо иАПФ для дальнейшего снижения риска госпитализации и смерти у амбулаторных пациентов со сниженной ФВ, у которых сохраняются симптомы, несмотря на ОМТ, включающую иАПФ, ББ и АМР (I, В);
– ингибитор If-каналов (ивабрадин) рекомендован для снижения риска госпитализации и сердечно-сосудистой смерти у симптомных пациентов с ФВ ≤35%, имеющих синусовый ритм и ЧСС в состоянии покоя ≥70 уд./мин., несмотря на прием доказано эффективных или максимально переносимых доз БАБ, иАПФ (или БРА) и АМР (IIa, B). Уменьшение потребности миокарда в кислороде в совокупности с увеличением миокардиальной перфузии под влиянием ивабрадина способствуют более экономичному функционированию миокарда, что обусловливает эффективность данного класса ЛС для лечения СН. Ивабрадин рекомендован для снижения риска госпитализации и сердечно-сосудистой смерти у симптомных пациентов с ФВ ≤35%, имеющих синусовый ритм и ЧСС в состоянии покоя ≥70 уд./мин., которые не переносят БАБ или имеют противопоказания для назначения БАБ. Пациенты должны принимать иАПФ (или БРА) и АМР (IIa, C).
Данная рекомендация явилась результатом целого ряда хорошо спланированных клинических исследований. Так, по данным K. Swedberg и соавт. (2010), ивабрадин способствует снижению риска смерти и госпитализации у пациентов с ХСН на 26% [19].
По данным J.S. Borerи соавт. (2014), эффект ивабрадина был более выражен у наиболее тяжелых пациентов. На 32% дополнительно снижались риски смерти и на 30% – госпитализации в связи с СН у пациентов с ФВ ЛЖ <20% по сравнению с пациентами с ФВ ЛЖ <35% при сохранении профиля безопасности [5].
В Республике Беларусь появился воспроизведенный препарат ивабрадина «Раеном» (ОАО «Гедеон Рихтер», Венгрия). В отношении генерических препаратов всегда возникает вопрос относительно их клинической эффективности. С.В. Поветкиным и соавт. в 2018 году опубликованы результаты открытого рандомизированного пилотного исследования с перекрестным дизайном, целью которого явилось изучение терапевтической эффективности и безопасности генерического препарата ивабрадина (Раеном) в сравнении с оригинальным препаратом у пациентов со стабильной стенокардией напряжения. Включено 20 пациентов со стабильной стенокардией ФК II–III. Критерий включения: ЧСС >70 уд./мин. на фоне терапии БАБ. Коморбидная кардиальная патология была представлена АГ 1–3 степени, СН ФК I–III. Пациенты рандомизированы в группу 1 приема оригинального препарата ивабрадина и группу 2 приема генерического ЛС (Раеном, ОАО «Гедеон Рихтер», Венгрия) в дозе 5 мг 2 раза в сутки с титрацией при необходимости в обеих группах дополнительно к проводимой антиангинальной терапии. Через 4 недели терапии в группах проводили замену препарата на сравниваемый в эквивалентных дозах, и наблюдали пациентов еще в течение четырех недель. Выявлено сопоставимое статистически значимое снижение ЧСС от 82,5±6,63 до 66,3±6,18 уд./мин. в группе 1 и от 83,0±6,18 до 67,6±5,97 уд./мин. в группе 2 (p<0,01 для обеих групп). Также отмечено сопоставимое между группами 1 и 2 уменьшение числа еженедельных приступов стенокардии (76,1%; р<0,01) и числа принимаемых сублингвально таблеток нитроглицерина (78,0%; р<0,01) в группе 1 против 75,2% (р<0,01) и 76,7% (р<0,01) в группе 2 соответственно. Средняя суточная доза ивабрадина у пациентов группы 1 составляла 10 мг, у лиц группы 2 – 11 мг (р>0,05). Сравнение степени изменения изучаемых параметров в процессе лечения не выявило статистически значимых отличий между группами. Выполненная после четырех недель терапии замена препаратов в каждой группе обеспечивала сохранение достигнутого эффекта лечения. В течение 8 недель наблюдения не было зарегистрировано нежелательных лекарственных реакций на фоне применения изучаемых препаратов. Авторы пришли к выводу о наличии у изучаемого генерического препарата ивабрадина (Раеном) терапевтического эффекта, сопоставимого с оригинальным ЛС [2].
– БРА рекомендованы для снижения риска госпитализации и сердечно-сосудистой смерти у симптомных пациентов, которые не переносят иАПФ. Пациенты должны принимать БАБ и АМР (I, B); рекомендованы для снижения риска госпитализации и смерти у симптомных пациентов, которые получают БАБ, но не переносят АМР (IIb, C).
– гидралазин + изосорбит динитрат – комбинация рекомендована у чернокожих пациентов с ФВ ≤35% или с ФВ ≤45% и дилатацией ЛЖ, имеющих ФК II–IV по NYHA, несмотря на прием иАПФ, БАБ и АМР – для снижения риска госпитализации и смерти (IIa, В); рекомендованы у симптомных пациентов с промежуточной ФВ, которые не переносят иАПФ и БРА или они противопоказаны – для снижения риска смерти (IIb, B);
– дигоксин рекомендован у симптомных пациентов с синусовым ритмом, несмотря на прием иАПФ или БРА, БАБ и АМР – для снижения риска госпитализации в связи с СН и по всем причинам (IIb, В);
– препараты омега-3-полине-насыщенных жирных кислот могут назначаться у симптомных пациентов для снижения риска сердечно-сосудистой госпитализации и смерти (IIb, B) [14].
Доказательная база в отношении ОМТ СН с сохранной ФВ ЛЖ значительно меньше. Доказательств, что БАБ и АМР способствуют улучшению симптомов недостаточно. Улучшение симптомов возможно на фоне терапии БРА – только для кандесартана доказано уменьшение ФК по NYHA. Уменьшение числа госпитализаций у пациентов с синусовым ритмом доказано для небиволола, дигоксина, спиронолактона. При наличии фибрилляции предсердий (ФП) доказательств для БАБ и дигоксина недостаточно, ведутся исследования для иАПФ и БРА. иАПФ, БРА, БАБ, АМР не влияют на смертность у этой категории пациентов. У пожилых пациентов небиволол способствовал уменьшению суммарной конечной точки «смерть + госпитализация». При наличии задержки жидкости рекомендованы диуретики (I, В) [14].
M. Nadeemи соавт. [11] проведен обзор рандомизированных клинических исследований (РКИ) о влиянии ивабрадина на ТФН, показатели ЭхоКГ, уровень натрийуретических пептидов и показатели гемодинамики у лиц с СН с сохранной ФВ ЛЖ. Только 2 исследования в настоящий момент проведено, в которых выявлено положительное влияние терапии ивабрадином в дозе 5 мг на показатели спироэргометрии – ТФН и VO2peak. В заключении констатируется необходимость проведения более длительных РКИ для оценки влияния терапии ивабрадином на «твердые» конечные точки – заболеваемость и смертность у данной категории пациентов.
Таблица 3. Основные принципы занятий физкультурой и спортом у пациентов с сердечной недостаточностью (по European Society of Cardiology Guidelines on Sport cardiology and exercise in patients with cardiovascular disease, 2020) [13]
|
Рекомендации для пациентов с СН со сниженной и умеренно сниженной ФВ ЛЖ
|
|
У всех пациентов с СН рекомендуется регулярное обсуждение участия в ФТ и предоставление индивидуальной программы ФТ
|
|
Кардиологическая реабилитация, основанная на ФТ, рекомендуется всем стабильным лицам с СН для улучшения переносимости ФН, повышения качества жизни, а также для снижения частоты повторной госпитализации
|
|
Перед тем, как заняться спортом, рекомендована предварительная оптимизация контроля факторов риска СН
и терапии, включая имплантацию устройств (если показано)
|
|
Регулярные упражнения, включая кардиологическую реабилитацию, сочетающие аэробные ФТ средней
интенсивности и ФТ с отягощением, рекомендованы пациентам после имплантации вспомогательных устройств
|
|
Не рекомендуется заниматься спортом, который потенциально может повлиять на любой
из компонентов вспомогательных устройств (например, контактные виды спорта)
|
|
Пациентам с СН со сниженной ФВ ЛЖ не рекомендуются высокоинтенсивные силовые и виды спорта
на выносливость, независимо от симптомов
|
|
Рекомендации для пациентов с СН с сохранной ФВ ЛЖ
|
|
Рекомендованы умеренно интенсивные ФТ на выносливость и ФТ с динамическим сопротивлением, а также изменение образа жизни и оптимальное лечение факторов риска сердечно-сосудистых заболеваний (например, АГ и СД 2-го типа)
|
В таблице 3 представлены основные рекомендации по занятиям ФТ и спортом у пациентов с СН различной степени выраженности. Таким образом, физический аспект является неотъемлемой частью комплексного лечения и кардиологической реабилитации пациентов с хроническими коронарными синдромами и сердечной недостаточностью, что имеет достаточно весомую доказательную базу, позволившую сформулировать основные принципы в Рекомендациях Европейского общества кардиологов по кардиологии и физическим тренировкам у пациентов с сердечно-сосудистыми заболеваниями (2020).
Л И Т Е Р А Т У Р А
1. Всемирный антидопинговый кодекс. Международный стандарт. Запрещенный список (2021). – Точка доступа: ttps.//rusada.ru/upload/iblock. – Дата доступа: 30.03.2021.
2. Поветкин С.В., Лунева Ю.В. // Рациональная фармакотерапия в кардиологии. – 2018. – №14(1). – С.34–39.
3. Angelini P., Cheong B.Y., Lenge De Rosen V.V., et al. // J. Am. Coll. Cardiol. – 2018. – Vol.71. – P.579–580.
4. Baumgartner H., Falk V., Bax J.J., et al. // European Heart Journal. – 2017. – Vol.38, Is.36. – P.2739–2791.
5. Borer J.S., et al. // Am. J. Cardiol. – 2014. – Vol.113, N3. – P.497–503.
6. Colin P., Ghaleh B., Monnet X., et al. // J. Pharmacol. Exp. Ther. – 2004. – Vol.308. – P.236–240.
7. Corra U., Agostoni P.G., Anker S.D., et al. // Eur. J. Heart Fail. – 2018. – Vol.20. – P.3–15.
8. Giuliano C., Karahalios A., Neil C., Allen J., Levin-ger I. // Int. J. Cardiol. – 2017. – Vol.227. – P.413–423.
9. Gloekler S., et al. // Heart. – 2014. – Vol.100, N2. – P.160–166.
10. Knuuti J., Wijns W., Saraste А., et al. // European Heart Journal. – 2019. Vol.1. – P.1–71.
11. Nadeem M., Hassib M., Aslam H.M., Illahi Y. Role of Ivabradine in Patients with Heart Failure with Preserved Ejection Fraction Cureus. – 2020. – Vol.12, N2. – e7123.
12. O’Connor C.M., Whellan D.J., Lee K.L., et al. // JAMA. – 2009. – Vol.301. – P.1439–1450.
13. Pelliccia А., Sharma S., Gati S., Back M., et al. // European Heart Journal. – 2020. – Vol.00. – P.1–80.
14. Ponikowski Р., Voors А.А., Anker S.D., et al. // European Heart Journal. – 2016. – Vol.37, Is.27. – P.2129–2200.
15. Rees K., Taylor R.S., Singh S., Coats A.J.S., Ebrahim S. // Cochrane Database Syst. Rev. – 2004. – CD003331.
16. Sadek Z., Salami A., Joumaa W.H., Awada C., Ahmaidi S., Ramadan W. // Eur. J. Prev. Cardiol. – 2018. – Vol.25. – P.1691–1701.
17. Sagar V.A., Davies E.J., Briscoe S., et al. // Open Heart. – 2015. – Vol.2. – e000163.
18. Scherr J., Wolfarth B., Christle J.W., Pressler A., Wagenpfeil S., Halle M. / Eur. J. Appl. Physiol. – 2013. – Vol.113. – P.147–155.
19. Swedberg K., et al. // Lancet. – 2010. – Vol.376, N9744. – P.875–885.
20. Taylor R.S., Walker S., Smart N.A., et al. // J. Am. Coll. Cardiol. – 2019. – Vol.73. – P.1430–1443.
21. Werdan K., et al. // Cardiology. – 2016. – Vol.135. – P.141–150.
22. Zarifis J., et al. // Angiology. – 2016. – Mar 8. – pii: 0003319716630499.
Медицинские новости. – 2021. – №5. – С. 29-34.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.