Внимание! Статья адресована врачам-специалистам
SultanlyM.E.
Scientific Research Institute of Physiology named after academician A. Karaev of the National Academy of Sciences, Baku, Azerbaijan
Glial cells of the prefrontal cerebral cortex of white laboratory rats:
histologicalandimmunohistochemicalanalysis
Резюме. Префронтальная кора головного мозга белых лабораторных крыс характеризуется высоким содержанием различных морфологических типов макроглии и глиальных макрофагов. В различных зонах префронтальной коры указанные клетки формируют перинейрональные глиальные поясы (сателлиты), перивазальные муфты или же своеобразную сеть в толще нейропиля. Необходимо дальнейшее комплексное изучение глиальной архитектоники префронтальной области коры головного мозга белых лабораторных крыс.
Ключевые слова: глиальные клетки, головной мозг, префронтальная кора, крыса, гистология, иммуногистохимия.
Медицинские новости. – 2021. – №10. – С. 70–72.
Summary. The prefrontal cortex of white laboratory rats is characterized by a high content of various morphological types of macroglia and glial macrophages. In different zones of the prefrontal cortex, these cells form perineuronal glial belts (satellites), perivasal muffs, or a kind of network in the thickness of the neuropil. Further comprehensive study of the glial architectonics of the prefrontal region of the cerebral cortex of white laboratory rats is required.
Keywords: glial cells, brain, prefrontal cortex, rat, histology, immunohistochemistry.
Meditsinskie novosti. – 2021. – N10. – P. 70–72.
Выполняя защитную, опорную, формообразующую и трофическую функции, глиальные клетки являются важнейшими составными частями нервной ткани и системы. Отдельные субпопуляции глиоцитов участвуют также в специфическом функционировании нервной системы, в частности, ряда корковых, подкорковых и стволовых структур головного мозга [1, 2]. Сегодня остается недостаточно изученной глиоархитектоника префронтальной (орбитальной) коры (ПФК) головного мозга белых лабораторных крыс – объектов при моделировании обширного диапазона патологических состояний в экспериментах. Так, до сих пор слабо изучены особенности онтогенеза, клеточно-типового состава, полового диморфизма, гистотопографии и архитектоники глиоцитов ПФК отмеченных животных не только при различных экспериментальных воздействиях, но и в условиях нормы [2–4]. Судя по анализу литературы, глиоархитектоника ПФК половозрелых белых лабораторных крыс изучена недостаточно с позиций методов иммуногистохимического анализа. Между тем детализация структурных, топографических и количественных особенностей глиальных клеток ПФК головного мозга белых лабораторных крыс может иметь важное значение при интерпретации результатов экспериментальных воздействий.
Цель исследования – гистологическое и иммуногистохимическое изучение глиального состава префронтальной коры «интактных» половозрелых белых лабораторных крыс.
Материалы и методы
Исследование было выполнено на 18 половозрелых белых лабораторных крысах-самцах (200,0–250,0 г, 6,0–6,5 месяца). Животные содержались в одинаковых условиях без ограничений в приеме пищи и воды, в хорошо вентилируемом помещении с достаточным естественным дневным освещением. Их умерщвляли путем массивной воздушной эмболизации, сразу после чего обезглавливали и извлекали префронтальные области обоих полушарий головного мозга. При уходе за животными и их умерщвлении были соблюдены принципы декларации Европейского сообщества (86/609/ЕЕС) о животных, используемых для экспериментальных и других научных целей [5]. Руководствуясь атласами и стереотаксическими картами головного мозга белой лабораторной крысы [6], в каждом случае обозначены 3 зоны ПФК с обеих сторон: 1) медиальная; 2) вентральная и 3) латеральная. Вырезанные образцы отмеченных зон были зафиксированы в 4,0% нейтральном формалине и растворе Карнуа, проведены через ряд спиртов восходящей концентрации, ксилена и заключены в парафин в аппарате для гистологической обработки тканей «Leica TP 1020». Для гистологического анализа часть серийно-последовательных срезов толщиной 2,5–3,0 мкм из соответствующих парафиновых блоков, изготовленных на микротоме «Microm HM 325 (ThermoScientific)», окрашена гематоксилином и эозином, пикрофуксином по van Gieson, 0,05% тионином, 0,1% толуидиновым синим, 0,1% метиленовым синим и серебрением по Golgi [7]. На другой же части серийных срезов для верификации макроглии (астроцитов и олигодендроглиоцитов) были поставлены иммуногистохимические реакции с моноклональными антителами к глиальному кислому фибриллярному белку (glial fibrillary acidic protein; GFAP), а для выявления микроглии (глиальных макрофагов) – к CD68 и CD163. Реакции выполнены в стандартном автоматическом режиме иммуногистохимической обработки на аппарате «VENTANABenchMarkUltra» с набором антител и средств визуализации «RocheDiagnostics». Микроскопирование гистологических и иммуногистохимических препаратов было проведено в идентичных условиях анализа и фотографирования на микроскопе «AxioScope A14» с фото-видеокамерой «Axiocam ERc 5s» («Carl Zeiss»). При интерпретации результатов гистологических окрашиваний и иммуногистохимических анализов руководствовались соответствующими стандартами [7, 8]. Для обработки цифровых данных использована программа «Morphology», адаптированная к камере «Axiocam ERc 5s».
Результаты и обсуждение
Установлено, что в ПФК белых лабораторных крыс, в отличие от человека и ряда млекопитающих [1–3], послойное расположение составных частей кортекса выражено нечетко, а кое-где вовсе отсутствует, из-за чего детальная характеристика глиальной архитектоники представляется непростой задачей.
Считаем, что у белых лабораторных крыс префронтальная область гистологически может быть отнесена к «агранулярному» типу кортекса. Об этом пишут некоторые другие авторы, которые сравнительно изучили лобно-орбитальные и сенсомоторные области коры головного мозга у приматов и грызунов [3, 4, 9, 10].
Рассмотренные зоны ПФК белых лабораторных крыс характеризуются достаточно высокой плотностью глиоцитов. При гистологических окрашиваниях от нейронов и структур кровеносных сосудов глиоциты отличаются меньшим сродством к базофильным красителям, отсутствием специфического цитоплазматического базофильного субстрата (субстанции Ниссля), однообразностью аргирофилии отростков, отсутствием аксонных холмиков, относительной гипохромией ядер с плохо обозначенными мелкими ядрышками. Иммуногистохимически макроглиальные клетки четко маркируются мембранно-цитоплазматическими отложениями GFAP, при этом их ядра остаются негативными (неокрашенными).
Выяснено, что удельный вес (количество) глиоцитов в изученных зонах ПФК меняется в пределах 56,0–60,0% от общей популяции клеток кортекса. Обилие глиальных клеток в ПФК придает коре вид «редкие нейроны / густая глия» под световым микроскопом. Следует подчеркнуть, что, несмотря на высокую плотность расположения глиоцитов в ПФК белых лабораторных, нами не отмечены поля, состоящие из сплошных непрерывных скоплений рассматриваемых клеток. Так, многочисленные одиночно-разбросанные глиальные клетки или их комплексы из 2–4 астроцитов и олигодендроглиоцитов сосредоточены перинейрально, перивазально или в толще нейропиля. Эти клетки в отдельных микрополях расположены в виде сателлитов по периметру малых и средних пирамидных нейронов, особенно в толще вентральных и латеральных зон ПФК.
Свето-микроскопически нами идентифицированы 3 популяции указанных клеток: астроциты, олигодендроглиоциты и глиальные макрофаги (рисунок).
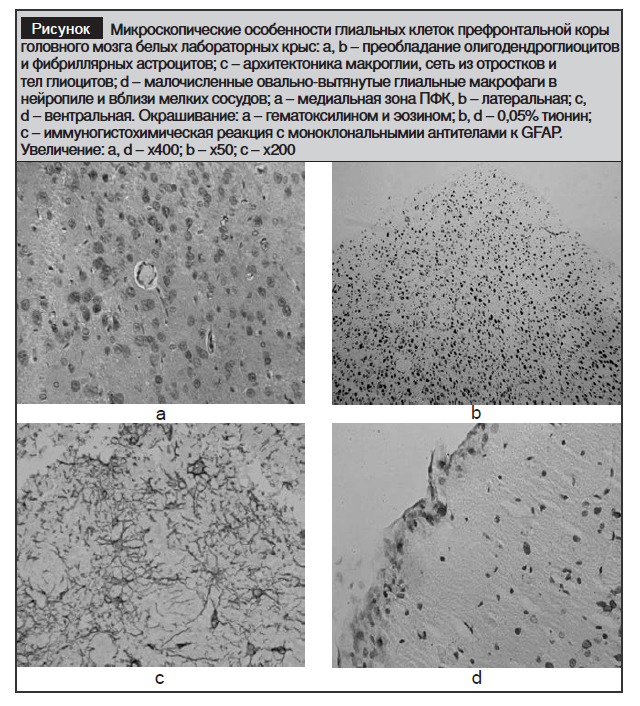
Количественно в одних зонах ПФК преобладают астроциты, а в других – олигодендроглиоциты. Выявлены определенные закономерности в количественном распределении глиоцитов по зонам ПФК, однако сказанное требует более аргументированного комплексного количественно-статистического исследования. В целом число фибриллярных астроцитов колеблется в пределах 15,0–21,0%, крупных протоплазматических астроцитов – 8,0–15,0%, а олигодендроглиоцитов – 14,0–23,0% от общей численности всех клеток кортекса. При этом удельный вес глиальных макрофагов в рассмотренных зонах ПФК не превышает 12,4% (таблица).
Таблица. Удельный вес глиальных клеток в различных зонах префронтальной коры белых лабораторных крыс (в % от общей численности всех клеток)
|
Морфологические типы глиоцитов
|
Зоны префронтальной коры
|
|
медиальная
|
вентральная
|
латеральная
|
|
I
|
II
|
III
|
I
|
II
|
III
|
I
|
II
|
III
|
|
Олигодендроглия
|
22,5
|
19,4
|
19,0
|
23,0
|
22,0
|
18,8
|
16,1
|
14,4
|
14,0
|
|
Фибриллярная астроцитарная глия
|
16,4
|
17,5
|
19,0
|
15,0
|
15,2
|
17,0
|
17,7
|
19,0
|
20,5
|
|
Протоплазматическая астроцитарная глия
|
8,0
|
8,5
|
9,8
|
8,6
|
9,7
|
10,1
|
12,6
|
14,5
|
15,0
|
|
Глиальные макрофаги (микроглия)
|
12,0
|
11,5
|
10,0
|
12,4
|
12,0
|
10,4
|
11,7
|
11,2
|
10,1
|
|
Суммарное число глиоцитов в общей клеточной популяции префронтальной коры
|
58,9
|
56,9
|
57,8
|
59,0
|
58,9
|
56,3
|
58,1
|
59,1
|
59,6
|
Примечание: I – условно поверхностный пласт (молекулярный и наружный зернистый слои ПФК); II – условно средний пласт (наружный пирамидный и внутренний зернистый слои ПФК); III – условно глубокий пласт (внутренний пирамидный и полиморфный слои ПФК).
Протоплазматические астроциты преимущественно сосредоточены в непосредственной близости тел различных нейронов, тогда как фибриллярные астроциты и олигодендроглиоциты наблюдаются как вблизи нейронов («сателлиты»), так и диффузно хаотично в межнейрональном фибриллярном матриксе (нейропиле).
В ПФК белых лабораторных крыс обнаружены сложные морфологические связи макроглиальных клеток с кровеносными микрососудами. Так, во всех 3 изученных зонах ПФК наблюдается широкопетлистая сеть вокруг гемокапилляров, состоящая из GFAP-позитивных отростков различных типов макроглии – протоплазматических, фибриллярных астроцитов и олигодендроглиоцитов.
Что касается глиальных макрофагов, то они преимущественно находятся вблизи мелких кровеносных сосудов и контактируют с ними. Иммуногистохимически (CD68 и CD163) нами идентифицированы 2 субпопуляции глиальных макрофагов, а именно диффузно распределенные и перивазальные клетки. Обнаружено, что перивазально расположенные глиальные макрофаги не только контактируют с микрососудами, но и в большинстве случаев собственными телами формируют как бы дополнительный адвентициальный пласт по ходу этих сосудов. Кроме того, в поверхностных (под менингеальными оболочками) и глубоких пластах (вдоль белого вещества полушарий) всех 3 зон часто наблюдаются широкопетлистые ложные сети, сформированные контактами длинных тонких отростков селективно-окрашенных глиальных макрофагов.
Выводы:
1. Глиоциты составляют большую часть общеклеточной популяции в медиальной, вентральной и латеральной зонах префронтальной коры головного мозга белых лабораторных крыс.
2. Глиальные клетки и их мелкие комплексы формируют перинейрональные глиальные поясы из клеток-сателлитов, перивазальные муфты или же своеобразную сеть в толще нейропиля в различных зонах префронтальной коры головного мозга белых лабораторных крыс.
3. Необходимо дальнейшее комплексное гистотопографическое и количественно-статистическое изучение глиальной архитектоники префронтальной области коры головного мозга белых лабораторных крыс.
Л И Т Е Р А Т У Р А
1. Васильев Ю.Г. Морфология нейро-глио-сосудистых отношений млекопитающих (сравнительное и онтогенетическое исследование): Автореф. дис. ... д-ра мед. наук. – Саранск, 2001. – 40 с.
2. Формирование поведения животных в норме и патологии. К 100-летию со дня рождения Л.В. Крушинского (2013) / И.И. Полетаева, З.А. Зорина. – М., 2013. – 489 с.
3. Dalley J.W., Cardinal R.N., Robbins T.W. // Neurosci. Biobehav. Rev. – 2004. – Vol.28, N7. – P.771–784.
4. Kesner R.P., Churchwell J.C. // Neurobiol. Learn Mem. – 2011. – Vol.96, N3. – P.417–431.
5. Guidelines for accommodation and care of animals (article 5 of the convention) approved by the multilateral consultation. Strasbourg, 15 june 2006, cons. 123 (2006).
6. Watson C., Paxinos G. The Rat Brain in stereotaksis coordinates. – London, San Diego, 2007. – 456 р.
7. Dey P. Basic and Advanced Laboratory Techniques in Histopathology and Cytology. – Springer, Singapore, 2018. – 275 p.
8. Lin F., Prichard J. Handbook of Practical Immunohistochemistry. – New York, 2015. – 764 p.
9. Uylings H.B., van Eden C.G. // Prog. Brain Res. – 1990. – Vol.85. – P.31–62.
10. Kanari L., Ramaswamy S., Shi Y., et al. // Cereb. Cortex. – 2019. – Vol.29, N4. – P.1719–1735.
Медицинские новости. – 2021. – №10. – С. 70-72.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.