Внимание! Статья адресована врачам-специалистам
Kozlovsky V.I.
Vitebsk State Medical University, Belarus
Vinpocetine (Cavinton forte) in the complex therapy
of post-COVID syndrome in patients with grade II arterial hypertension
Резюме. Обследованы 36 пациентов с артериальной гипертензией II степени (АГ), риск 2–3, перенесших двухстороннюю полисегментарную средней тяжести и тяжелую пневмонию, с наличием постковидного синдрома. Определено, что у лиц с сохраняющимися слабостью, одышкой и/или ощущением тумана в голове, согласно данным теста ММSE, отмечается достоверное умеренное снижение когнитивных функций, темпа выполнения теппинг-теста, а также ускорение скорости оседания эритроцитов (СОЭ) и повышение С-реактивного протеина (ЦРП). Случайным образом пациенты разделялись на две равные группы. В 1-й проводилась традиционная антигипертензивная терапия, что сопровождалось достоверным улучшением указанных показателей. Во 2-й к антигипертензивной терапии добавляли винпоцетин (Кавинтон форте) в дозе 30 мг в сутки. Отмечалось более выраженное улучшение когнитивных функций, скорости выполнения теппинг-теста, а также более выраженное снижение СОЭ и ЦРП. Сделан вывод о том, что у пациентов с АГ, перенесших двустороннюю пневмонию с наличием проявлений постковидного синдрома, добавление к традиционной антигипертензивной терапии винпоцетина (Кавинтона форте) обеспечивает достоверно более выраженное снижение клинических проявлений, улучшение когнитивных функций, повышение скорости выполнения теппинг-теста, а также снижение ЦРП и СОЭ.
Ключевые слова: артериальная гипертензия, пневмония после COVID-19, постковидный синдром, лечение винпоцетином.
Медицинские новости. – 2021. – №11. – С. 37–41.
Summary. 36 patients with grade II arterial hypertension, risk 2–3, who suffered from bilateral polysegmental moderate severity and severe pneumonia in the presence of postcovid syndrome were examined. It was determined that in patients with persistent weakness, shortness of breath and / or a feeling of fog in the head, according to the MMSE test data, there is a significant moderate decrease in cognitive functions, a decrease in the rate of tapping test, as well as an acceleration of ESR and an increase in CPR. Patients were randomly divided into two equal groups. In the 1st, traditional antihypertensive therapy was performed, which is accompanied by a significant improvement in these indicators. In the 2nd, vinpocetine (Cavinton forte) was added to antihypertensive therapy at a dose of 30 mg per day. There was a more pronounced improvement in cognitive functions, the speed of the tapping test, as well as a more pronounced decrease in ESR and CPR. It is concluded that in patients with arterial hypertension who have undergone bilateral pneumonia with the presence of manifestations of postcovid syndrome, the addition of vinpocetine (Cavinton forte) to traditional antihypertensive therapy provides a significantly more pronounced decrease in clinical manifestations, improvement of cognitive functions, an increase in the rate of tapping test, as well as a decrease in CPR and ESR.
Keywords: arterial hypertension, pneumonia after COVID-19, postcovoid syndrome, vinpocetine treatment.
Meditsinskie novosti. – 2021. – N11. – P. 37–41.
Коронавирусная инфекция поставила целый ряд сложнейших вопросов по оказанию медицинской помощи пациентам не только в остром периоде, но и в связи с длительным сохранением клинической симптоматики, формированием лонг COVID-19 или постковидного синдрома [2, 5, 8–14].
Показано, что у пожилых пациентов с сопутствующим ожирением, патологией сердечно-сосудистой системы, сахарным диабетом, бронхиальной астмой, хронической обструктивной болезнью существенно чаще сохраняются клинические проявления [17].
Британским NationalInstituteforHealthandCareExcellence (NICE) предложено определение продолжительности течения коронавирусной инфекции [8].
1. Острый COVID-19 – при наличии признаков заболевания в течение первых 4 недель с момента заражения.
2. Новые или продолжающиеся симптомы через 4 недели и более после начала острого COVID-19 подразделяются на:
– продолжающийся симптомный COVID-19 (или longCOVID-19) в течение 4–12 недель после начала заболевания;
– постковидный синдром – это синдром, который развивается во время или после инфекции, характерной для COVID-19, продолжается более 12 недель от начала заболевания и не объясняется альтернативным диагнозом [5].
Частота постковидного синдрома достаточно высока и составляет, по мнению различных авторов, до 37% перенесших COVID-19 инфекцию.
Клинические проявления разнообразны, однако наиболее частыми является слабость, одышка, кашель, ощущение «тумана в голове» [3, 9, 19].
Патогенез постковидного синдрома детально не исследован. Полагают, что в его основе лежат запущенные COVID-19 системное воспаление (в результате иммунных, аутоиммунных реакций в ответ на повреждение), дисфункция и повреждение эндотелия, гиперкоагуляция, нарушения агрегации клеточных элементов крови, повышение адгезии лейкоцитов, расстройства реологических свойств крови с формированием гипоперфузии головного мозга и других органов.
В связи с множеством проявлений, обусловленных поражением сосудистой, нервной систем, желудочно-кишечного тракта, авторы предлагают различные подходы к лечебной тактике. Они связаны с купированием сосудистой дистонии, коррекцией гиперкоагуляции, агрегацией клеточных элементов, коррекцией тревожных и депрессивных реакций, продолжением приема антиагрегантов и антикоагулянтов [3, 18–20]. Возникновение гипоперфузии головного мозга может быть одним из наиболее вероятных механизмов формирования синдрома «тумана в голове».
В настоящее время показано, что винпоцетин (Кавинтон форте) обладает целым рядом эффектов, которые могли бы быть полезны при лечении и профилактике постковидного синдрома, протекающего с синдромом гипоперфузии головного мозга при наличии синдромов системного воспаления.
Винпоцетин ингибирует IKK/NF -?B [21], ядерный фактор ?-легкой цепи-энхансер активированных В-клеток ?B (NF -?B) – главный фактор транскрипции, регулирующий гены, ответственные как за врожденный, так и за адаптивный иммунный ответ (рис. 1).
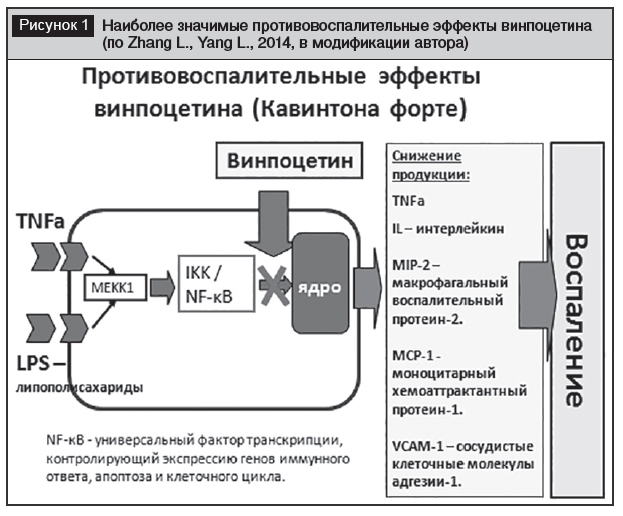
Результатом является снижение продукции тумор некротического фактора (TNF -?), интерлейкинов (IL-1, IL-6), протеина, активирующего хемотаксис моноцитов (МСР-1), продукцию молекул адгезии (VCAM-1) в ответ на активацию рецепторов липополисахаридов и TNF -?, что обеспечивает снижение воспалительных реакций [21–24].
Ингибируя продукцию хемоаттрактантного белка-1 моноцитов в эндотелиальных клетках, винпоцетин влияет на трансформацию моноцитов в макрофаги, тем самым снижает выработку провоспалительных факторов в макрофагах. Винпоцетин также снижает экспрессию факторов роста в эндотелиальных клетках, подавляет миграцию и пролиферацию гладкомышечных клеток сосудов. Это ингибирование пролиферации и миграции VSMC происходит за счет ингибирования фосфорилирования индуцированных тромбоцитарным фактором роста, а также путем ингибирования продукции провоспалительного фактора, индуцированного IKK [23].
Винпоцетин защищает нейроны, подавляя чувствительные к напряжению натриевые каналы и ингибируя накопление Ca2+ в клетках, что предотвращает набухание и повреждение клеток. При повреждении нейронов высвобождаются молекулярные паттерны, активирующие микроглию и макрофаги посредством активации Toll-подобного рецептора 4 в пути NF -?B. Винпоцетин препятствует этому процессу, подавляя высвобождение провоспалительных цитокинов (IL-1?, TNF -?).
Хотя винпоцетин прямо не влияет на активацию микроглии, он подавляет пролиферацию микроглии посредством блокады NF -?B и факторов транскрипции активаторного белка-1, которые являются основными факторами транскрипции генов, ответственных как за врожденный, так и за адаптивный иммунный ответ, и являются важными в дифференцировке Т-клеток [23].
Винпоцетин не только снижает выраженность системных проявлений воспаления [15], но и предупреждает ремоделирование сосудистой стенки в связи с локальным повреждением, в частности гипертрофии гладкой мускулатуры, предупреждает накопление избытка коллагена в тканях, причем эти эффекты доказаны морфологически [6, 7].
Результаты анализа современных исследований механизмов действия винпоцетина (Кавинтона форте) позволяют полагать рациональность его применения у пациента с длительной гипоперфузией головного мозга и появлением синдрома «тумана в голове», что представляется особенно актуальным у пациентов с артериальной гипертензией и старше 50 лет.
Несмотря на то, что эффективность применения винпоцетина (Кавинтона форте) при лечении проявлений гипоперфузии головного мозга доказана в ряде исследований, его применение у пациентов с клиническими проявлениями постковидного синдрома не исследовано.
Цель исследования – определение возможности применения винпоцетина (Кавинтона форте) у пациентов с артериальной гипертензией II степени, перенесших двухстороннюю пневмонию в связи с COVID-19, при проявлениях постковидного синдрома.
Материалы и методы
Обследованы 36 пациентов с артериальной гипертензией II степени, риск 2–3. Мужчин было 17, женщин – 19. Средний возраст обследованных – 52±6,4 года. Все пациенты перенесли двухстороннюю полисегментарную средней тяжести и тяжелую пневмонию. Диагноз подтверждался результатами компьютерной томографии и ПЦР-исследованием. У всех пациентов отмечались симптомы, характерные для постковидного синдрома, что регистрировалось на основании критериев британского NationalInstituteforHealthandCareExcellence (NICE). Постковидный синдром – это синдром, который развивается во время или после инфекции, характерной для COVID-19, продолжается более 12 недель от начала заболевания и не объясняется альтернативным диагнозом [9].
Все пациенты получали антигипертензивную терапию, лечение COVID-19-ассоциированной пневмонии согласно протоколам Министерства здравоохранения Республики Беларусь [2]. Целевое артериальное давление достигали у 86,1% больных. У остальных артериальное давление было меньше 150/95 мм рт. ст. Пациенты принимали лизиноприл, лозартан, пириндоприл, индап, верошпирон, бисопролол. Антигипертензивная терапия в 1-й и 2-й группах достоверно не отличалась по числу препаратов, дозировкам и достигнутому эффекту.
Первое обследование назначалось через 5–6 недель после завершения стационарного лечения при наличии симптомов, характерных для постковидного синдрома. Все пациенты случайным образом разделялись на 2 равные группы. 1-я группа получала только антигипертензивные препараты, 2-я – аналогичное лечение и винпоцетин (Кавинтон форте), который назначался перорально по 10 мг 3 раза в сутки в течение 3 месяцев. Повторное обследование проведено через 3 месяца.
Изменения клинической симптоматики (одышка, слабость, ощущение «тумана в голове») оценивали по шкалам ВАШ (0–100%).
Оба обследования включали оценку артериального давления, общего анализа крови, скорость оседания эритроцитов (СОЭ), уровень С-реактивного протеина (ЦРП). Когнитивные функции оценивали с помощью краткой шкалы оценки психического статуса (Mini Mental State Exa-mination – MMSE, Mini-mental state) [16].
Теппинг-тест оценивался по числу точек, нанесенных карандашом на 6 квадратах стандартного листа бумаги. Оценивали число точек в квадрате, нанесенных в течение 5 секунд. Общая продолжительность теста – 30 секунд [1].
Изменения клинических проявлений оценивалась по ВАШ: слабость, «туман в голове», одышка.
Материал обработан с помощью пакета статистических программ STATISTICA-10 с использованием параметрических и непараметрических методов.
Результаты и обсуждение
Во время первичного обследования отмечено сохранение слабости, одышки, ощущения «тумана в голове» (табл. 1), исходные данные достоверно не отличались в 1-й и 2-й группах. Артериальное давление у 86,1% пациентов находилось в пределах целевых значений. Существенные изменения артериального давления в течение наблюдения не отмечены.
Таблица 1. Изменения артериального давления, результаты теста ММSE, изменения ЦРП и СОЭ у пациентов, перенесших COVID-19
|
Группы
|
|
Количество пациентов
|
Время обследования
|
АДС, мм рт. ст.
|
АДД, мм рт. ст.
|
ММSE, балл
|
ЦРП, мг/л
|
СОЭ, мм/ч
|
|
1
|
|
18
|
Исходно
|
129,3±7,4
|
76,2±5,8
|
23,4±0,92
|
8,3±0,64
|
36,0±0,69
|
|
|
Через 3 месяца
|
128,5±8,6
|
81,3±6,5
|
24,1±0,90
|
3,5±0,79
|
28,9±0,83
|
|
2
|
|
18
|
Исходно
|
131,2±7,3
|
79,4±6,3
|
23,25±0,86
|
8,1±0,69
|
35,1±0,96
|
|
|
Через 3 месяца
|
130,5±9,3
|
83,1±7,3
|
27,1±0,96*
|
2,3±0,63*
|
18,2±0,79*
|
Примечание: АДС – систолическое артериальное давление, АДД – диастолическое артериальное давление; подчеркнуты достоверные изменения исходно и через 3 месяца (р<0,05); * – достоверные изменения соответственно периоду обследования по сравнению с 1-й группой (р<0,05).
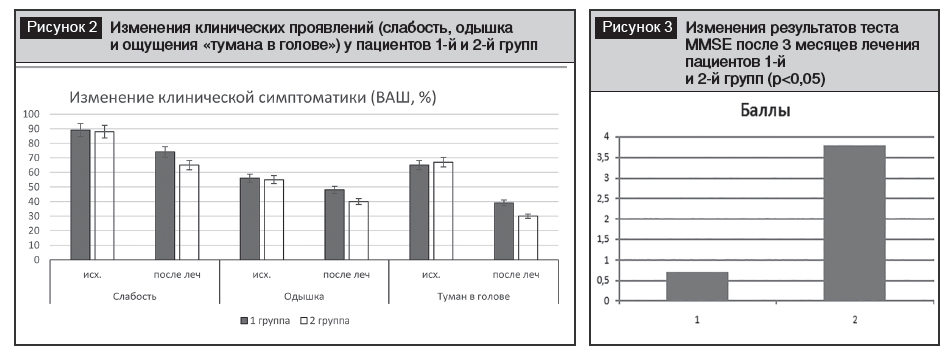
Через 3 месяца у всех пациентов выявлено достоверное уменьшение слабости, одышки, ощущения «тумана в голове». Однако более выраженные изменения были во 2-й группе у лиц, получавших винпоцетин (Кавинтон форте) (рис. 2).
После проведенного лечения как в 1-й, так и во 2-й группе отмечено достоверное улучшение клинических проявлений: снижение слабости, одышки, ощущения «тумана в голове», р<0,05 (см. рис. 2). Однако выраженность этих изменений была большей у пациентов 2-й группы, получавших винпоцетин (Кавинтон форте).
Артериальное давление достоверно не изменялось в процессе проводимого лечения (см. табл. 1).
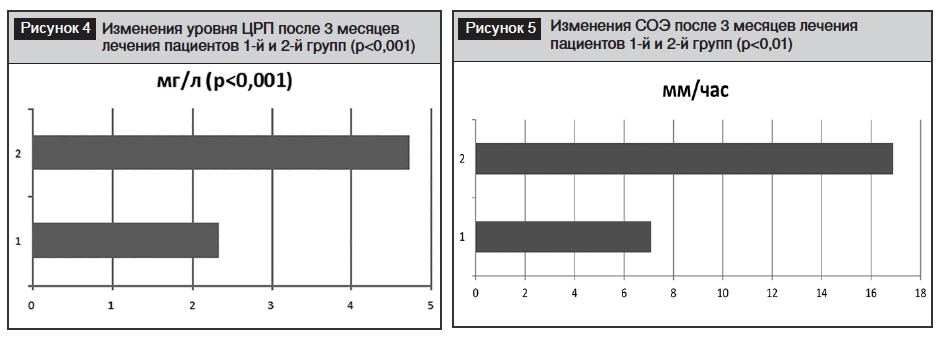
У пациентов с артериальной гипертензией отмечалось снижение показателей теста MMSE, что свидетельствовало о наличии легких и умеренных когнитивных расстройств (см. табл. 1). Через 3 месяца отмечалось достоверное уменьшение когнитивных нарушений, однако во 2-й группе эти изменения были достоверно более выраженными (рис. 3).
В крови у пациентов с артериальной гипертензией в начале контролируемого периода отмечалось повышение уровня СОЭ и ЦРП (см. табл. 1). После проведенного лечения показатели достоверно снижались, причем более значительно во 2-й группе, р<0,05 (рис. 4, 5).
При первом выполнении теппинг-теста у пациентов с артериальной гипертензией скорость нанесения точек была снижена, особенно в 4–6-секундном периодах (табл. 2). Такой тип изменений указывал на быстрое истощение функциональных возможностей выполнять моторные реакции с высоким темпом. После лечения число нанесенных точек существенно увеличилось (р<0,05). Во 2-й группе после терапии показатели теста были достоверно более выраженными, чем в 1-й (р<0,05), что указывало на повышение функциональных возможностей выполнять быстрые движения кистью. Причем увеличение числа точек у пациентов 2-й группы в 4–6 квадратах было существенно большим, чем в 1-й, что свидетельствовало о значительном снижении функционального истощения.
Таблица 2. Результаты теппинг-теста у пациентов, перенесших COVID-19
|
Группы
|
Количество пациентов
|
Время обследования
|
Число точек в разное время выполнения теста
|
|
1–5 секунд
|
5–10 секунд
|
10–15 секунд
|
15–20 секунд
|
20–25 секунд
|
25–30 секунд
|
|
1
|
18
|
Исходно
|
19,0±0,8
|
19,8±0,9
|
17,6±0,8
|
19,0±0,8
|
16,0±0,7
|
15,7±0,5
|
|
Через 3 месяца
|
20,7±0,8
|
22,0±0,8
|
19,8±0,4
|
20,0±0,8
|
18,9±0,9
|
18,3±0,8
|
|
2
|
18
|
Исходно
|
18,9±0,9
|
19,0±0,9
|
17,6±0,8
|
17,0±0,8
|
19,9±0,9
|
15,8±0,8
|
|
Через 3 месяца
|
22,9±0,8*
|
22,8±1,0
|
23,0±1,3*
|
19,6±0,8
|
20,6±1,2*
|
23,1±0,9*
|
Примечание: подчеркнуты достоверные изменения исходно и через 3 месяца (р<0,05); * – достоверные изменения соответственно периоду обследования по сравнению с 1-й группой (р<0,05).
С фактом применения винпоцетина (Кавинтона форте) выявлена достоверная корреляционная связь изменений СОЭ и ЦРП (соответственно r=0,41, р<0,05 и r=0,46, р<0,05) с изменениями MMSE (r=0,45, р<0,05) и результатом теппинг-теста (r=0,36, р<0,05).
В процессе наблюдения за состоянием пациентов с артериальной гипертензией, принимавших винпоцетин (Кавинтон форте), неблагоприятные эффектов не выявлены.
Полученные данные показывают, что у лиц с артериальной гипертензией, перенесших двустороннюю пневмонию, и наличием постковидного синдрома отмечаются когнитивные расстройства, снижение темпа выполнения движений кисти, сохранение проявлений воспалительных реакций в виде ускоренного СОЭ и повышенного ЦРП.
Применение винпоцетина (Кавинтона форте) в комплексной терапии пациентов с артериальной гипертензией II степени после перенесенной пневмонии, связанной с COVID-19-инфекцией, ассоциировано с достоверным более выраженным снижением клинической симптоматики, прежде всего с уменьшением слабости, одышки и ощущения «тумана в голове».
Кроме этого, отмечается достоверное улучшение когнитивных функций, а также темпа выполнения теппинг-теста. Динамика этих изменений указывает на достоверное и более выраженное улучшение функционального состояния центральной нервной системы после перенесенной инфекции.
В представленной работе на основании клинических результатов подтверждаются данные, полученные в эксперименте, о наличии значительного противовоспалительного эффекта винпоцетина (Кавинтона форте). Применение данного препарата совместно с антигипертензивной терапией сопровождалось достоверно более значимым улучшением этих показателей. Наличие противовоспалительного эффекта у винпоцетина (Кавинтона форте) подтверждается и наличием достоверной корреляции изменений СОЭ и ЦРП с фактом применения препарата.
Отсутствие неблагоприятных эффектов, отмечаемое в данном исследовании, подтверждает безопасность применения винпоцетина в комплексном лечении пациентов с артериальной гипертензией и гипоперфузией головного мозга [21, 25]. Выявление достоверной корреляции изменений когнитивных функций, теппинг-теста, клинических проявлений заболевания, воспалительных, а также изменений с фактом применения винпоцетина (Кавинтона форте) подчеркивает, что препарат обеспечивает дополнительное снижение системного воспаления.
Заключение
Применение комбинированной терапии антигипертензивными препаратами и винпоцетином (Кавинтоном форте) у пациентов с артериальной гипертензией II степени и постковидным синдромом сопровождается достоверным снижением слабости, одышки, «тумана в голове», улучшением когнитивных функций, повышением темпа выполнения теппинг-теста, снижением СОЭ и ЦРП.
Определено, что изменения когнитивных функций, теппинг-теста достоверно коррелируют с фактом применения винпоцетина (Кавинтона форте) и изменением СОЭ и ЦРП.
Л И Т Е Р А Т У Р А
1. Ильин Е.П. Психомоторная организация человека. – СПб, 2003. – 364 с.
2. О вопросах лечения пациентов с инфекцией COVID-19. Приказ МЗ РБ №690 от 1.07.2020. – 55 с.
3. Трисветова Е.Л. // Кардиология в Беларуси. – 2021. – Т.13, №2. – С.268–279.
4. A clinical case definition of post COVID-19 condition by a Delphi consensus. WHO, 6 October 2021. – 27 p.
5. Cai Y., Knight W.E., Guo S., et al. // J. Pharmacol. Exp. – 2012. – Vol.343, N2. – P.479–488.
6. Cai Y., Miller C.L., Nagel D.J., et al. // Arterioscler. Thromb. Vase. Biol. – 2011. – Vol.31, N3. – P.616–623.
7. Carfi A., Bernabei R., Landi F. // JAMA. – 2020. – Vol.324, N6. – P.603–605. doi: 10.1001 /jama.2020.12603
8. COVID-19 rapid guideline: managing the long-term effects ofCOVID-19. NICE Guidance. National Institute for Health and Care Excellence. 2020. Available at: www.nice.org.uk/ guidance/NG188
9. Dei Rio C., Collins L.F., Malani P. // JAMA. – 2020. – Vol.324, N17. – P.1723–1724. doi: 10.1001/jama.2020.19719
10. Driggin E., Madhavan M.V., Bikdeli B. // J. Am. Coll. Cardiol. – 2020. – Vol.75, N18. – P.2352–2371. doi: 10.1016/j.jacc.2020.03.031
11. Grabowski D.C., Joynt Maddox K.E. // JAMA. – 2020. – Vol.323, N20. – P.2007–2008.
12. GuoT., Fan Y., Chen M. // JAMA Cardiol. – 2020. – N27. – e201017. doi: 10.1001 /jamacardio.2020.1017
13. Johnson S.F., Tiako M.J.N., Flash M.J.E. // Lancet Psychiatry. – 2020. – N7. – P.54–55.
14. Medina A.E. // Proc. Natl. Acad. Sci. USA. – 2010. – Vol.107, N22. – P.9921–9922.
15. Mini Mental State Examination – MMSE, Mini-mental state”. A practical method for grading the cognitive state of patients for the clinician // J. Psychiatric Res. – 1975. – Vol.12, N3. – P.189–198. doi: 10.1016/0022-3956(75)90026-6
16. Moreno-Perez O., Merino E., Leon-Ramirez J-M. // J. Infect. – 2021. – Vol.82, N3. – P.378–383. doi: 10.1016/j.jinf.2021.01.004
17. Pavli Androula, Theodoridou Maria, Maltezou Helena C. // Arch. Med. Res. – 2021. – Vol.52, Iss.6. – P.575–581. doi: 10.1016/j.arcmed.2021.03.010
18. Puntmann V.O., Careri L., Wieters I. // JAMA Cardiol. – 2020. – Vol.5, N1. – P.1307–1308. doi: 10.l001/jamacardio.2020.4661
19. Radtke T., Ulyte A., Puhan M.A., et al. // JAMA. – 2021. – Vol.326, N9. – P.869–871. doi: 10.1001/jama.2021.11880
20. Sheehy L.M. // JMIR Public Health Surveil. – 2020. – Vol.6, N2. – e9462.
21. Zhang C., Yan C.J. // Cell Immunol. – 2020. – N2 (5). – P.211–219. doi: 10.33696/immunology.2.045
22. Zhang F., Yan C., Wei C., et al. // Transl. Stroke Res. – 2018. – Vol.9, N2. – P.174–184. doi: 10.1007/s12975-017-0549-z. Epub 2017 Jul 9
23. Zhang L., Yang L. // Molecules. – 2014. – Vol.20, N1. – P.335–347. doi: 10.3390/molecules20010335
24. Zhang Y.S., Li J.D., Yan C. // Eur. J. Pharmacol. – 2018. – Vol.819. – P.30–34. doi: 10.1016/j.ejphar.2017.11.041. Epub 2017 Nov 26
25. Zhang W., Huang Y., Li Y., et al. // Trial. Clin. Drug Investig. – 2016. – N36. – P.697–704. https://doi.org/10.1007/s40261-016-0415-x
Медицинские новости. – 2021. – №11. – С. 37-41.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.