Внимание! Статья адресована врачам-специалистам
Sujayeva V.A.
Republican Scientific and Practical Center «Cardiology», Minsk, Belarus
The problem of myocarditis in the new Recommendations
of the 2021 European Society of Cardiology for the diagnosis
and treatment of acute and chronic heart failure
Резюме. Приведен обзор новых рекомендаций Европейского общества кардиологов по диагностике и лечению острой и хронической сердечной недостаточности 2021 года и основные позиции, касающиеся эпидемиологии, клинического течения, основных подходов к лечению миокардита. Отдельно освещена проблема миокардита, связанного с инфекцией SARS-CoV-2. Приведена доказательная база в отношении эффективности некоторых классов лекарственных средств, используемых в комплексной терапии сердечной недостаточности и миокардита.
Ключевые слова: острая сердечная недостаточность, хроническая сердечная недостаточность, миокардит, инфекция SARS-CoV-2, диагностика, лечение, лозартан.
Медицинские новости. – 2021. – №12. – С. 36–41.
Summary. The article provides an overview of the new recommendations of the European Society of Cardiology for the diagnosis and treatment of acute and chronic heart failure in 2021 and the main positions related to epidemiology, clinical course, main approaches to the treatment of myocarditis. The problem of myocarditis associated with SARS-CoV-2 infection is separately highlighted. The evidence base for the effectiveness of some classes of drugs used in the complex therapy of heart failure and myocarditis is presented.
Keywords: acute heart failure, chronic heart failure, myocarditis, SARS-CoV-2 infection, diagnosis, treatment, losartan.
Meditsinskie novosti. – 2021. – N12. – P. 36–41.
В 2021 году вышла новая версия Рекомендаций Европейского общества кардиологов – European Society of Cardiology (ESC), посвященных диагностике и лечению острой и хронической сердечной недостаточности (ОСН и ХСН соответственно) [1]. Обращает на себя внимание наличие целого ряда новых рекомендаций.
1. По диагностике СН (относительно роли катетеризации правых отделов сердца).
2. По лечению ХСН:
– со сниженной фракцией выброса левого желудочка (СНснФВ) рекомендованы новые классы лекарственных средств (ЛС): противодиабетические (дапаглифлозин и эмпаглифлозин) и стимулятор растворимой гуанилатциклазы – верицигуат;
– с незначительно сниженной ФВ ЛЖ (СНнезнснФВ) рекомендованы ингибиторы ангиотензинпревращающего фермента (иАПФ), блокаторы рецепторов ангиотензина II (БРА), бета-адреноблокаторы (БАБ), антагонисты минералокортикоидных рецепторов (АМР), комбинация ингибитора неприлизина и блокатора рецептора ангиотензина II (ARNI) сакубитрил/валсартан. Все рекомендации имеют класс доказанности IIb;
– с сохранной ФВ ЛЖ (СНсохрФВ) – в основном немедикаментозные профилактические методы воздействия (скрининг коморбидных заболеваний, вакцинация, комплексная кардиологическая реабилитация).
3. По лечению тяжелой СН.
4. По ведению пациентов с СН после госпитализации.
5. По ведению пациентов с СН и фибрилляцией предсердий (антикоагулянтная терапия).
6. По ведению пациентов с СН и хроническими коронарными синдромами (ХКС).
7. По ведению пациентов с СН и болезнями клапанов.
8. По ведению пациентов с СН и сахарным диабетом (СД).
9. По ведению пациентов с дефицитом железа (скрининг и лечение анемии с помощью внутривенно вводимых лекарственных средств при необходимости).
10. По ведению пациентов с СН и раком.
11. По ведению пациентов с СН и амилоидозом [1].
Также целый ряд рекомендаций из большинства указанных выше разделов претерпели изменения, в основном класс и/или уровень доказанности с учетом полученных новых данных.
Базисным лечением СНснФВ ЛЖ по-прежнему являются средства, влияющие на активность ренин-ангиотензин-альдостероновой системы (РААС) – ARNI, иАПФ – или при их непереносимости – БРА, а также БАБ и АМР. Все рекомендации имеют наивысший класс доказанности I.
Как и в Обновлении 2021 года экспертного заключения Американской коллегии кардиологов/Американской ассоциации сердца «Путь принятия консенсусных решений для оптимизации лечения сердечной недостаточности со сниженной фракцией выброса» [2], в новых Европейских рекомендациях подчеркивается важность выбора препарата и дозировок, эффективность которых доказана [1]. Доказанные лекарственные средства и их дозы для лечения СНснФВ представлены в таблице 1.
Таблица 1. Доказательные дозы лекарств, модифицирующих болезнь,
в ключевых рандомизированных исследованиях у пациентов с СН со сниженной фракцией выброса (по 2021 ESCGuidelinesforthediagnosisandtreatmentofacuteandchronicheartfailure [1])
|
Лекарственное средство
|
Стартовая доза
|
Целевая доза
|
|
иАПФ
|
|
Каптоприл
|
6,25 мг 3 раза в сутки
|
50 мг 3 раза в сутки
|
|
Эналаприл
|
2,5 мг 2 раза в сутки
|
10–20 мг 2 раза в сутки
|
|
Лизиноприл
|
2,5–5 мг 1 раз в сутки
|
20–35 мг 1 раз в сутки
|
|
Рамиприл
|
1,25 мг 2 раза в сутки
|
10 мг 2 раза в сутки
|
|
Трандалоприл
|
0,5 мг 1 раз в сутки
|
4 мг 1 раз в сутки
|
|
ARNI
|
|
Сакубитрил/валсартан
|
49/51 мг 2 раза в сутки
|
97/103 мг 2 раза в сутки
|
|
БАБ
|
|
Бисопролол
|
1,25 мг 1 раз в сутки
|
10 мг 1 раз в сутки
|
|
Карведилол
|
3,125 мг 2 раза в сутки
|
25 мг 2 раза в сутки
|
|
Метопролол-сукцинат
|
12,5–25 мг 1 раз в сутки
|
200 мг 1 раз в сутки
|
|
Небиволол
|
1,25 мг 1 раз в сутки
|
10 мг 1 раз в сутки
|
|
Антагонисты минералокортикоидных рецепторов
|
|
Спиронолактон
|
25 мг 1 раз в сутки
|
50 мг 1 раз в сутки
|
|
Эплеренон
|
25 мг 1 раз в сутки
|
50 мг 1 раз в сутки
|
|
Ингибиторы натрийзависимого переносчика глюкозы 2-го типа
|
|
Дапаглифлозин
|
10 мг 1 раз в сутки
|
10 мг 1 раз в сутки
|
|
Эмпаглифлозин
|
10 мг 1 раз в сутки
|
10 мг 1 раз в сутки
|
|
Другие агенты
|
|
Гидралазин/Изосорбид динитрат
|
37,5 г 3 раза в сутки /20 мг 3 раза в сутки
|
75 мг 3 раза в сутки / 40 мг 3 раза в сутки
|
|
Кандесартан
|
4 мг 1 раз в сутки
|
32 мг 1 раз в сутки
|
|
Валсартан
|
40 мг 2 раза в сутки
|
160 мг 2 раза в сутки
|
|
Лозартан
|
50 мг 1 раз в сутки
|
150 мг 1 раз в сутки
|
|
Ивабрадин
|
5 мг 2 раза в сутки
|
7,5 мг 2 раза в сутки
|
|
Верицигуат
|
2,5 мг 1 раз в сутки
|
10 мг 1 раз в сутки
|
|
Дигоксин
|
62,5 мкг 1 раз в сутки
|
250 мкг 1 раз в сутки
|
В рамках Рекомендаций ESC (2021) отдельное внимание уделено разделу «Миокардиты». Следует отметить, что консенсусный документ в отношении данного этиологического фактора развития как ОСН, так и ХСН был принят ESCв 2013 году [3]. Актуальность проблемы миокардитов, их диагностики и лечения приобретает еще большую выраженность в связи с пандемией SARS-CoV-2, которая помимо поражения дыхательной системы – этиологический фактор острого вирусного миокардита (табл. 2), который может протекать фульминантно и являться причиной смерти.
Таблица 2. Этиологические факторы, которые следует рассматривать как провоцирующие острый миокардит (по 2021 ESCGuidelinesforthediagnosisandtreatmentofacuteandchronicheartfailure [1])
|
Вирусы
|
Парвовирус B19, вирус герпеса человека-6, вирус Эпштейна – Барр, энтеровирусы, (вирус Коксаки, аденовирус), ЦМВ, ВИЧ, SARS-CoV-2
|
|
Другие
|
Borrelia, Coxiella burnetii (Q-лихорадка)
|
|
Системные болезни
|
|
Аутоиммунные и другие
|
Саркоидоз, гигантоклеточный миокардит, эозинофильный миокардит, СКВ, ANCA-положительный васкулит, ревматоидный артрит, любое другое аутоиммунное заболевание
|
|
Токсические
|
|
Медикаменты
|
Ингибиторы иммунных контрольных точек, антрациклины, клозапин, адренергические препараты, 5-фторурацил
|
|
Другие агенты
|
Алкоголь, амфетамины, кокаин
|
Примечание. ЦМВ – цитомегаловирус; ВИЧ – вирус иммунодефицита человека; СКВ – системная красная волчанка.
Проблема миокардита крайне многогранна. Во-первых, оценить истинную распространенность миокардита, в том числе и вызванного SARS-CoV-2, весьма затруднительно, так как «золотой стандарт» в диагностике миокардита – эндомиокардиальная биопсия (ЭМБ) – используется редко. По данным J. Gore и соавт. (1947) [4] и C. Basso и соавт. (2001) [5], при вскрытии молодых людей, внезапно умерших от различных причин, признаки миокардита выявлялись в 2–42% случаев. Подтвержденный по данным биопсии миокардит выявлен у 9–16% взрослых и у 46% детей в качестве причины необъяснимой неишемической дилатационной кардиомиопатии (ДКМП). При изучении причин внезапной смерти у 1,5 млн новобранцев военно-воздушных сил США показано, что миокардит явился причиной гибели 5 из 19 человек, то есть более чем в 25% случаев. Вместе с тем при аутопсии ВИЧ-инфицированных пациентов этот показатель составлял уже 50%. По результатам специальных исследований с использованием различных диагностических критериев заболевания, частота фатального миокардита варьировала от 0,15 до 0,46 на 100 000 человеко-лет наблюдений [3].
Заболеваемость острым миокардитом оценивается в 1,5 млн случаев в год во всем мире. Роль миокардита, как причины СН, варьирует в зависимости от возраста и региона примерно от 0,5 до 4,0%. Хроническое, подтвержденное ЭМБ воспаление выявляется у 9–30% взрослых пациентов с ДКМП [1].
В исследовании [6] оценивалась частота развития миокардита при COVID-19 среди 1597 спортсменов из 14 университетов. Они наблюдали общую распространенность – 2,3%, с 9 случаями клинического миокардита и 28 – субклинического миокардита, классифицированных на основе наличия сердечных симптомов и результатов магнитно-резонансной томографии сердца (МРТ).
Клиническая картина острого миокардита может варьировать от легкой до кардиогенного шока. План обследования для диагностики острого миокардита у пациентов с СН представлен в таблице 3.
Таблица 3. Диагностическое обследование при подозрении на острый миокардит (по 2021 ESCGuidelinesforthediagnosisandtreatmentofacuteandchronicheartfailure [1])
|
Определение подозрения на острый миокардит:
Клиническая картина + ≥1 положительный результат обязательного диагностического теста (предпочтительно МРТ) при отсутствии значимых изменений КА, клапанных или врожденных пороков сердца или других причин
|
|
Диагностическое обследование
|
Чувствительность
|
Специфичность
|
|
Клиническая картина
|
|
Острая/впервые возникшая боль в груди, одышка, признаки лево- и/или правожелудочковой СН и/или необъяснимые аритмии или прерванная внезапная смерть
|
Низкая
|
Низкая
|
|
Обязательные диагностические тесты
|
|
ЭКГ
|
Новые и динамические изменения ST-T, включая псевдоинфарктный подъем сегмента ST, предсердные или желудочковые аритмии, AВ-блокады, изменения QRS
|
Высокая
|
Низкая
|
|
Лабораторные тесты
|
Повышенный уровень тропонинов с динамическими изменениями, соответствующими миокардиальному некрозу. Стандартные тесты, включая количество лейкоцитов, чтобы исключить эозинофилию
|
Промежуточная
|
Низкая
|
|
ЭхоКГ
|
Новые структурные или функциональные аномалии; аномалии движения региональных стенок или глобальная желудочковая дисфункция без или с дилатацией желудочков, как правило, легкой степени; увеличение толщины стенки из-за миокардиального отека; выпот в перикард; внутрисердечные тромбы, не объясненные другими состояниями (например, КБС, ОКС или порок сердца)
|
Высокая
|
Низкая
|
|
МРТ
|
Обнаружение отека, воспаления и фиброза, количественная оценка и локализация с помощью картирования T1 и T2, оценки внеклеточного объема и позднего накопления гадолиния
|
Высокая
|
Промежуточная
|
|
Дополнительные диагностические тесты
|
|
КАГ или КТА КА
|
Исключить КБС или ОКС при клиническом подозрении на миокардит
|
Высокая
|
Высокая
|
|
ЭМБ
|
Для диагностики и показаний к специфическому лечению
|
Промежуточная
|
Высокая
|
|
ПЭТ
|
Может быть полезна у пациентов, которым не выполнена МРТ, или при подозрении на системный аутоиммунный процесс или саркоидоз
|
Низкая
|
Низкая
|
|
Дополнительные лабораторные тесты
|
Ферменты скелетных мышц, функция печени и почек, НУП, функция ЩЖ, статус железа, маркеры системных аутоиммунных заболеваний
|
Низкая
|
Низкая
|
|
СРБ повышен у 80–90% пациентов
|
Промежуточная
|
Низкая
|
|
ПЦР-тестирование распространенных кардиотропных вирусов. Он может обнаружить системную инфекцию, но не доказывает сердечную инфекцию и не может заменить. Анализ генома вирусов на образцах ЭМБ. Циркулирующие антитела IgG к кардиотропным вирусам распространены в отсутствие вирусного миокардита. Очень ограниченная диагностическая ценность. Специальный тест на SARS-CoV-2, Borrelia, ВИЧ или ЦМВ при клиническом подозрении
|
Низкая
|
Низкая
|
Примечание. ЭКГ – электрокардиография; АВ – атриовентрикулярный; ЭхоКГ – эхокардиография; КАГ – коронароангиография; КТА КА – компьютерная томографическая ангиография коронарных артерий; КБС – коронарная болезнь сердца; ОКС – острый коронарный синдром; ПЭТ – позитронно-эмиссионная томография; НУП – натрийуретический пептид; ЩЖ – щитовидная железа; IgG – иммуноглобулин G; СРБ – С-реактивный белок; ПЦР – полимеразная цепная реакция.
Оценка распространенности миокардита в остром и отдаленном периодах после COVID-19, патогенетические механизмы развития повреждения миокарда, а также его ближайшие и отдаленные исходы не установлены. В имеющейся литературе данные зачастую носят весьма противоречивый характер. Так, в крупнейшем систематическом обзоре [7] выявлено более 50 долгосрочных эффектов COVID?19. Установлено, что COVID-19 может включать персистирование вируса, а также и другие медицинские осложнения, которые длятся от нескольких недель до нескольких месяцев после первоначального выздоровления. Базы LitCOVID и Embase были проверены на предмет поиска статей с исходными данными, опубликованными до 1 января 2021 года, включавшие минимум 100 пациентов. Всего была идентифицирована 18 251 публикация, из которых 15 соответствовали критериям включения. Оценена распространенность 55 отдаленных эффектов, проведен 21 мета-анализ, включено 47 910 пациентов (возраст 17–87 лет) от 14 до 110 дней после заражения вирусом. Было подсчитано, что у 80% инфицированных пациентов с SARS-CoV-2 развился один или несколько долговременных симптомов. Пять наиболее частых симптомов: утомляемость (58%), головная боль (44%), нарушение внимания (27%), выпадение волос (25%) и одышка (24%). При этом миокардит, как следствие COVID-19, был описан в 1 исследовании: из 287 пациентов он развился у 4 (распространенность оценена 0–4%). По другим данным, встречаемость миокардита при COVID-19 находится в пределах 8–12% [8]. В условиях высокой вирусной нагрузки у 7% пациентов описаны случаи развития фульминантного миокардита [9].
Патогенез повреждения миокарда при COVID-19 комплексный. Обсуждают несколько механизмов: прямое повреждение миокарда, опосредуемое взаимодействием вируса SARS-CoV-2 с миокардиальными рецепторами АПФ2, повреждение сердечной мышцы цитокинами и другими провоспалительными факторами [10].
В миокарде погибших от COVID-19 описаны воспалительные изменения и фиброз [11], однако прямых доказательств наличия в кардиомиоцитах вирусной рибонуклеиновой кислоты (РНК) до настоящего времени нет. Вместе с тем в сходной клинической ситуации у погибших от тяжелого острого респираторного синдрома получены доказательства взаимодействия вируса SARS-CoV с миокардиальными рецепторами АПФ2, причем в миокарде выявляли РНК этого вируса [12]. Если миокард был «SARS-CoV-положительным», морфологические признаки его повреждения выражены значительно сильнее, а длительность жизни пациентов в стационаре короче, чем при «SARS-CoV-отрицательных» биоптатах [12].
Показанием для выполнения ЭМБ у пациентов с подозрением на миокардит является прогрессирующая или стойкая тяжелая сердечная дисфункция, и/или опасные для жизни желудочковые аритмии, и/или АВ-блокада Мобитц 2-й степени или выше при отсутствии крат-косрочного (<1–2 недель) ожидаемого ответа на обычное лечение. Цель состоит в том, чтобы определить этиологию и указать специфическое лечение (например, при гигантоклеточном или эозинофильном миокардите, саркоидозе сердца, системных воспалительных заболеваниях). Оптимальное число и место забора образцов для ЭМБ: минимум – 5, но возможно не менее 7 образцов: 3 – для патологии, 2 – для инфекций (ДНК, ПЦР), 2 – для РНК-вирусов/вирусной репликации. Левый и/или правый желудочек. Можно рассмотреть возможность отбора проб с помощью МРТ или ПЭТ [1].
При ЭМБ возможно точное установление этиологического фактора. Для этого проводится количественный анализ вирусного генома с помощью ПЦР на общие кардиотропные вирусы (парвовирус B19, HHV4, HHV6, энтеровирусы, аденовирус и вирус Коксаки) с помощью полимеразной цепной реакции с обратной транскриптазой. Для выявления активной репликации вируса может быть оценена вирусная микроРНК, хотя она имеет низкую чувствительность. По показаниям выполняется исследование на наличие ЦМВ, ВИЧ, Borrelia, Coxiella burnetii (Q-лихорадка) и SARS-CoV-2. Для объективизации воспаления проводится иммуногистохимическое исследование с окрашиванием на анти-CD3-, CD4-, CD8- или CD45-антитела для лимфоцитов, анти-CD68-антитела для макрофагов и анти-HLA-DR-антитела. Иммуносупрессивная терапия может быть показана на основании результатов ЭМБ при гигантоклеточном или эозинофильном миокардите, при саркоидозе, васкулите или у отдельных пациентов с усиленным сердечным воспалением неизвестного происхождения на основании многопрофильных консультаций. При выявлении по данным ЭМБ этиологического фактора острого миокардита назначается лечение – антибиотикотерапия (при боррелиозе – болезни Лайма), противовирусная терапия – при ВИЧ, ЦМВ [1].
Еще один крайне информативный метод для диагностики миокардита – МРТ сердца, рекомендуется исходно у всех пациентов с подозрением на миокардит, имеющих анамнез + ЭКГ, повышенный уровень сердечных тропонинов или ЭхоКГ изменения (табл. 3), если тяжелая КБС исключена или маловероятна. В дальнейшем МРТ рекомендуется при последующем наблюдении у пациентов со стойкой дисфункцией при ЭхоКГ, аритмиями или отклонениями ЭКГ. Вместе с тем даже отрицательный результат сканирования T1/T2 не исключает продолжающегося воспалительного процесса в хронической фазе [1].
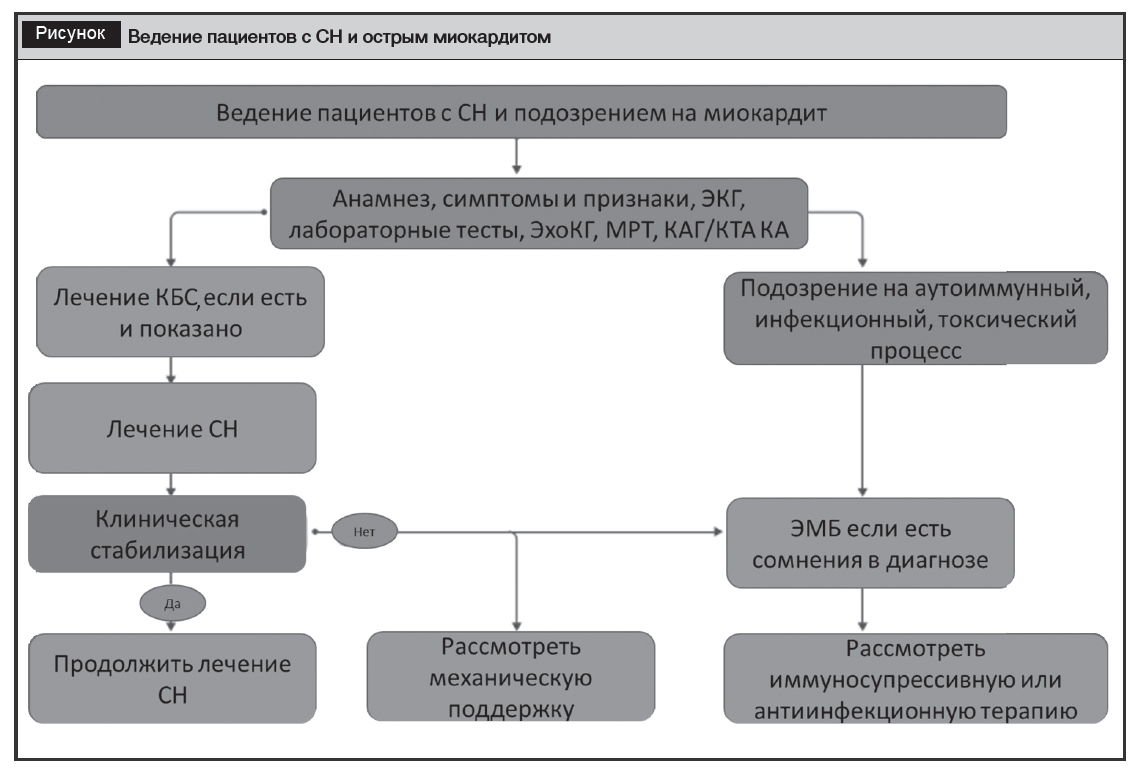
Европейским обществом кардиологов рекомендован алгоритм ведения пациентов с СН и подозрением на миокардит, представленный на рисунке.
Клинически миокардит проявляется по-разному, начиная от легких симптомов (боль в груди и сердцебиение, сопровождающихся преходящими изменениями на ЭКГ), вплоть до развития жизнеугрожающих состояний (кардиогенный шок и желудочковая аритмия). Особенностью ассоциированного с COVID-19 миокардита является то, что он регистрируется через 2 недели после появления респираторных симптомов коронавирусной инфекции [13].
Обращает на себя внимание, что в согласительном мнении экспертов рабочей группы ESC по болезням мио-карда и перикарда (2013) [3], как и в новых рекомендациях ESC по диагностике и лечению острой и хронической сердечной недостаточности (2021) [1], доказательная база в отношении медикаментозной терапии недостаточна для того, чтобы сформировать рекомендации в соответствии с принципами медицины, основанной на доказательствах. Большинство рекомендаций представляют собой согласительное мнение экспертов.
Тактика ведения пациентов с миокардитом определяется гемодинамической стабильностью. Так, в соответствии с Рекомендациями ESC (2021) госпитализация на срок не менее 48 часов целесообразна для пациентов с острым миокардитом и СН, особенно при повышении тропонина, а также при наличии систолической дисфункции и/или аритмий на начальном этапе [1].
В консенсусном документе по миокардитам экспертов ESC (2013) сказано, что при подозрении на миокардит у лиц без симптомов или с мягкой симптоматикой рекомендуется госпитализация и клинический мониторинг до постановки окончательного диагноза, так как ситуация может развиваться быстро, а опасное сердечно-легочное событие (например, тяжелая форма блокады или угрожающая жизни аритмия) может наступить неожиданно даже при изначально сохраненной систолической функции. При острой стадии миокардита противопоказаны тестовые физические нагрузки, поскольку способны ускорить проявление аритмии. Пациентам с гемодинамически стабильной СН назначают диуретики, иАПФ или БРА и БАБ. Для лиц с симптомами СН, сохраняющимися даже при получении надлежащей терапии, следует рассмотреть дополнительное лечение АМР. Прекращение терапии СН после восстановления функции желудочка не регламентируется. Нестероидные противовоспалительные средства (НПВС), в частности ацетилсалициловая кислота, являются основой лечения острого перикардита, но приводили к повышенной смертности в экспериментальных моделях миокардита. Клинические данные их назначения при миокардите остаются неубедительными, и необходимо проведение контролируемых исследований. В экспериментальных моделях острого вирусного миокардита у мышей применение индометацина и других НПВС приводило к увеличению выраженности воспаления в миокарде и увеличению смертности животных. Следовательно, назначение НПВС в минимально необходимых дозах можно рассматривать только при лечении пациентов с перимиокардитом, у которых отсутствуют какие-либо нарушения функции ЛЖ и имеются выраженные боли в грудной клетке, обусловленные перикардитом.
Больным с гемодинамически нестабильной СН в соответствии с действующими рекомендациями ESC по СН экстренная помощь оказывается в отделении интенсивной терапии, оснащенном средствами искусственной вентиляции легких и сердечно-легочной реанимации. В острых/молниеносных случаях с кардиогенным шоком и серьезным нарушением функции желудочка с целью создания условий для трансплантации сердца или стабилизации состояния может потребоваться подключение аппарата вспомогательного кровообращения или экстракорпоральная мембранная оксигенация [3].
В Рекомендациях ESC по СН (2021) сказано, что несмотря на отсутствие доказательной базы для некоторых форм острого миокардита, рекомендовано лечение СНснФВ в соответствии с актуальными рекомендациями (см. табл. 2), а после разрешения настоящего эпизода острого миокардита терапию следует продолжать в течение не менее 6 месяцев до полного функционального восстановления (ФВ>50%). Специфическая иммуносупрессивная терапия в течение не менее 6–12 месяцев требуется при остром миокардите с клиническими или ЭМБ-признаками аутоиммунного заболевания, включая гигантоклеточный миокардит, васкулит или саркоидоз и проводится согласно соответствующим клиническим рекомендациям [1]. Иммуносупрессия не рекомендуется при остром миокардите на регулярной основе без клинических или основанных на ЭМБ доказательств аутоиммунного заболевания. Первоначальное эмпирическое внутривенное введение кортикостероидов можно рассмотреть в случаях сильного подозрения на иммуноопосредованный миокардит, особенно если он осложнен ОСН, злокачественными аритмиями и/или высокой степенью АВ-блокады.
Следует избегать интенсивных занятий спортом до тех пор, пока симптомы повышенных кардиальных ферментов или аномалии ЭКГ-визуализации присутствуют и сохраняются в течение не менее 6 месяцев с момента полного выздоровления. Необходимо ежегодное наблюдение в течение не менее 4 лет с ЭКГ и ЭхоКГ, так как острый миокардит может привести к ДКМП примерно в 20% случаев [1].
Таким образом, патогенез развития миокардитов различной этиологии имеет сложный комплексный характер, не все механизмы его установлены. До сих пор неясным остается вопрос, почему у некоторых пациентов миокардит может протекать в малосимптомной стертой форме и разрешаться бесследно, а у некоторых лиц он трансформируется в ДКМП. Также неясно, чем обусловлена обратимость острого миокардита после перенесенного COVID-19.
Одной из точек зрения на патогенетические пути профилактики развития постмиокардитических осложнений является вовлеченность в патологический процесс РААС. Считается, что за счет как можно более рано начатого приема препаратов, блокирующих РААС, возможно уменьшение выраженности дезадаптивного ремоделирования сердца, а также уменьшение вероятности прогрессирования СН [3].
В экспериментальных моделях аутоиммунного или вирусного миокардита на мышах применение иАПФ каптоприла, а также БРА лозартана и олмесартана приводило к статистически значимому уменьшению выраженности воспаления, некроза и фиброза.
Кроме того, данные, полученные в ходе выполнения экспериментальных исследований на животных, позволяют предположить, что применение иАПФ или БРА снижает регуляцию возможных аутоиммунных компонентов заболевания в отсутствие увеличения концентрации инфекционных агентов, за счет которых возможно начало развития миокардита.
Так, защитные эффекты лозартана у мышей с хроническим вирусным миокардитом, вызванным вирусом Коксаки B3 (CVB3), описаны Y.-Y. Zhang и соавт. [14]. 32 самцам мышей Balb/с внутрибрюшинно вводили CVB3 (10?TCID50) для индукции хронического вирусного миокардита. Этим мышам перорально ежедневно в течение 28 дней вводили лозартан в дозе 12,5 мг/кг (n=16) или физиологический раствор (n=6). Неинфицированных мышей (n=6) использовали в качестве контроля. На 29-й день всем мышам проводили анестезию и эхокардиографию. Уровни сывороточнных маркеров воспаления (интерлейкин-17 (ИЛ-17), ИЛ-4 и тумор-некротизирующего фактора-альфа (ТНФ-альфа)) измеряли с помощью иммуноферментного анализа, а сердечные ткани исследовали гистологически после окрашивания гематоксилином и эозином. Кроме того, влияние лозартана на титры вируса в первично культивируемых кардиомиоцитах новорожденных крыс, инфицированных CVB3, измеряли на клетках Hep-2 через 72 часа после инфицирования. У мышей, инфицированных CBV3, значительно увеличилась смертность, соотношение массы сердца к массе тела, показатели некроза и воспаления, а также снизилась ФВ по сравнению с контролем (р<0,05). Лозартан значительно снизил смертность с 40,0% до 12,5% (р<0,05), отношение массы сердца к массе тела – с 7,08±2,17 до 4,15±0,99 (р<0,05), а показатели некроза и воспаления – с 3,33±0,50 до 2,50±0,65 (р<0,05), увеличил ФВ от 55,80±9,25 до 72,31±12,15 (р<0,05). Лозартан значительно усилил ИЛ-4 и снизил ТНФ-альфа и ИЛ-17 (все р<0,05). В эксперименте in vitro лозартан не влиял на титры вируса. Таким образом, лозартан защищал мышей от CVB3-индуцированного хронического вирусного миокардита ответов Th1 и Th17.
Сравнительное действие лозартана, каптоприла и эналаприла на острый миокардит мышей, вызванный вирусом энцефаломиокардита, оценивалось М. Араки и соавт. [15]. Лозартан вводили перорально в течение 14 дней мышам с вирусным миокардитом, начиная с 7-го дня после инокуляции вируса энцефаломиокардита. ИАПФ (каптоприл и эналаприл) вводили таким же образом для сравнения их воздействия на степень выраженности миокардита, ОСН и гипертрофии ЛЖ. Масса сердца и соотношение массы сердца/массы тела снижались в группе лозартана (60 мг/кг/день) и каптоприла (7,5 мг/кг/день), но не эналаприла (1 мг/кг/день). Толщина стенки ЛЖ и размер полости уменьшились в группах лозартана и каптоприла. Каптоприл уменьшал как некроз миокарда, так и воспаление, тогда как эналаприл уменьшал некроз миокарда, но не воспаление. Таким образом, специфическая блокада РААС полезна при СН и гипертрофии ЛЖ [15].
На фармацевтическом рынке Республики Беларусь с 2009 года зарегистрирован лозартан производства ОАО «Гедеон Рихтер» (Венгрия) под названием «Сентор» в дозировках 50 мг и 100 мг. C.М. Комиссаровой и соавт. [16] доказано, что включение в комплекс терапии пациентов с гипертрофической кардиомиопатией вместе с бета-блокатором лозартана (Сентор, ОАО «Гедеон Рихтер», Венгрия) в течение 6 месяцев тормозит прогрессирование диастолической дисфункции и вызывает снижение нейрогуморальной активности, диагностируемое по уровню NT-proBNP, то есть способствует уменьшению степени выраженности и прогрессирования СН, что может быть крайне актуальным у пациентов, перенесших острый миокардит и/или имеющих продолженный постковидный синдром.
Эффективность препарата лозартана (Сентор) в удержании синусового ритма у пациентов с пароксизмальной или персистирующей ФП была установлена А.М. Пристромом и соавт. [17]. В группе лиц, принимавших Сентор, выявлено значимое снижение количества и продолжительности эпизодов ФП за счет уменьшения отрицательного ремоделирования миокарда предсердий и фиброза, что также может быть крайне важным в лечении миокардита, в том числе COVID-19-ассоциированного, и его последствий.
Нами ранее было установлено, что прием препарата лозартана (Сентор) способствовал исчезновению сочетанных тревожно-депрессивных расстройств, клинически выраженной тревоги, депрессии у пациентов с метаболическим синдромом. Эффект наблюдался уже через 1 месяц терапии и сохранялся в течение 6 месяцев приема препарата [18].
Таким образом, Е.Г. Малаева и соавт. пришли к выводу, что продолжающиеся клинические исследования позволяют уточнить не только основные эффекты этого класса, но и выявить новые свойства, которые приносят пользу пациентам с артериальной гипертензией и другими сердечно-сосудистыми заболеваниями. Физиологическая роль РААС дала основание рассчитывать на эффекты БРА в других областях клинической медицины (неврология, пульмонология, гепатология, онкология), а выполненные экспериментальные и клинические исследования демонстрируют обнадеживающие результаты [19]. Применяемые в Республике Беларусь с 2010 года препарат лозартана (Сентор) и с 2011 года фиксированная комбинация лозартана с гидрохлортиазидом (Ко-Сентор) производства ОАО «Гедеон Рихтер» являются хорошо изученными и продемонстрировавшими свою высокую клиническую эффективность и безопасность.
Л И Т Е Р А Т У Р А
1. McDonagh T.A., Metra M., Adamo М., et al. // Eur. Heart J. – 2021. – Vol.42, Iss.36. – P.3599–3726.
2. Maddox T.M., et al. // JACC. –2021. – Vol.77, N6. – P.772–810.
3. Caforio A.L.P., Pankuweit S., Arbustini E., et al. // Eur. Heart J. – 2013. – N34. – P.2636–2648.
4. Gore I., Saphir O. // Am. Heart J. – 1947. – N34. – P.827–830.
5. Basso C., Calabrese F., Corrado D., Thiene G. // Cardiovasc. Res. – 2001. – N50. – P.290–300.
6. Daniels C.G., Rajpal S., Greenshields J.T., et al. // JAMA Cardiol. 2021. – N6 (9). – P.1078–1087.
7. Lopez Leon S., Wegman Ostrosky T., Perelman C., et al. // Scientifc. Rep. – 2021. – N11. – P.16144.
8. Guzik T., Mohiddin S.A., Dimarco A., et al. // Cardiovasc. Res. – 2020. – Vol.116, 10. – P.1666–1687.
9. Chen C., Zhou Y., Wang D.W. // Herz. – 2020. – Vol.45, N3. – P.230–232.
10. Козлов И.А., Тюрин И.Н.С. // Вестник анестезиологии и реаниматологии. – 2020. – Т.17, №4. – С.14–22.
11. Xu Z., Shi L., Wang Y., et al. // Lancet Respir. Med. – 2020. – Vol.8, N4. – P.420?422.
12. Oudit G.Y., Kassiri Z., Jiang C., et al. // Eur. J. Clin. Invest. – 2009. – Vol.39, N7. – P.618?625.
13. БубноваМ.Г., АроновД.М. // Пульмонология. – 2020. – Т.30, №5. – С.688–699.
14. Zhang Y.-Y., Li J.-N., Hua-Xiang Xia, et al. // Life Sci. – 2013. – Vol.92, N24–26. – P.1186–1194.
15. Araki M., Kanda T., Imai S., et al. // Cardiovasc. Pharmacol. – 1995. – Vol.26, N1. – P.61–65.
16. Комиссарова С.М., Мельникова О.П., Севрук Т.В., Устинова И.Б., Ковш Е.В. // Мед. новости. – 2015. – №3. – С.35–38.
17. Пристром А.М., Рачок С.М., Казаков С.А. [и др.] // Кардиология в Беларуси. – 2013. – №1 (26). – С.4–16.
18. Суджаева О.А., Суджаева С.Г. // Мед. новости. – 2012. – №10. – С.71–76.
19. Малаева Е.Г., Силивончик Н.Н., Буглова А.Е. // Семейный доктор. – 2015. – №4. – С.24–29.
Медицинские новости. – 2021. – №12. – С. 36-41.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.