Внимание! Статья адресована врачам-специалистам
Romanova I.S., Kozhanova I.N., Chak T.A.
Belarusian State Medical University, Minsk
Features of the use of antihypertensive drugs in patient
with chronic kidney disease
Резюме. Артериальная гипертензия (АГ) и хроническая болезнь почек (ХБП) зачастую тесно взаимосвязаны и существенно повышают риск неблагоприятных исходов. Резистентная АГ способствует прогрессирующему снижению функции почек вплоть до терминального состояния, в то время как ХБП может быть причиной вторичной симптоматической АГ. При АГ на фоне ХБП препаратами выбора являются ингибиторы ангиотензинпревращающего фермента или блокаторы рецепторов ангиотензина II типа по причине доказанного нефро- и кардиопротекторного действия. Однако при ХБП 4-й и 5-й стадии данные группы лекарственных препаратов противопоказаны. Без существенного ограничения по уровню скорости клубочковой фильтрации могут быть использованы блокаторы кальциевых каналов. Если целевое артериальное давление не достигнуто, к лечению добавляют бета-адреноблокаторы или препараты преимущественно центрального действия. При отсутствии контроля за артериальным давлением могут быть использованы a1-адреноблокаторы. При необходимости диуретической терапии тиазидные или тиазидподобные диуретики используются преимущественно на ранних стадиях ХБП, на 4–5-й стадии предпочтение следует отдавать петлевым диуретикам с учетом интервала дозирования.
Ключевые слова: артериальная гипертензия, хроническая болезнь почек, ингибиторы ангиотензинпревращающего фермента, антагонисты рецепторов ангиотензина II типа, блокаторы кальциевых каналов, бета-адреноблокаторы, альфа1-адреноблокаторы, диуретики.
Медицинские новости. – 2022. – №6. – С. 44–49.
Summary. Arterial hypertension and chronic kidney disease (CKD) are often linked and significantly increase the risk of adverse cardiovascular outcomes. Resistant arterial hypertension contributes to a progressive decline in renal function up to the terminal state, while CRD can cause secondary symptomatic arterial hypertension. In any case, a stable increase in blood pressure requires the appointment of drug treatment. For hypertension and CKD, angiotensin-converting enzyme inhibitors or angiotensin II receptor blockers are the drugs of choice, as they have proven nephro- and cardioprotective effects. However, the degree of decrease in the glomerular filtration rate should be taken into account: these groups of drugs are contraindicated in CKD 4–5 stages. The second-line drugs are calcium channel blockers in case of ineffectiveness of monotherapy or the impossibility of prescribing the above mentioned groups. If the target blood pressure is not reached, beta-blockers or drugs of predominantly central action are added to the treatment. In the absence of blood pressure control, alpha1-blockers can be used. If diuretic therapy is needed, especially in the later stages of CKD, loop diuretics may be recommended based on the dosing interval. Thiazide or thiazide-like diuretics can only be used in the early stages of CKD.
Keywords: arterial hypertension, chronic kidney disease, angiotensin-converting enzyme inhibitors, angiotensin II receptor antagonists, calcium channel blockers, beta-blockers, a1-blockers, diuretics.
Meditsinskie novosti. – 2022. – N6. – P. 44–49.
Широкая распространенность артериальной гипертензии (АГ) во всем мире, недостаточный контроль за уровнем артериального давления (АД) на фоне терапии и, соответственно, наличие высоких рисков осложнений сохраняет интерес ведущих научных сообществ к данной проблеме. При этом АГ у пациентов с хронической болезнью почек (ХБП) встречается в 2–3 раза чаще, чем в общей популяции [6]. По данным некоторых эпидемиологических исследований, 67–71% пациентов с ХБП имеют повышенное АД [5, 32]. С увеличением возраста и прогрессированием ХБП число лиц с сопутствующей АГ возрастает до 90% [42, 51].
ХБП и АГ часто настолько взаимо-связаны, что в клинической практике при выявлении снижения функции почек и повышения АД затруднительно выяснить, что является первопричиной. ХБП может быть следствием длительно существующей эссенциальной АГ, особенно при неадекватном контроле АД. Однако при развитии ХБП вследствие других заболеваний, например, сахарного диабета или гломерулонефрита, АГ может иметь вторичный характер. При этом гломерулонефрит может внезапно развиться у пациента с уже существующей (и не выявленной своевременно) эссенциальной АГ. Симптоматическая АГ чаще развивается в случае наиболее тяжелых форм нефропатий, при этом нарушение контроля за АД может указывать на прогрессирование патологии почек [6]. Помимо этиологии ХБП и уровня альбуминурии/протеинурии на распространенность и степень выраженности АГ будет влиять наследственная предрасположенность, в то время как социально-экономические факторы и образ жизни могут оказывать влияние на возможность контроля АГ [29]. В любом случае ХБП является причиной или следствием повышения АД, сопутствующую АГ необходимо корригировать с учетом сниженной функции почек, что может накладывать определенные ограничения в выборе лекарственных препаратов. В данной статье мы попытаемся разобраться с приоритетными направлениями в выборе терапии АГ с учетом стадии ХБП.
Несмотря на возможные сложности в определении этиологии АГ, необходимо понимать, что вторичная АГ имеет свои особенности течения и во многом зависит от первичного заболевания почек. При успешном проведении патогенетической терапии нефропатии, АД может стабилизироваться или даже нормализоваться без гипотензивной поддержки. При этом патогенетическая терапия может включать лекарственные препараты, которые способствуют повышению АД (глюкокортикоиды, циклофосфан, эритропоэтин-альфа). При прогрессировании заболевания в почках одновременное использование даже 3–4 антигипертензивных препаратов в максимально переносимых дозах может быть малоэффективно. Именно вторичная гипертензия зачастую оказывается резистентной к лечению и быстрее приводит к поражению органов-мишеней. Поэтому приоритетным будет выбор лекарственных препаратов с доказанной кардио- и нефропротекцией, например, группы препаратов, влияющие на ренин-ангиотензиновую систему (ингибиторы ангиотензинпревращающего фермента (иАПФ), блокаторы рецепторов ангиотензина (БРА)) [17, 27, 36, 39]. Однако по мере снижения выделительной функции почек будет изменяться фармакокинетика лекарственных средств, и назначение иАПФ, БРА, а также ингибиторов ренина и тиазидных диуретиков чревато снижением эффективности и/или развитием побочных эффектов [6]. Это ограничивает врача в выборе групп лекарственных препаратов по мере увеличения стадии ХБП. Если к ситуации добавить возможную индивидуальную непереносимость каких-либо препаратов, лечение АГ становится весьма затруднительным при широком выборе лекарственной терапии с убедительной доказательной базой.
Смертность от сердечно-сосудистых причин у пациентов, нуждающихся в диализе, в 10–20 раз выше, чем в общей популяции. Но даже у лиц с ранними стадиями ХБП вероятность умереть от сердечно-сосудистых событий в 5–10 раз выше, чем вероятность дожить до терминальных стадий патологии почек [1]. Поэтому контроль за возможными кардиальными рисками у пациента с ХБП любой стадии – одна из первостепенных задач.
Для достижения целевых значений АД у больных с ХБП при выборе лекарственных препаратов необходимо руководствоваться данными о наличии нефро- и кардиопротекции, которые представлены в результатах клинических испытаний. Однако большинство рандомизированных клинических исследований (РКИ) посвящено изучению действия какого-либо препарата или комбинации препаратов в группах пациентов, включенных в исследование по определенному признаку/заболеванию. Исследования, посвященные коррекции АД у лиц с ХБП, особенно с терминальной стадией до или во время диализа, немногочисленны и иногда имеют противоречивый характер. Это связано с тем, что пациенты с ХБП исторически исключались из исследований по лечению гипертензии, и, как следствие, именно нефрологи часто сталкиваются с резистентной АГ у пациента с ХБП и ограниченными данными о том, как лучше всего лечить данное состояние [24]. Поэтому доказательная база рекомендаций, посвященных лечению АГ у больных с патологией почек, недостаточна и часто требует пересмотра [6]. При этом необходимо учитывать, что многие препараты или группы препаратов обладают свойствами нефропротекции на более ранних стадиях ХБП, в то время как при ХБП 4-й и особенно 5-й стадии без диализа могут быть опасны при использовании. Это говорит о необходимости постоянного мониторинга функции почек для своевременной коррекции гипотензивной терапии.
Препараты, влияющие на ренин-ангиотензиновую систему
Поражение почек, связанное с АГ, характеризуется гломерулярным и тубулоинтерстициальным повреждением. Гиперактивация ренин-ангиотензин-альдостероновой системы (РААС), главным образом ангиотензином II, предположительно является основным фактором прогрессирующего почечного фиброза.
В различных РКИ [9, 21, 26, 39, 48, 49, 55] показаны выраженные нефропротекторные свойства препаратов, блокирующих РААС. В связи с этим при наличии у пациента ХБП с альбуминурией/протеинурией иАПФ или БРА могут быть рекомендованы даже при отсутствии АГ. При наличии повышенного АД у больного с ХБП 1–2-й стадии иАПФ или БРА являются препаратами выбора. Однако по мере снижения функции почек помимо нефро- и кардиопротекторного эффекта увеличивается вероятность побочных эффектов. БРА и иАПФ уменьшают компенсаторную гиперфильтрацию, тем самым способствуют более быстрому снижению скорости клубочковой фильтрации (СКФ) при низком функциональном резерве почек [3]. Поэтому терапия данными группами препаратов должна проводиться на фоне регулярного мониторинга уровней креатинина и калия в сыворотке крови. Повышение уровня креатинина более чем на 50% от исходного может свидетельствовать о резкой дестабилизации почечной гемодинамики, критическом падении клубочкового давления, что часто наблюдается при сниженной перфузии почек. Данная ситуация служит показанием для немедленной отмены препарата. В отношении протеинурии и сохранения функции почек сравнительные клинические исследования не выявили преимуществ какой-либо из указанных групп, но БРА значительно реже вызывают сухой кашель и ангионевротический отек, а также гиперкалиемию (за счет уменьшения канальцевой реабсорбции калия) по сравнению с иАПФ [15]. Необходимо учитывать совместный прием некоторых препаратов, ухудшающих почечный кровоток (например, нестероидных противовоспалительных препаратов, НПВП). Учитывая безрецептурную продажу данных лекарственных препаратов, пациент должен быть предупрежден об основных возможных побочных реакциях.
Многочисленные исследования (IRMA, IDNT, RENAAL, MARVAL, DROP, SMART) предоставили доказательства наличия нефропротекторного эффекта для различных представителей БРА (лозартан, валсартан, ирбесартан и др.) [33]. БРА представляют собой семейство агентов, которые конкурентно блокируют АТ1-рецепторы ангиотензина II, что приводит к ослаблению его эффекта, реализуемого через данные рецепторы. В результате действия блокады АТ1-рецепторов уменьшается артериальная вазоконстрикция, снижается секреция альдостерона, вазопрессина, эндотелина, норадреналина, что приводит к снижению АД. При этом эффекты ангиотензина II, реализуемые через АТ2-рецепторы, не только сохраняются, но и могут усиливаться за счет увеличения синтеза ангиотензина II типа по принципу обратной связи после блокады АТ1-рецепторов и воздействия увеличенного количества ангиотензина на оставшиеся свободными АТ2-рецепторы. Это приводит к дополнительным органопротективным эффектам БРА. Для группы БРА характерно наличие антиоксидантного эффекта за счет снижения продукции агрессивных свободных радикалов, увеличения синтеза эндотелием вазодилататоров простациклина и оксида азота, что способствует коррекции эндотелиальной дисфункции. Применение БРА приводит к снижению риска кардио-васкулярных осложнений и повышению чувствительности периферических тканей к инсулину [12]. С момента своего появления в 1995 году эти агенты широко используются в терапии АГ и для уменьшения осложнений сердечно-сосудистой патологии и диабетической нефропатии.
Лозартан (Сентор®, ОАО «Гедеон Рихтер», Венгрия) является сильнодействующим, перорально активным и высокоспецифичным блокатором рецепторов ангиотензина I типа [13]. В дополнение к антигипертензивной эффективности лозартан снижает индекс массы левого желудочка у пациентов с АГ, конечно-диастолический и конечно-систолический объемы левого желудочка у лиц с сердечной недостаточностью и предотвращает сердечно-сосудистые заболевания и смерть, преимущественно инсульт, независимо от снижения цифр АД. Краткосрочные исследования у пациентов с сахарным диабетом (СД) 1-го типа с явной нефропатией показали, что лозартан и иАПФ оказывают сходное благотворное влияние на скорость экскреции альбумина, АД и почечную гемодинамику. Согласно крупному многоцентровому исследованию RENAAL, лозартан снижал скорость экскреции альбумина у больных микроальбуминурией и СД 2-го типа. Более того, в исследовании RENAAL было показано, что блокада рецепторов АТ1 лозартаном превосходит стандартную антигипертензивную терапию в замедлении прогрессирования диабетической нефропатии. В совокупности данные клинических испытаний демонстрируют положительный эффект БРА, включая лозартан, в первичной и вторичной профилактике прогрессирования почечной недостаточности у больных СД [43]. Согласно инструкции по медицинскому применению лозартана (Сентор®), одним из показаний для назначения является лечение заболевания почек у взрослых пациентов, страдающих АГ и СД 2-го типа в сочетании с протеинурией более 0,5 г/день в качестве составной части антигипертензивной терапии. При этом для лиц с нарушением функции почек и для пациентов, получающих лечение гемодиализом, не требуется коррекция начальной дозы [13].
В отличие от монотерапии любым из препаратов комбинация иАПФ с БРА ухудшает все основные почечные исходы. Были опубликованы результаты различных исследований, которые показали, что комбинация иАПФ/БРА удваивают риск развития почечной недостаточности и гиперкалиемии при сравнении с назначением одного из этих препаратов, особенно у пожилых пациентов, что окончательно утвердило в невозможности одновременного использования данных групп препаратов. Некоторые РКИ были остановлены досрочно из соображений безопасности [37, 39]. Согласно Рекомендациям ESC/ESH по лечению АГ 2018 года, совместный прием 2 препаратов, блокирующих РААС, не применяется (класс рекомендаций III, уровень доказательства А).
Блокаторы кальциевых каналов
Для терапии АГ дигидропиридиновые блокаторы кальциевых каналов (БКК) используются очень широко, при этом в немногочисленных исследованиях не было получено данных о нефропротективном эффекте данной группы препаратов. В Кокрейновском обзоре, который включал 13 исследований, проведенных до апреля 2020 года, и объединил 1459 пациентов с ХБП, нуждающихся в гемодиализе, использование БКК приводило к снижению АД, однако улучшение каких-либо ренальных исходов не получено. При этом некоторые исследования были достаточно кратковременны и оценить риски сердечно-сосудистых событий проблематично [40]. В исследованиях, где включены пациенты с более ранними стадиями ХБП, отмечено, что дигидропиридиновые БКК неэффективны в снижении уровня протеинурии или замедлении прогрессирования ХБП, несмотря на их эффективность в снижении АД [19, 23]. С использованием радиотелеметрии АД в экспериментальных моделях протеинурии было продемонстрировано, что дигидропиридиновые БКК приводят к большему гломерулосклерозу при любом заданном повышении АД по сравнению с нелечеными животными или животными, получавшими блокаду РААС [19, 22].
Бета-адреноблокаторы
У бета-адреноблокаторов не выявлено доказанных нефропротекторных свойств, поэтому данные препараты могут быть назначены с целью дополнительного снижения АД и кардиопротекции [15], особенно когда использование основных нефропротективных препаратов (иАПФ [27, 39], БРА [36]) недостаточно или противопоказано из-за выраженной дисфункции почек или по иной причине. Предпочтение в данной ситуации следует отдавать высокоселективным бета-адреноблокаторам без внутренней симпатомиметической активности и длительным периодом полувыведения (метопролол замедленного высвобождения, бисопролол, небиволол) [10], которые с осторожностью могут быть использованы и при тяжелой ХБП (клиренс креатинина менее 20 мл/минуту). В клинической практике также применяется a/b-адреноблокатор карведилол, который обладает свойствами липофильности, пролонгированным гипотензивным и антиангинальным эффектом и при этом за счет блокады a-адренергических рецепторов может положительно повлиять и на почечную функцию, улучшив перфузию паренхимы почек [11, 28].
Адренергические средства центрального действия
В настоящее время препаратом выбора данной группы является агонист I2-имидазолиновых рецепторов моксонидин, у которого в отличие от агонистов центральных ?1-адренорецепторов (метилдопа, клонидин) отсутствуют или значительно менее выражены многие побочные эффекты. При этом моксонидин, помимо достаточно эффективного снижения АД, снижает реабсорбцию натрия в почках, что уменьшает задержку его в организме, снижает альбуминурию, усиливает липолиз, снижает высвобождение катехоламинов надпочечниками. Данные плейотропные эффекты обусловлены наличием I2-имидазолиноых рецепторов в тканях вне центральной нервной системы [3]. В одном из исследований было показано, что добавление моксонидина к комплексной терапии АГ способно увеличить продолжительность жизни пациентов с ХБП [38].
Альфа1-адреноблокаторы
альфа1-адреноблокаторы являются препаратами резерва для лечения резистентной АГ. Исследования по использованию данной группы препаратов у пациентов с ХБП весьма ограничены. Согласно результатам канадского популяционного ретроспективного когортного исследования, было выявлено, что использование альфа-адреноблокаторов (празозина, теразозина, доксазозина) при ХБП связано с более высоким риском прогрессирования заболевания почек, но с меньшим риском сердечных событий и смертности по сравнению с альтернативными препаратами, снижающими АД [30].
При назначении альфа-адреноблокаторов пациентам с ХБП, особенно на 3б–5-й стадии и в пожилом возрасте, нужна предельная осторожность с целью исключения развития эпизодов гипотонии [15], однако не требуется коррекция дозы, так как фармакокинетика и фармакодинамика не меняется при нарушении функции почек [31].
Диуретики
Определенную нишу в лечении АГ, особенно резистентной, у пациентов с ХБП могут занимать мочегонные препараты. Несмотря на то, что снижение СКФ ограничивает максимально достижимый эффект для любого диуретика за счет адаптивного увеличения доставки жидкости из проксимального канальца вместе с избыточной экспрессией транспортера, диуретический ответ сохраняется даже у лиц с выраженной ХБП [34]. Эффективная доза диуретика должна быть больше, чем у пациентов с нормальной функцией почек [24]. Согласно рекомендациям National Kidney Foundation Kidney Disease Outcomes Quality Initiative (NKF K/DOQI), тиазидным диуретикам следует отдавать предпочтение на 1-й и 2-й стадии ХБП, на 3-й стадии появляется необходимость замены тиазидных диуретиков на петлевые, так как существенное повышение дозы препарата не приводит к увеличению натрийуретического эффекта, при этом могут возникать побочные явления. Петлевые диуретики являются препаратами выбора на 4-й и 5-й стадии ХБП [4] и при наличии нефротического синдрома могут быть назначены для перорального приема один или два раза в сутки [35]. В приведенных результатах мета-анализов, которые суммарно обобщили 30 РКИ у взрослых пациентов с АГ, было показано, что тиазидоподобные диуретики более эффективны в предотвращении сердечно-сосудистых событий, чем тиазидные [41, 45]. Одна из причин, возможно, – длительный период их полувыведения [42], что помимо основных эффектов повышает приверженность пациентов. Для преодоления резистентности к диуретикам при выраженном нефротическом синдроме может быть использована комбинация из петлевого и тиазидного диуретиков в высоких дозах [4]. Ряд недавно проведенных исследований показал эффективность использования гидрохлортиазида и хлорталидона при АГ на фоне ХБП 4-й и 5-й стадии. При этом у пациентов со значительно нарушенной функцией почек помимо снижения АД (в среднем на 15 мм рт. ст.) достаточно часто отмечались различные электролитные нарушения. Поэтому в настоящее время рекомендовать использование комбинации тиазидных и тиазидподобных диуретиков у лиц с тяжелой ХБП не представляется возможным. Необходимы результаты хорошо спланированных РКИ для получения достоверных доказательств возможности применения таких комбинаций [4, 47].
На поздних стадиях ХБП (СКФ <20–30 мл/мин/1,73 м2) для лечения АГ может быть эффективно использован петлевой диуретик с учетом интервала дозирования. Торасемид предпочтительнее за счет более высокой и стабильной биодоступности, и, как правило, он может вводиться один раз в день по сравнению с фуросемидом, который требует дозирования 2–3 раза в день.
Диуретики в целом и тиазиды в частности связаны с повышенным риском гиперурикемии, но это не должно препятствовать их применению у пациентов с ХБП, учитывая частое присутствие гиперволемии [24]. Однако, согласно инструкции по медицинскому применению гидрохлортиазида (согласовано Министерством здравоохранения Республики Беларусь, приказ №648 от 02.06.2021), симптоматическая гиперурикемия или подагра, в том числе в анамнезе, являются противопоказанием для его назначения.
Следует соблюдать осторожность при необходимости применения антагонистов минералокортикоидных (альдостероновых) рецепторов, в частности спиронолактона, у пациентов с ХБП по причине высокой вероятности гиперкалиемии [24]. Калийсберегающие диуретики обладают эффектом кардио- и нефропротекции за счет нивелирования неблагоприятных эффектов активированной РААС. Данная группа препаратов может быть использована в сочетании с другими гипотензивными препаратами, а также для купирования или предотвращения гипокалиемии на фоне применения петлевых или тиазидных диуретиков. Однако снижение СКФ ниже 60 мл/мин/1,73 м2 требует коррекции дозы препарата, а снижение ниже 30 мл/мин/1,73 м2 – полной его отмены из-за опасности развития побочных эффектов [4]. Поэтому при необходимости использования спиронолактона при ХБП должен быть тщательный регулярный мониторинг клиренса креатинина и уровня калия в плазме крови [44, 46]. Сочетание калийсберегающих диуретиков с иАПФ, НПВП, сердечными гликозидами, гепарином, бета2-адреноблокаторами резко увеличивает вероятность гиперкалиемии, повышения уровня креатинина и развития острого повреждения почек [44, 54]. При этом не исключается использование спиронолактона у пациентов, находящихся на гемодиализе или перитонеальном диализе. В настоящее время проводится исследование ALCHEMIST, целью которого является получение доказательства снижения кардиоваскулярной и общей летальности при условии соблюдения строгого контроля плазменных уровней калия [4].
Клинические рекомендации
В сентябре 2021 года в Республике Беларусь вышел новый клинический протокол (КП), регламентирующий диагностику и лечение пациентов (взрослое население) с ХБП 5-й стадии методом гемодиализа, перитонеального диализа, а также лечение осложнений, связанных с ХБП 5-й стадии у лиц, находящихся на различных видах хронического диализа [7]. Данный клинический протокол включил и лечение АГ у больных, находящихся на диализе.
Целевым АД у пациентов, получающих лечение методом диализа, считается значение ниже 140/90 мм рт. ст. Основным путем достижения и поддержания данного уровня АД является получение адекватной дозы диализа (гемодиализом Kt/V >1,2; перитонеальным диализом – недельного Kt/V >1,7), а также достижение пациентом «сухого веса» и ограничение потребления соли до 2–3 г в сутки. Количественная характеристика эффективности лечения методом программного гемодиализа выражается коэффициентом очищения Kt/V по мочевине: при проведении программного гемодиализа в режиме 3 раза в неделю минимальная доза Kt/V одного сеанса должна составлять не менее 1,2.
Если диеты, достижения «сухого веса» и адекватного диализа недостаточно для контроля за АД, необходимо использовать антигипертензивные лекарственные препараты. Назначенная схема антигипертензивной терапии должна учитывать способность препарата выводиться во время диализа и в случае выведения назначать данное лекарство после сеанса диализа.
Согласно данному КП, для лечения АГ у пациентов, находящихся на постоянном гемодиализе (или перитонеальном диализе) могут быть использованы следующие группы препаратов: БРА (валсартан, ирбесартан, кандесартан, лозартан, телмисартан, азилсартан), иАПФ (каптоприл, эналаприл, лизиноприл, фозиноприл, периндоприл, рамиприл), бета-адреноблокаторы (карведилол, небиволол, атенолол, бисопролол, бетаксолол, метопролол, пропранолол), БКК (амлодипин, нифедипин с контролируемым высвобождением, верапамил, дилтиазем), препараты преимущественно центрального действия (метилдопа, моксонидин), альфа1-адреноблокаторы (теразозин, доксазозин).
У пациентов с АГ, получающих лечение методом гемодиализа (перитонеального диализа), может быть активно использована комбинированная терапия. Принципы комбинированной антигипертензивной терапии оговариваются рядом международных и национальных руководств [8]. Предлагается комбинировать лекарственные средства в соответствии с их фармакокинетическими/фармакодинамическими особенностями и суммацией или потенцированием эффектов взаимодействия.
Например, по данным исследований, длительная комбинированная терапия лизиноприлом и амлодипином (Экватор®, ОАО «Гедеон Рихтер», Венгрия) полностью соответствует современным требованиям к антигипертензивной терапии – приводит к достоверному снижению риска прогрессирования ХБП и развития сердечно-сосудистых осложнений, при этом является метаболически нейтральной. Снижение комбинированного риска прогрессирования ХБП и развития сердечно-сосудистых осложнений было связано с кардио- и нефропротекторным действием Экватора®, а также со снижением негативного влияния инсулинорезистентности у больных АГ и СД 2-го типа [14]. Согласно инструкции по медицинскому применению, во время терапии препаратом «Экватор®», у пациентов с почечной недостаточностью необходимо контролировать функцию почек, содержание натрия и калия в сыворотке крови. В случае ухудшения функции почек необходимо прекратить прием Экватора и заменить его отдельными компонентами: лизиноприлом (Диротон®) и амлодипином (Нормодипин®) [16]. У пациентов, получающих лечение гемодиализом, следует учитывать, что лизиноприл на 60% выводится во время 4-часового сеанса гемодиализа, поэтому предпочтительно его назначение после процедуры [2]. Амлодипин не выводится во время диализа, поэтому схема его приема может не изменяться относительно времени проведения гемодиализа [16]. Нарушение функции почек замедляет выведение лизиноприла, что становится клинически значимым при снижении СКФ до 30 мл/мин/1,73 м2 и ниже [2].
Наличие на нашем рынке монопрепаратов (Диротон®, Сентор®) [2, 13] и устойчивых комбинаций с удобной линейкой дозирования дает возможность гибкого подбора моно- и комбинированной терапии и повышения приверженности пациентов к лечению [8].
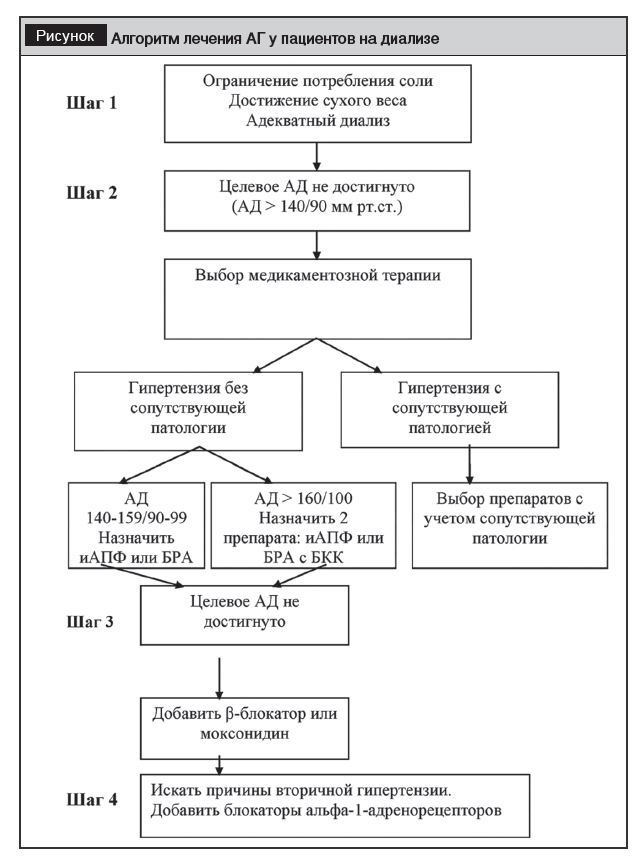
Вышеуказанный КП включает следующий алгоритм лечения лиц с АГ, находящихся на диализе (рисунок): при неэффективности диеты и других немедикаментозных методов лечения (например, отказ от курения и занятия адекватными физическими нагрузками) терапия должна быть дополнена лекарственными средствами с учетом сопутствующей патологии. При АД в пределах 140–159/90–99 мм рт. ст. предпочтение можно отдавать монотерапии препаратами, блокирующими РААС: иАПФ (например, лизиноприл) или БРА (например, лозартан). Если же АД выше 160/100 мм рт. ст., к указанным препаратам должны быть добавлены БКК (амлодипин). Если на данном шаге целевое АД не удается достигнуть, к лечению добавляют моксонидин или бета-адреноблокатор. Неэффективность лечения АГ тремя препаратами из вышеуказанных групп в максимально переносимых дозах указывает на наличие резистентной АГ. Несмотря на то, что поражение паренхимы почек само по себе может способствовать резистентности АГ, наличие ХБП не должно препятствовать поиску дополнительной причины вторичной гипертензии [24]. Также на данном этапе могут быть использованы ?-адреноблокаторы.
Как видно на рисунке, препараты групп иАПФ или БРА рекомендованы в качестве стартовых не только у пациентов с ХБП ранних стадий, но и у лиц, получающих заместительную почечную терапию гемодиализом. В данном случае нефропротективные свойства уже не имеют первоначального значения, однако, учитывая высокий риск сердечно-сосудистых осложнений у данной категории, должны быть использованы кардиопротективные (плейотропные) свойства иАПФ и БРА. Данная терапия становится эффективной и безопасной при адекватном контроле уровня калия в сыворотке крови.
Для пациентов с ХБП 5-й стадии, получающих лечение гемодиализом, характерны колебания АД и во время процедуры: у 10–15% больных регулярно встречается интрадиализная гипертензия. По результатам недавнего исследования интрадиализная гипертензия любой степени и интрадиализная гипотензия тяжелой степени могут существенно повышать риск смертности. Повышение АД во время диализа может быть связано с низкими уровнями альбумина и мочевины у пациента перед процедурой, что способствует небольшому снижению осмолярности и, как следствие, препятствует снижению АД. Для решения данной проблемы помимо амбулаторного регулярного приема гипотензивных препаратов может быть рекомендован пересмотр «сухого веса» пациента, даже если клинически нет признаков перегрузки объемом. Также следует рассмотреть возможность снижения содержания натрия в диализате, хотя долгосрочные эффекты этого вмешательства неясны.
Для увеличения эффективности и безопасности антигипертензивного лечения пациентам в зависимости от стадии ХБП необходимо соблюдать специальную диету. На более ранних стадиях ХБП при отсутствии нефротического синдрома и других состояний, связанных с задержкой жидкости, рекомендуется соблюдать расширенный водный режим (употреблять не менее 2 л жидкости в сутки), в то время как у лиц с нефротическим синдромом, ХБП 5-й стадии объем жидкости должен быть минимально возможным. Независимо от стадии ХБП при наличии АГ рекомендована низкосолевая диета (менее 2 г соли в сутки), а при ХБП 3–5-й стадии – низкобелковая диета (0,6–0,8 г/кг сутки) [21]. Следует напоминать пациентам, находящимся на постоянном гемодиализе и принимающим иАПФ или БРА, о необходимости соблюдения диеты с ограничением содержания калия и регулярном мониторинге уровня калия в сыворотке крови [29].
Таким образом, лечение АГ по мере снижения функции почек может представлять определенные трудности для клинициста. Поэтому необходимо выявлять предпосылки к развитию нефропатии и своевременно назначать адекватное гипотензивное лечение с учетом нефропротекции.
Л и т е р а т у р а
1. Бова А.А. // Мед. новости. – 2013. – №6. – С.27–33.
2. Диротон. Инструкция по применению лекарственного средства для специалистов / Приказ Министерства здравоохранения Республики Беларусь №256 от 13.03.2017.
3. Домбровский Я. // Почки. – 2014. – №8 (2). – С.59–62.
4. Дядык А.И. [и др.] // Архив внутренней медицины. – 2020. – №1. – С.10–20.
5. Зуева Т.В., Жданова Т.В. // Леч. врач. – 2020. Электронный доступ: https://www.lvrach.ru/2020/09/15437680.
6. Клинические рекомендации «Диагностика и лечение артериальной гипертензии при хронической болезни почек». Научное общество нефрологов России. Ассоциация нефрологов России. – М., 2014. – 74 с.
7. Клинический протокол «Лечение осложнений, связанных с хронической болезнью почек 5-й стадии у пациентов (взрослое население), находящихся на различных видах хронического диализа». Постановление МЗ РБ от 02.08.2021 №93.
8. Кожанова И.Н. // Мед. новости. – 2018. – №6. – С.35–42.
9. Леонова М.В. // Consilium Medicum. – 2014. – №16 (1). – С.7–12.
10. Моисеев В.С. [и др.] // Клиническая нефрология. – 2014. –№2. – С.4–29.
11. Муркамилов И.Т. [и др.] // Рациональная фармакотерапия в кардиологии. – 2017. – №13 (3). – С.422–426.
12. Окороков А.Н. // Новости отечественной фармации. – 2020. –№3. – С.29–33.
13. Сентор. Инструкция по применению лекарственного средства для специалистов / Приказ Министерства здравоохранения Республики Беларусь №1248 от 21.10.2019.
14. Стаценко М.Е., Деревянченко М.В. // Кардиология. – 2015. – Т.55, №8. – С.43–48.
15. Шевцов М.Ю. [и др.] // Методическое руководство для врачей. – М. – 83 с.
16. Экватор. Инструкция по применению лекарственного средства для специалистов / Приказ Министерства здравоохранения Республики Беларусь №468 от 22.04.2020.
17. Amann K., et. al. // Nephrol. Dial Transplant. – 1996. – Vol.11, N6. – P.1003–1011.
18. Bakris G.L., et al. // JAMA. – 2004. – Vol.292, N18. – P.2227–2236.
19. Bakris G.L., et al. // Kidney Int. – 2004. – Vol.65. – P.1991–2002.
20. Bakris G.L., et al. // Kidney International. – 2006. – Vol.70, N11. – P.1905–1913.
21. Bakris G.L., et al. // Lancet. – 2010. – Vol.375. – P.1173–1181.
22. Bidani A.K., et al // Hypertension. – 2009. – Vol.54. – P.393–398.
23. Bidani A.K., et al. // Am. J. Med. – 2012. – Vol.125, N11. – P.1057–1062.
24. Braam B., et. al. // Clin. J. Am. Soc. Nephrol. –2017. – Vol.12, N3. – P.524–535.
25. Bragg-Gresham J.L., et al. // Amer. J. Kidney Dis. – 2007. – Vol.49. – P.426–431.
26. Clase C.M., et al. // Kidney Int. – 2017. – Vol.91, N3. – P.683–690.
27. Epstein M. // Nat. Clin. Pract. Nephrol. – 2009. – Vol.5. – P.12–13.
28. Hiremath S.B., Lokikere S.D. // Int. J.Basic Clin. Pharmacol. –2016. – Vol.5, N3. – P.769–74.
29. Horowitz B., Miskulin D., Zager P. // Adv. Chronic Kidney Dis. – 2015. – Vol.22, N2. – P.88–95.
30. Hundemer G.L., et al. // J. Kidney Dis. – 2021. – Vol.77, N2. – P.178–189.
31. Jungers P., et al. // Am. J. Med. – 1986. – Vol.80, N5B. – P.94–99.
32. Kalaitzidis R.G., Elisaf M.S. // Curr. Hypertens Rep. – 2018 – Vol.20, N8. – P.64.
33. Kidney Disease: Improving Global Outcomes (KDIGO) Glomerulonephritis Work Group KDIGO (2012) Clinical Practice Guideline for Glomerulonephritis // Kidney Int. – 2012. – Suppl.2. – P.139–274.
34. Kim G.H. // Am. J. Nephrol. – 2004. –Vol.24, N6. – P.595–605.
35. Kumra R., Bargman J.M. // Adv. Perit. Dial. – 2014. – Vol.30. – P.115–119.
36. Lewis E.J., et al. // N. Engl. J. Med. – 2001. –Vol.345. – P.851–860.
37. Linda F. Fried, et al. // N. Engl. J. Med. – 2013. – Vol.369, N20. – P.1892–903.
38. Littlewood K.J., et al. // BMC Nephrol. – 2007. – Vol.24, N8. – P.9.
39. Mann J.F., et al. // Lancet. – 2008. – Vol.372. – P.547–553.
40. Mugendi G.A., et al. Перевод Базаева О.М. Основаная группа Кокрейновских обзоров: Kidney and Transplant Group. 2020.
41. Olde Engberink R.H., et al. // Hypertension. – 2015. – Vol.65. – P.1033–1040.
42. Peco-Antic A., Paripovic D. // Srp. Arh. Celok Lek. – 2014. – Vol.142, N1–2. – P.113–117.
43. Perico N. // Expert Rev. Cardiovasc. Ther. – 2004. – Vol.2, N4. – P.473–83.
44. Rossignol P., Frimat L., Zannad F. // Kidney Int. – 2019. – Vol.95, N4. – P.747–749.
45. Roush G.C., et al. // Hypertension. – 2012. – Vol.59. – P.1110–1117.
46. Sica D.A. // Nat. Rev. Nephrol. – 2011. – Vol.8, N2. – P.100–109.
47. Sinha A.D., Agarwal R. // Curr. Hypertens Rep. – 2015. – Vol.17. – P.13.
48. The GISEN Group. // Lancet. –1997. – Vol.349. – P.1857–1863.
49. The Heart Outcomes Prevention Evaluation Study Investigators // Lancet. – 2000. – Vol.355. – P.253–259.
50. Upadhyay A., et al. // Ann. Intern. Med. – 2011. – Vol.154. – P.541–548.
51. Valika A., Peixoto A.J. // Adv. Chronic Kidney Dis. – 2016. – Vol.23, N4. – P.255–261.
52. Van Buren P.N. // Curr. Opin. Nephrol. Hypertens. – 2017. – Vol.26, N4. – P.303–310.
53. Van Buren P.N., Inrig J.K. // Semin. Dial. – 2017. – Vol.30, N6. – P.545–552.
54. Whittaker C.F., et al. // Clin. J. Am. Soc. Nephrol. – 2018. – Vol.13. – P.1738–1746.
55. Wright J.T., et al. // JAMA. – 2002. – Vol.288. – P.2421–2431.
Медицинские новости. – 2022. – №6. – С. 44-49.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.