Внимание! Статья адресована врачам-специалистам
Guluzade L.Ch.
Zafaran Hospital, Baku, Azerbaijan
Evaluation of white matter hyperintensities using MRI
of the brain in patients with type 2 diabetes mellitus
Резюме. Магнитно-резонансная томография (МРТ) показывает распространенность гиперинтенсивных очагов белого вещества (ГОБВ) головного мозга. ГОБВ и другие изменения белого вещества являются серьезными причинами когнитивных нарушений и деменции. Основной целью нашего исследования является оценка ГОБВ у больных сахарным диабетом (СД) 2-го типа в Азербайджане при МРТ-исследовании головного мозга и изучение их связи с заболеванием. Исследование проводилось в Клинике учебной хирургии АМУ и больнице Зафаран. В исследование включено 100 пациентов в возрасте 40–65 лет. Кроме того, в качестве контрольной группы выступили 50 практически здоровых лиц.
При обследовании 50 практически здоровых лиц ГОБВ не выявлены у 45%, среднее число случаев ГОБВ, выявленных у 55% больных, составило 1,8, средний размер – 1 мм. Согласно полученным нами данным, у 100 пациентов с СД 2-го типа, включенных в исследование, среднее количество ГОБВ составило 45, а средний размер – 3,2 мм. Кроме того, количество ГОБВ головного мозга было выше у больных СД 2-го типа (n=72) с артериальной гипертензией, чем у лиц без нее. Особой разницы в количестве и размерах ГОБВ, обнаруженных при МРТ головного мозга, среди мужчин и женщин не наблюдалось. Результаты исследования показывают, что эффективное лечение артериальной гипертензии у больных СД позволяет предотвратить увеличение количества ГОБВ. Увеличение количества и размеров очагов, тенденция к их слиянию, а также очаги, возникающие с возрастом, являются причиной развития у пациентов серьезных патологий, таких как преждевременная умственная отсталость.
Ключевые слова: гиперинтенсивные очаги белого вещества, магнитно-резонансная томография, сахарный диабет 2-го типа.
Медицинские новости. – 2022. – №6. – С. 69–71.
Summary. Magnetic resonance imaging (MRI) shows the prevalence of white matter hyperintensities (WMH) in the brain. WMH and other white matter changes are major causes of cognitive impairment and dementia. The main goal of our study was to assess WMH in patients with type 2 diabetes mellitus in Azerbaijan using MRI examination of the brain and to study their relationship with this disease. The study was conducted at the Clinic for Educational Surgical Clinic of Azerbaijan Medical University and «Zafaran» Hospital. The study included 100 patients with age range of 40–65 years. In addition, 50 apparently healthy individuals were included in the study as a control group. For the MRI examination we used the 1.5 Tesla Magnetom Aera MRI machine and images that were acquired in TIRM thin mode. Two different radiologists examined the obtained images.
When examining 50 practically healthy individuals, 45% of individuals did not have WMH, while the average number of WMH detected in the remaining 55% of patients was 1.8, and their average size was 1 mm. According to obtained data, the average number of WMH in 100 patients with type 2 diabetes included in the study was 45, and their average size was 3.2 mm. In addition, the number of WMH in the brain white matter was higher in patients with type 2 DM (n=72) with concomitant arterial hypertension than in those without arterial hypertension. There was no significant difference in the number and size of WMH detected on MRI of the brain among men and women. The study results demonstrate that effective treatment of arterial hypertension in diabetic patients helps preventing an increase in the number of WMH. An increase in the number and size of WMH, a tendency for their merge, as well as foci that occur with aging are the cause of the development of serious pathologies in patients, including early cognitive decline.
Keywords: white mater hyperintensities, magnetic resonance imaging, type 2 diabetes mellitus.
Meditsinskie novosti. – 2022. – N6. – P. 69-71.
Магнитно-резонансная томография (МРТ) показывает распространенность гиперинтенсивных очагов белого вещества (ГОБВ) головного мозга. ГОБВ и другие изменения белого вещества являются серьезными причинами возникновения когнитивных нарушений и деменции. Ханчински и его коллеги впервые описали появление гиподенсивных поражений белого вещества низкой плотности при компьютерной томографии (КТ) в конце 1980-х годов, назвав это лейкоареозом. Однако позже было обнаружено, что ГОБВ лучше выявляются при МРТ, поскольку она более чувствительна к изменениям мягких тканей. В режиме TIRM эти гиперинтенсивности более выражены, так как также подавляется сигнал гиперинтенсивности от спинномозговой жидкости. Более серьезные поражения отслеживаются по гипоинтенсивности в Т1-взвешенном режиме, но невыраженные поражения в этом режиме не видны (поэтому некоторые ученые считают его таким же чувствительным, как КТ). Первыми стали использовать низкопольные томографы. В настоящее время более широкое распространение получили аппараты МРТ с напряженностью магнитного поля 1,5 и 3 Тл [1, 20].
Исследования показывают, что ГОБВ в головном мозге увеличивают риск инсульта, вызывая гериатрический (стареющий) синдром, такой как депрессия, снижение когнитивных функций, недержание мочи и функциональные расстройства [2, 4].
Предполагается, что ГОБВ имеют сосудистое происхождение. Считается, что когнитивные нарушения увеличивают риск инсульта в три раза и риск деменции в два раза [2, 11]. За последние несколько десятилетий число людей с сахарным диабетом (СД) во всем мире увеличилось. Болезнь не только снижает качество их жизни, но и увеличивает затраты на регулирование медицинского и социального благополучия [20]. Исследования показывают, что СД является серьезным фактором риска в образовании ГОБВ головного мозга.
Цель исследования – оценка ГОБВ у больных СД 2-го типа в Азербайджане при МРТ-исследовании головного мозга и изучение их связи с заболеванием.
Материалы и методы
В исследование включено 100 пациентов (51 (51%) женщина и 49 (49%) мужчин) в возрасте 40–65 лет. Таким образом, люди старше 65 лет не вошли в наше исследование из-за увеличения ГОБВ в связи со старением. Кроме того, в качестве контрольной группы в исследование включены 50 практически здоровых лиц. Артериальная гипертензия отмечена у 72 (72%) больных СД. В исследование не включались пациенты с опухолями головного мозга и другими онкологическими заболеваниями, травмами, хирургическим анамнезом, демиелинизирующей патологией, больные с диагностированной мигренью. Исследование проводилось в Клинике учебной хирургии Азербайджанского медицинского университета и больнице Зафаран. Изображения были оценены двумя разными радиологами. В исследовании использовался аппарат МРТ Magnetom Aera мощностью 1,5 Тесла и изображения, полученные в тонком режиме TIRM. Изображения МРТ были получены с использованием TR-9200, TI 2450, TE 84 и толщины разреза 3,5 мм и зазора (gap) до 10% толщины разреза.
В ходе исследования МРТ головного мозга у пациентов обнаружены ГОБВ, расположенные в перивентрикулярном (не опирающиеся на поверхность желудочка) и в глубоком белом веществе. Оценивалось количество, размер (максимальный размер очага), локализация (по доле) гиперинтенсивных очагов белого вещества. Результаты сравнивали с практически здоровыми лицами. Благодаря тонкой толщине среза и высококачественным изображениям легко дифференцировать ГОБВ с мелкими сосудами, расширенными периваскулярными пространствами и мелкими лакунарными очагами.
Все показатели, полученные в ходе исследования, оценивались по критериям вариации (критерии t-Стьюдента, КU (Краскела – Уоллиса)), все расчеты выполнялись в электронной таблице Excel-2010 и пакетной программе SPSS-20.
Результаты и обсуждение
При обследовании 50 практически здоровых лиц ГОБВ не выявлены у 45%, среднее число случаев ГОБВ, выявленных у 55% больных, составило 1,8, средний размер – 1 мм (рис. 1а, б). Таким образом, установлено, что количество и размеры ГОБВ были выше у больных СД 2-го типа по сравнению с практически здоровыми лицами.
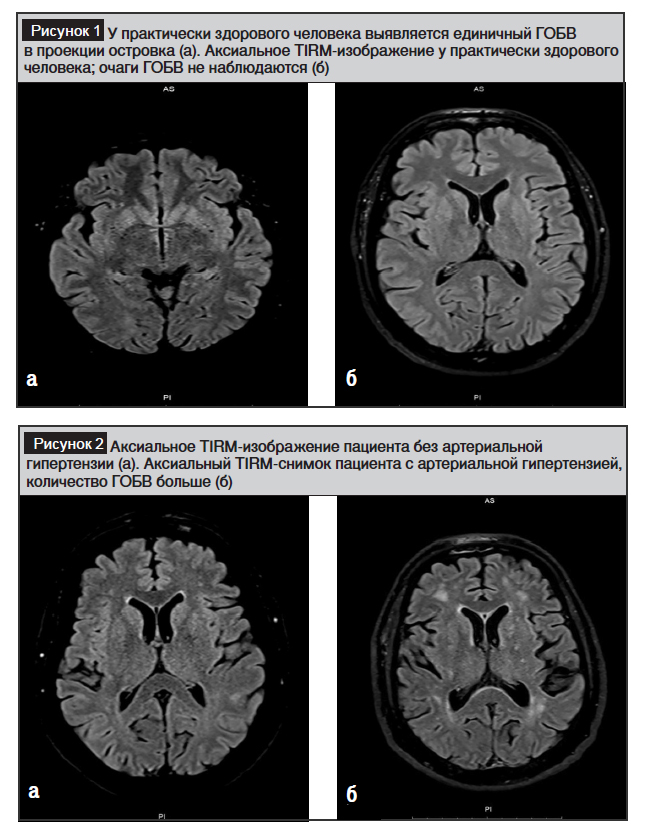
Согласно полученным нами данным, у 100 пациентов с СД 2-го типа, включенных в исследование, среднее количество ГОБВ составило 45, а средний размер – 3,2 мм.
Кроме того, количество ГОБВ было выше у больных СД 2-го типа (n=72) с артериальной гипертензией, чем у лиц без нее (рис. 2а, б).
Особой разницы в количестве и размерах ГОБВ, обнаруженных при МРТ головного мозга, среди мужчин и женщин не наблюдалось. Кроме того, достоверной корреляции между длительностью заболевания и количеством ГОБВ не обнаружено. При оценке локализации ГОБВ чаще располагались в лобных, затем теменных и менее выраженно в затылочных и височных долях.
Результаты исследований в этой области показывают, что ГОБВ, расположенные в глубоком белом веществе, связаны с депрессией, тогда как перивентрикулярные ГОБВ в большей степени – с когнитивными нарушениями. У лиц без СД или деменции в анамнезе количество ГОБВ как в глубоком, так и в перивентрикулярном белом веществе увеличивается по мере роста уровня HbA1c. Кроме того, увеличение ГОБВ отмечается также у пациентов, в анамнезе которых имелся лишь СД [13, 20]. В нашем исследовании количество ГОБВ у больных СД без каких-либо заболеваний было выше, чем у практически здоровых лиц, и идентично другим исследованиям. Таким образом, в результате гипергликемии при СД увеличиваются реактивные формы кислорода, а также конечные продукты процесса при образовании слишком большого количества глюкозы, и этот оксидативный стресс нарушает функцию эндотелия. Кроме того, ожирение и резистентность к инсулину, характерные для СД, являются результатом хронического системного воспаления, которое в свою очередь приводит к повреждению эндотелия. При СД также нарушается регуляция микроваскулярного кровотока [12, 20].
Novak и соавт. предполагают, что снижение кровотока в средней мозговой артерии связано с образованием и увеличением количества ГОБВ [20].
Исследование Адама де Хавенона и соавт. показало, что снижение уровня глюкозы в крови у пациентов с СД 2-го типа не уменьшает количество ГОБВ, но нормализация артериального давления снижает скорость их развития [10]. В нашем исследовании высокий уровень ГОБВ у лиц с артериальной гипертензией идентичен с этим выводом.
В своем исследовании Ван Хартен и соавт. показали, что ГОБВ был выше у пациентов с СД и артериальной гипертензией или без нее, чем в нормальной контрольной группе, что совпало с нашими результатами. Однако в некоторых исследованиях показано, что артериальное давление не играет роли в повышении уровня ГОБВ у лиц с СД [8].
Исследования показывают, что ГОБВ также увеличивается по мере увеличения продолжительности СД [8, 14]. Однако наше исследование не выявило этого соответствия.
Исследования показали, что пациенты с когнитивными нарушениями с высоким индексом пульсового давления имеют высокие уровни ГОБВ, однако у лиц без когнитивных нарушений связи с ГОБВ не обнаружено [18]. В результате ГОБВ увеличивается при высоком пульсовом давлении у пациентов с СД с легкими когнитивными нарушениями, но этого повышения не наблюдается у лиц без СД. Таким образом, путем нормализации индекса пульсового давления у больных СД можно предотвратить как легкие когнитивные нарушения, так и повышение ГОБВ [3, 18].
В результате исследований Сергио Гросса и соавт. обнаружено что, у пациентов с пре-диабетом и диабетом объем ГОБВ бывает больше, чем у лиц с нормальным уровнем глюкозы в крови [5, 7, 15]. Это согласуется с нашими данными по сравнению с практически здоровыми пациентами в контрольной группе.
У лиц с СД для выявления макроскопических изменений в головном мозге при МРТ используется режим DIR (двойной инверсией восстановления), а микроскопических – диффузионно-тензорная визуализация (ДТВ). В этом режиме учитываются значения ФA (фракционная анизотропия) и MD (средняя диффузионная способность). ФА указывает на ограниченное движение молекулы жидкости в любом направлении и уменьшается при микроструктурных повреждениях белого вещества. MD показывает, насколько быстро молекула воды распространяется повсюду и увеличивается при микроструктурных повреждениях белого вещества [16, 19]. В дальнейшем мы планируем использовать эти методики исследования на наших пациентах, ведь раннее обнаружение изменений в белом веществе, не выявляющихся при рутинном исследовании, но на самом деле имеющих патологию, может в будущем способствовать улучшению состояния пациента и прогноза болезни.
Небольшое снижение ГОБВ при наблюдении может быть клинически значимым. Таким образом, ни один другой фактор, кроме понижения артериального давления, не оказывает снижающего эффекта. Хотя некоторые исследования показали, что отказ от курения, физические упражнения и диета не влияют на снижение уровня ГОБВ, они замедляют нарушение когнитивных функций у пациентов [9, 17].
Мичито и Такамичи проводили исследования, как изменялся ГОБВ у 103 пациентов (1610 очагов) в течение 3 лет и более и с чем это могло быть связано. Исследование показало, что этиология ГОБВ до конца не изучена, а небольшое количество ГОБВ (227 очагов, 14,1%) уменьшилось и исчезло в промежутке между двумя обследованиями, особенно у пациентов с СД [1]. Исследование также показало, что чем дольше время между двумя МРТ-сканами, тем ниже годовой прирост ГОБВ [1].
Таким образом, результаты исследования показывают, что эффективное лечение артериальной гипертензии у больных СД позволяет предотвратить увеличение количества ГОБВ. Увеличение количества и размеров очагов, тенденция к их слиянию, а также очаги, возникающие с возрастом, являются причиной развития у пациентов серьезных патологий, таких как преждевременная умственная отсталость.
Иногда МРТ головного мозга проводят лицам с жалобами на головную боль и ухудшение памяти, которые не подозревают о своем заболевании. В результате, правильно информируя клиницистов о патологиях, которые могут вызывать ГОБВ в зависимости от их количества, размеров, склонности к слиянию и локализации, МРТ повышает эффективность диагностики. В настоящее время исследования в этой области представляют большой интерес и продолжаются.
Л И Т Е Р А Т У Р А
1. Adachi M., Takamichi Sato // Magnet. Res. Med. Sci. – 2017. – Vol.16, N3. – P.238–244.
2. Altermatt A., Gaetano L., Magon S., et al. // Neuro Image. – 2019. – Vol.189,N1. – P.727–733.
3. Carmichael O., Stuchlik P., Pillai S., et al. // J. Clin. Endocrinol. Metab. – 2019. – Vol.104. – P.4492–4500.
4. Caunca M.R., Simonetto M., Cheung Y.K., et al. // Stroke. – 2020. – Vol.51. – P.372–378.
5. Dybjer E., Nilsson P.M., Engström G., Helmer C., Nägga K. // BMC Endocr. Disord. – 2018. – Vol.18, N1. – P.91. doi: 10.1186/s12902-018-0318-3
6. Foreman Y.D., Brouwers M.C.G.J., Berendschot T.T.J.M., et al. // Cardiovasc. Diabetol. – 2019. – N18. – P.152.
7. Grosu S., Lorbeer R., Hartmann F., et al. // BMJ Open Diabetes Res Care. – 2021. – Vol.9, N1. – e002050.
8. Harten B., Oosterman J., Potter van Loon B., Scheltens P., Weinstein H. // Eur. Neurol. – 2007. – Vol.57, N2. – P.70–74.
9. Hase Y., Horsburgh K., Ihara M., Kalaria R.N. // J. Neurochem. – 2018. – Vol.144, N5. – P.617–633. doi: 10.1111/jnc.14271
10. Havenon А., Majersik J., Tirschwell D., et al. // Am. Academy Neurol. – 2019. – Vol.92, N11. – e1168–1175.
11. Marsegliaa A., Fratiglioni L., Kalpouzosa G., et al. // Alzheimers Dement. – 2019. – Vol.15, N1. – P.25–33. doi: 10.1016/j.jalz.2018.06.3060
12. No H.-J., Yi H.-A., Won K.S., et al. // Rev. Esp. Med. Nucl. Imagen. Mol. (English Edition). – 2019. – Vol.38, N3. – P.160–166. doi: 10.1016/j.remnie.2019.01.005
13. Pal K., Mukadam N., Petersen I., et al. // Soc. Psychiatry Psychiatr. Epidemiol. – 2018. – Vol.53, N11. – P.1149–1160. doi: 10.1007/s00127-018-1581-3
14. Sanahuja J., Alonso N., Diez J., et al. // Diabetes Care. – 2016. – N39. – P.1614–1620.
15. Schneider A.L.C., Selvin E.., Sharret A.R., et al. // Diabetes Care. – 2017. – Vol.40. – P.1514–1521.
16. Wang D., Wang L., Wei M., et al. // Front Endocrinol. (Lausanne). – 2020. – N11. – P.595962.
17. Wardlaw J., Chappell F., Hernández M., et al. // Am. Academy Neurol. – 2017. – Vol.89, N10. – P.1003–1010.
18. Werhane M., Kelsey R.T., Bangen K., et al. // Front Aging Neurosci. – 2021. – N13. – P.716638.
19. Xiong Y., Sui Y., Xu Z., et al. // AJNR Am. J. Neuroradiol. – 2016. – Vol.37, N8. – P.1462–1469. doi: 10.3174/ajnr.A4740
20. Yoshiaki T., Atsushi A. // Geriatr. Gerontol. Int. – 2015. – Vol.15, Suppl.1. – P.34–42.
Медицинские новости. – 2022. – №2. – С. 69-71.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.