Внимание! Статья адресована врачам-специалистам
MohortT.V.
Belarusian State Medical University, Minsk
Is there a chance to prevent type 2 diabetes mellitus?
Резюме. В обзоре представлены данные о распространенности предиабета, его негативном влиянии на риск развития сердечно-сосудистой патологии и прогрессирования в манифестную форму сахарного диабета 2-го типа. Приведены принципы диагностики и выделения групп риска для тестирования. Особое внимание уделено мерам, которые можно и нужно принимать после установления диагноза предиабет. Обоснована эффективность, целесообразность и безопасность применения метформина у данной категории больных. Рассмотрены современные данные о возможностях излечения сахарного диабета 2-го типа и предиабета.
Ключевые слова: предиабет, сахарный диабет 2-го типа, профилактика, кардиоваскулярная патология, метформин.
Медицинские новости. – 2022. – №12. – С. 16–21.
Summary. The review presents data on the prevalence of prediabetes, its negative impact on the risk of cardiovascular pathology and progression to manifest type 2 diabetes mellitus. The principles of its diagnosis and identification of risk groups for testing are given. Special attention is paid to the measures that can and should be taken after the diagnosis of prediabetes. The effectiveness, appropriateness and safety of metformin use in this category of patients is substantiated. Modern data on the potential for the cure of type 2 diabetes mellitus and prediabetes are considered.
Keywords: prediabetes, type 2 diabetes mellitus, prevention, cardio-vascular pathology, metformin.
Meditsinskie novosti. – 2022. – N12. – P. 16–21.
Диабет 2-го типа (СД2) является растущей проблемой общественного здравоохранения, которая увеличивает заболеваемость и смертность. По данным 10-го издания Атласа Международной федерации диабета, выпущенного в 2021 году, в Европейском регионе проживает 61 млн людей с СД, то есть 1 из 11 взрослых имеет это заболевание. Затраты на «диабет» в 2021 году составили 189 млрд долларов США и 1,1 млн смертей были обусловлены СД. К 2045 году прогнозируется увеличение количества пациентов до 69 млн. При этом 1 из 3 взрослых живет с недиагностированным СД [1].
Среди различных типов СД более 90% представлено СД2, поэтому именно это заболевание определяет значимость проблемы. По данным отчета эндокринологической службы Республики Беларусь, общее количество больных с СД увеличилось с 118 713 в 1995 году до 388 767 пациентов в 2021 году. На конец 2021 года на диспансерном учете состояло 363 774 пациента с СД2. По сравнению с данными 2019 года количество пациентов только с СД2 увеличилось на 14 376, то есть особенности оказания медицинской помощи в период COVID-19 не привели к снижению количества выявляемых пациентов, что определяет актуальность выявления СД2 и его предупреждение.
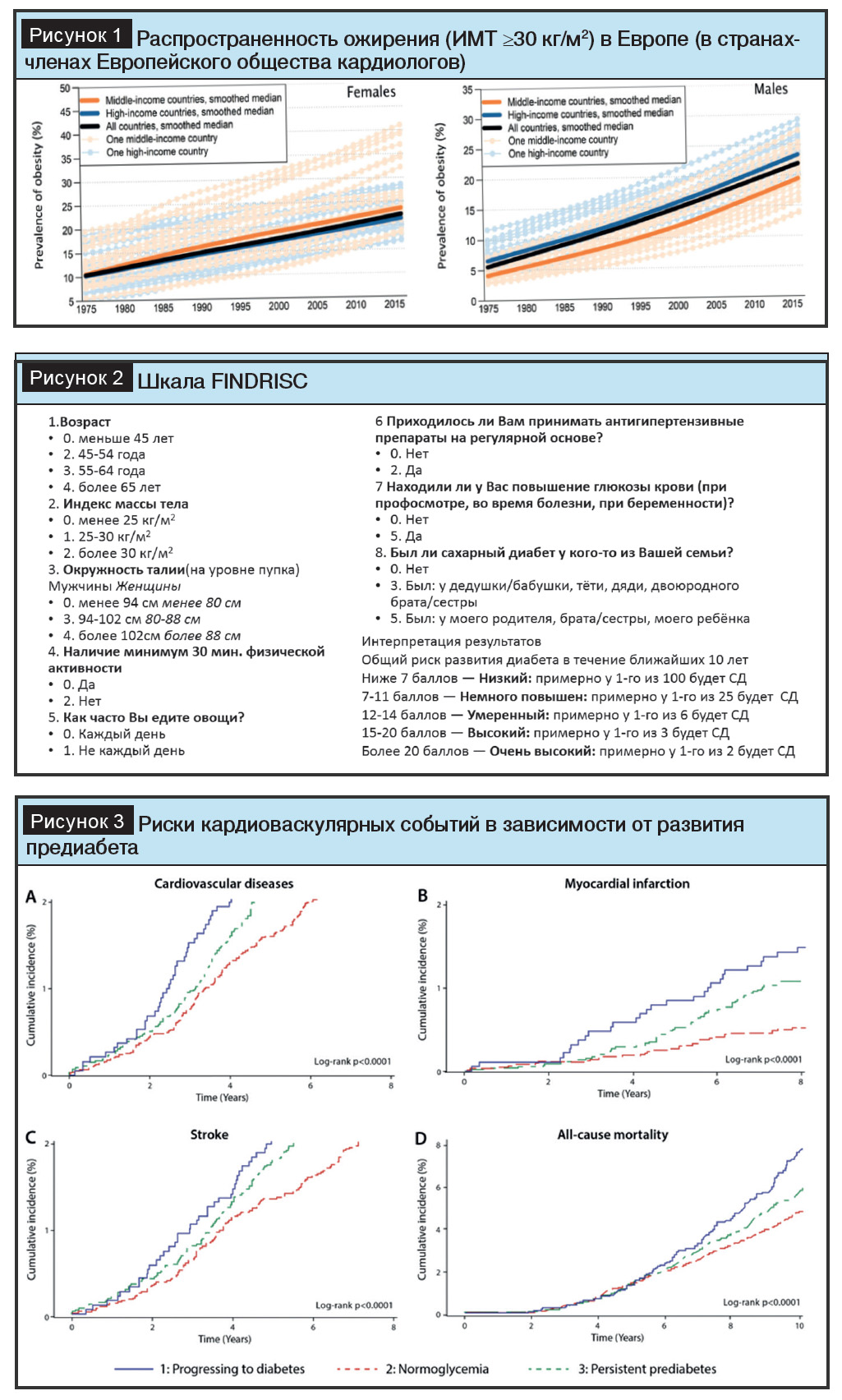
Ожирение является основной движущей силой пандемии СД2, который ассоциируется с прогрессирующим снижением функции ?-клеток в условиях резистентности к инсулину, развивающейся на фоне ожирения, что требует усиления фармакотерапии, которая часто завершается лечением инсулином. По данным Атласа Европейского общества кардиологов, сохраняется стойкое увеличение распространенности ожирения (рис. 1) [2]. Стандартизированная по возрасту распространенность СД 1-го и 2-го типов у взрослых в возрасте 20–79 лет в Беларуси составляет 5%, что ниже прогнозируемых показателей [2]. Потеря веса потенциально может обратить вспять эту траекторию и вызвать ремиссию СД2.
Согласно современным представлениям, в эволюции СД2 выделяют стадию предиабета – раннего нарушения метаболизма углеводов, включающую нарушение толерантности к глюкозе (НТГ) или нарушение гликемии натощак по данным орального теста на толерантность к глюкозе (ОГТТ), и манифестной стадии заболевания. Предиабет, как суммарное состояние, может быть диагностирован также по результатам оценки уровня гликированного гемоглобина (НbА1с).
Актуальность диагностики СД на стадии предиабета обусловлена его прогрессией в манифестный СД2 с развитием хронических осложнений; прямым влиянием на кардиоваскулярные заболевания и микрососудистые осложнения, подтвержденным при многолетнем наблю-дении; наличием возможностей коррекции и предупреждения его эволюции в манифестную стадию [3–6].
В ретроспективном когортном исследовании 3888 взрослых с предиабетом, проведенном в Балтиморе, обнаружено, что 63,4% пациентов прошли повторное тестирование на гликемию в течение 12 месяцев, но только в 10,4% случаев диагноз был установлен и закодирован, 1,0% пациентов получили рекомендации по питанию и в 5,4% случаев был назначен метформин. В течение последующих 12 месяцев после включения в исследование у 6% лиц с предиабетом развился манифестный СД [7]. Приведенное исследование демонстрирует неиспользование «окна» потенциальных возможностей по предупреждению развития манифестного СД.
Кардиоваскулярная патология является главной причиной смерти при СД, поэтому оценка влияния предиабета представляет несомненный интерес. Мета-анализ 129 исследований, в которых приняли участие 10 069 955 человек, продемонстрировал, что в общей популяции предиабет связан с повышенным риском смертности от всех причин (ОР 1,13; 95% ДИ 1,10–1,17), комбинированных сердечно-сосудистых заболеваний (ОР 1,15; 95% ДИ 1,11–1,18), ишемической болезни сердца (ОР 1,16; 95% ДИ 1,11–1,21) и инсульта (ОР 1,14; 95% ДИ 1,08–1,20) при среднем сроке наблюдения 9,8 года. По сравнению с нормогликемией абсолютная разница в риске смертности при предиабете от всех причин, комбинированных сердечно-сосудистых заболеваний, ишемической болезни сердца и инсульта составила 7,36 (95% ДИ от 9,59 до 12,51), 8,75 (от 6,41 до 10,49), 6,59 (от 4,53 до 8,65) и 3,68 (от 2,10 до 5,26) на 10 000 человеко-лет соответственно. Не было обнаружено существенной гетерогенности в отношении риска всех исходов, наблюдаемых при различных фенотипах предиабета [8]. Таким образом, предиабет нуждается в диагностике и проведении коррекционных мероприятий.
Вопрос, который возникает при планировании диагностики предиабета и СД2, – выделение групп риска для проведения тестирования.
На первом этапе могут быть использованы различные шкалы оценки риска развития СД2. Одной из самых популярных является шкала Finnish Diabetes Risk Score(FINDRISK), которая позволяет оценить 10-летний риск развития СД2, включая предиабет, у лиц старше 25 лет с 85% точностью (рис. 2) [9]. После определения риска показано проведение лабораторного тестирования для верификации наличия и выраженности нарушений углеводного обмена.
Согласно проекту Национальных протоколов «Диагностика и лечение пациентов с сахарным диабетом (взрослое население)», подготовленных рабочей группой, диагностика СД проводится на основании установления факторов риска, клинических симптомов и лабораторных определений концентрации глюкозы в крови (натощак, или при проведении ОГГТ) и/или HbA1c. Подход, изложенный в протоколах, согласуется с рекомендациями ВОЗ и ведущих международных экспертов.
Факторы риска развития СД2:
– избыточная масса тела или ожирение (ИМТ >25 кг/м2);
– возраст старше 45 лет;
– семейный анамнез (СД у родственников первой степени родства);
– артериальная гипертензия (АД >140/90 мм рт. ст.) или использование антигипертензивных лекарственных средств в постоянном режиме;
– наличие других сердечно-сосудистых заболеваний;
– гиперхолестеринемия, гипертриглицеридемия;
– привычно низкая физическая активность (ходьба или другая динамическая физическая нагрузка менее 30 минут в день или менее 3 часов в неделю);
– женщины, родившие ребенка с массой >4 кг или имевшие диагноз гестационный СД;
– женщины с синдромом поликистозных яичников [10].
Все лица, имеющие 1 и более из перечисленных факторов риска, нуждаются в ежегодном тестировании. Эксперты в области диабетологии ежегодно обновляют рекомендации по стандартам диабетологической помощи.
В 2022 году внесены изменения в определение факторов риска, которые включают необходимость ежегодного тестирования:
– при ИМТ более 25 кг/м2 и концентрации холестерина липопротеинов высокой плотности <0,90 ммоль/л;
– всем женщинам, у которых был гестационный диабет, независимо от массы тела новорожденного, – пожизненно;
– лица с диагнозом СПИД.
Для всех пациентов ежегодное тестирование должно начинаться с 35 лет, независимо от массы тела. В зависимости от начального результата и статуса риска тестирование в дальнейшем рекомендуется проводить минимум 1 раз в 3 года (или чаще) [11]. Снижение возраста для начала тестирования обусловлено «омоложением» СД2 и актуальностью превентивных мероприятий у этой категории пациентов.
Некоторые организации выделяют понятие «модифицируемых факторов риска», включающих наряду с ожирением и избыточной массой тела окружность талии >94 см у мужчин и >80 см у женщин, нездоровый паттерн питания, недостаточную физическую активность, плохой сон, курение, артериальную гипертензию и метаболический синдром, использование лекарственных средств, повышающих гликемию, включая глюкокортикоиды [12]. В период эпохи пандемии COVID-19 и значимого увеличения частоты употребления глюкокортикоидов имеет смысл учитывать этот фактор риска.
Какие методы могут быть использованы для диагностики предиабета?
Поскольку предиабет не характеризуется выраженной гипергликемией, «большие» симптомы СД – полиурия, полидипсия, похудание – не проявляются и диагноз не устанавливается на основании анамнеза и осмотра. Верификация диагноза может быть проведена только по результатам оценки лабораторных исследований (ОГТТ и/или HbA1c) и при исключении манифестного СД. Общепринятые рекомендации включают проведение лабораторных определений концентрации глюкозы в крови (натощак, или при проведении ОГГТ) и/или HbA1c. Диагностические критерии СД и других нарушений гликемии (ВОЗ, 1999–2013) приведены в таблице 1.
Таблица 1. Диагностические критерии СД и других нарушений гликемии
|
Показатель
|
Норма
|
Предиабет
|
СД
|
|
Гликемия, ммоль\л
|
натощак, цельная капиллярная кровь
|
<5,6
|
> 5,6 < 6,1
Нарушение гликемии натощак
|
> 6,1
|
|
натощак, плазма венозной крови
|
< 6,1
|
> 6,1 <7,0
|
>7,0
|
|
через 2 часа после нагрузки 75 г глюкозы (цельная капиллярная кровь, плазма венозной крови)
|
< 7,8
|
>7,8 < 11,1
Нарушение толерантности к глюкозе
|
>11,0
|
|
НbА1с, %
|
цельная кровь
|
5,7
|
>5,7< 6,5
|
>6,5
|
Диагноз манифестного СД устанавливается на основании сочетания двух лабораторных показателей, соответствующих диагностическим критериям СД, и только при исключении СД2 может быть верифицирован предиабет. HbA1c не используется в качестве диагностического критерия при наличии анемии, гемоглобинопатии, во II и III триместрах беременности, при проведении гемодиализа, недавней кровопотере или переливании крови, лечении эритропоэтином. Кроме того, тест на HbA1c необходимо проводить с использованием сертифицированного метода, который стандартизован в соответствии с исследованием DiabetesControlComplicationTrial (этому требованию соответствуют далеко не все используемые методики).
ОГТТ не проводится на фоне острых заболеваний, кратковременного приема лекарственных средств, повышающих уровень гликемии (глюкокортикоиды, тиреоидные гормоны, тиазидные диуретики, бета-адреноблокаторы); при диагностированном СД или выявленной тощаковой гликемии более 7,0 ммоль/л или случайной гипергликемии более 11,1 ммоль/л. Облигатное условие для проведения ОГТТ – потребление углеводов не менее 150 г/сутки) в течение 3 дней до теста.
При выявлении гипергликемии на фоне критического состояния, обусловленного различными интеркуррентными заболеваниями (COVID-19, инфаркт миокарда, острое нарушение мозгового кровообращения, травмы и т.д.), необходимо дифференцировать стрессовую гипергликемию (гипергликемия критического состояния). Для установления диагноза в случае впервые выявленной гипергликемии при экстренной госпитализации для этой цели необходимо оценить HbA1c.
Предиабет – гетерогенное состояние и может быть представлено нарушением толератности к глюкозе (НТГ) или нарушением гликемии натощак по данным ОГТТ или предиабетом, устанавливаемым по результатам тестирования НbA1c.
Международная статистическая классификация болезней и проблем, связанных со здоровьем десятого пересмотра (МКБ-10), разработанная в 1989 году и принятая ВОЗ в 1990 году, включает в рубрикациях из всех состояний предиабета только НТГ (R-73.0). В принятой ВОЗ МКБ-11, переход на которую планируется с 2022 года, в разделе «Заболевания эндокринной системы, расстройства питания и нарушения обмена веществ/Эндокринные заболевания»имеются рубрики 5A40 – промежуточные гипергликемии и 5A4Z – нарушения регуляции глюкозы и внутренней секреции поджелудочной железы, неуточненные, в которые может быть включен предиабет в любом его проявлении.
Какие меры должны быть приняты после установления предиабета?
Очевидно, что цель ведения пациентов с предиабетом – предупреждение его эволюции в манифестный СД, то есть регрессия к нормальной толерантности и, как следствие – минимизация последующих рисков развития сердечно-сосудистых заболеваний и микрососудистых осложнений.
Многочисленные исследования продемонстрировали эффективность в снижении относительного риска эволюции предиабета в манифестный СД при использовании модификации образа жизни (МОЖ), направленной на снижение массы тела и включающей изменение питания и физической активности (табл. 2) [13–18].
Таблица 2. Модификация образа жизни
|
Исследование
|
Число объектов
|
Длительность воздействия (годы)
|
Частота СД в группе контроля (%/год)
|
Снижение относительного риска (%)
|
|
Исследование Malmo [1]
|
217
|
5
|
5,6
|
63
|
|
Исследование Da Quing [2]
|
577
|
6
|
15,7
|
41
|
|
DPS исследование [3]
|
522
|
3,2
|
7,8
|
58
|
|
DPP исследование [4]
|
2161
|
2,8
|
11,0
|
58
|
|
Китайское исследование [5]
|
145
|
3,0
|
11,6
|
33
|
|
Индийское исследование IDPP [6]
|
269
|
2,5
|
18,3
|
29
|
Также были проведены исследования по оценке медикаментозной интервенции с использованием метформина, блокатора ?-глюкозидазы акарбозы, тиазолидиндионов (троглитазон, росиглитазон), ингибитора липаз орлистата, ингибитора дипептидил-пептидазы-4 ситаглиптина, ингибиторов натриевого котранспорта глюкозы 2, андрогенов, заместительной менопаузальной терапии, ингибиторов ангиотензинпревращающего фермента, блокаторов ангиотензина II, продемонстрировавшие их эффективность, но не превосходящую МОЖ [19–27].
Выбор лекарственной интервенции при предиабете лимитирован, с одной стороны, сравнительно невысокой, эффективностью МОЖ, с другой стороны – доказанными негативными влияниями на здоровье (троглитазон, росиглитазон), и, наконец, необходимостью наличия строгих показаний и исключения противопоказаний при назначении лекарственных средств (андрогены, эстрогены, прогестины и др.). Лимитирующим фактором также можно назвать стоимость лекарственных средств.
В обсервационном исследовании по профилактике диабета Da Qing (540 участников, 6-летнее исследование по МОЖ у людей с НТГ) с последующим разделением на группы пациентов с регрессией до нормальной толерантности к глюкозе и сохранением НТГ и/или прогрессией в СД2, пациенты наблюдались в течение 24 лет с проведением сравнения показателей заболеваемости и риска развития кардиоваскулярной патологии и микрососудистых осложнений. Полученные результаты свидетельствуют о том, что лица, достигшие нормализации толерантности к глюкозе, впоследствии имели значительно более низкие показатели сердечно-сосудистых и микрососудистых заболеваний, чем те, у кого развился диабет. Частота сердечно-сосудистых заболеваний в группе с нормализацией толерантности к глюкозе снизилась на 37% (ОР 0,63; 95% ДИ 0,47–0,85), а средняя задержка начала заболевания составила 7,45 года (95% ДИ 1,91–12,99), а частота развития микрососудистых заболеваний снизилась на 66% (ОР 0,34; 95% ДИ 0,20–0,56) с медианой задержки на 18,66 года (95% ДИ 6,08–31,24) (рис. 3) [4]. Аналогичные результаты получены в другом исследовании, выявившем снижение риска смертности от всех причин, кардиоваскулярных событий, инфаркта миокарда и инсульта у лиц с нормогликемией [28].
При установлении предиабета на начальном этапе рекомендуется программа МОЖ для достижения и поддержания 7-процентной потери начальной массы тела в течение 6 месяцев и увеличения физической активности средней интенсивности (например, быстрая ходьба) по крайней мере, до 150 минут в неделю. Первоначальная цель снижения веса на 7% была выбрана потому, что ее можно было сравнительно легко достичь и поддерживать (рекомендуемый темп потери веса – около 500 г в неделю). Цели по калориям определяются путем оценки ежедневного потребления калорий, необходимых для поддержания веса и вычитания 500–1000 калорий в день (в зависимости от начальной массы тела). Первоначально внимание должно было сосредоточено на снижении общего количества пищевых жиров с последующим сбалансированием рациона. Цель физической активности выбрана таким образом, чтобы затраты на физическую активность составляли не менее 700 ккал в неделю (для удобства она описана как минимум 150 минут физической активности средней интенсивности в неделю, аналогичной по интенсивности быстрой ходьбе). Участникам было рекомендовано распределять свои занятия в течение недели с минимальной частотой три раза в неделю и не менее 10 минут на сеанс.
Сложность ведения пациентов с предиабетом, как правило, имеющих избыточную массу тела, заключается в необходимости пожизненного соблюдения мер по МОЖ и прекращением соблюдения рекомендаций. В реальной клинической практике 90,3% пациентов с избыточной массой тела не следуют рекомендациям по МОЖ [29]. В американском исследовании DPP (DiabetesPreventionProgram), цитированном выше, риск развития СД2 снизился на 58% в группе МОЖ и на 31% в группе метформина по сравнению с группой плацебо [30] (рис. 4). Оценка устойчивости полученных результатов в долгосрочной перспективе продемонстрировала, что через 10 и 15 лет оптимальные результаты по снижению массы тела были получены у пациентов в группе метформина [30, 31].
Мета-анализ 8 высококачественных исследований демонстрирует тенденцию к восстановлению веса по сравнению с исходным уровнем до лечения с течением времени (рис. 5) [32]. Этот факт инициировал рекомендацию по назначению медикаментозной интервенции, при этом признанной рекомендацией названо назначение метфромина.
Из перечисленных выше глюкозо-снижающих препаратов рекомендован метформин. Это обусловлено оценкой соотношения «эффективность – стоимость». Метформин, наряду с уменьшением проявлений инсулинорезистетности, лежащей в основе развития предиабета, снижает глюконеогенез в печени, противодействует глюкагон-опосредованной передаче сигналов в печени и усиливает поглощение глюкозы скелетными мышцами, задействует множественные механизмы васкулярной протекции, он не вызывает гипогликемий, способствует снижению массы тела, доступен по стоимости.
Эффективность метформина подтвердил мета-анализ 32 клинических исследований, в котором показано снижение риска развития СД2 на 27% при использовании метформина и на 38% при комбинации МОЖ и метформина у пациентов с предиабетом [33]. При этом использование метформина, по данным мета-анализа 40 исследований с участием более 1 000 000 пациентов с ишемической болезнью сердца, было ассоциировано со снижением общей и сердечно-сосудистой смертности и риска развития неблагоприятных сердечно-сосудистых событий [34].
Приведенные факты определили актуальность использования метформина при выявлении предиабета [11].
Терапия метформином для профилактики СД2 должна быть рекомендована пациентам с предиабетом, особенно в возрасте 25–59 лет с ИМТ ≥35 кг/м2, и нарушением гликемии натощак или НbA1c (≥6,0%), и женщинам с предшествующим гестационным сахарным диабетом. В таких случаях, как правило, рекомендуется старт с минимальной дозы метформина (500 мг) вечером во время или после ужина с постепенным увеличением дозы до 850 мг 2 раза в день. Есть мнение, что назначение метформина в дозе 250 мг 3 раза в сутки оказывает превентивный эффект на развитие СД2 [35]. Выбор дозы метформина должен основываться на исходной массе тела пациента.
В настоящее время доказано, что при длительном приеме метформина может возникать дефицит витамина B12, поэтому следует рассмотреть возможность периодического измерения уровня витамина B12 у пациентов, принимающих метформин, особенно при наличии анемии или периферической невропатии. Для предупреждения развития дефицита витамина В12 могут быть использованы добавки, содержащие витамин В12, польза которого при СД не ограничивается только прямым влиянием на анемию и невропатию, но включает также влияние на центральную нервную систему (снижение риска депрессий и когнитивного дефицита). Многочисленными исследованиями доказана сравнительная эффективность орального и парентерального пути поступления в организм витамина В12, что позволяет рекомендовать использование более простого для пациента способа. Рекомендуемые дозы В12 для пациентов, длительно получающих метформин в дозе 2000 мг/сутки: орально или внутримышечно 1000 мкг/сутки или в течение недели, затем в раз в неделю в течение 4–8 недель и далее, 1 раз в месяц в течение всей жизни [36]. Приведенный режим дозирования не требует мониторинга, но может быть адаптирован к реальной ситуации.
Вопрос о возможности приема метформина в период и при развитии COVID-19 имеет однозначный ответ. Прием метформина ассоциирован со снижением смертности, особенно у женщин (рис. 6). При этом метформин достоверно снижает прогрессию COVID-19, обеспечивая уменьшение уровней СРБ, интерлекина-6, ферритина, но утяжеление состояния и развитие легочной и/или полиорганной недостаточности является противопоказанием для использования метформина [37, 38].
При использовании метформина возможно развитие нежелательных явлений, чаще всего со стороны желудочно-кишечного тракта (боли в животе, тошнота, диарея, рвота), которые проявляются в первые дни приема лекарственного средства и могут быть минимизированы при однократном использовании в вечернее время, постепенном увеличении суточной дозы. В качестве наиболее эффективной стратегии может быть использован метформин пролонгированного действия с замедленным высвобождением лекарственного средства, доступный в Республике Беларусь. В нескольких исследованиях доказана эффективность пролонгированного метформина (исследования проведены с использованием препарата Глюкофаж® Лонг) при предиабете [39]. Преимущества форм метформина с замедленным высвобождением включают наряду с удобством применения и оптимизацией комплаентности, лучшую переносимость при сравнимой и улучшенной эффективности [40, 41]. G. Derosa и соавт. считают, что метформин замедленного высвобождения более эффективен (в сравнении с обычным метформином) в улучшении гликометаболического контроля, липидного профиля и уровней некоторых адипоцитокинов при СД2 [42].
Предиабет связан с повышенным сердечно-сосудистым риском, поэтому всем пациентам рекомендуется оценка кардиоваскулярного риска и лечение факторов риска возникновения сердечно-сосудистых заболеваний. Наиболее частые состояния, ассоциированные с предиабетом, включают артериальную гипертензию и дислипидемию.
Снижение АД – эффективная стратегия профилактики СД2. Ингибиторы ангиотензинпревращающего фермента и блокаторы рецепторов ангиотензина II в отличие, например, от ?-блокаторов, наряду с прямым влиянием на кардиоваскулярные риски, обеспечивают снижение риска развития СД2 (рис. 7) [42].
Использование статинов, наоборот, ассоциировано с некоторым повышением риска развития СД2. Тем не менее, кардиопротективный эффект превосходит влияние на развитие СД2: на 1 впервые выявленный случай СД приходится -5,5 случаев кардиоваскулярной смерти, что определяет необходимость использования статинов у пациентов с предиабетом при наличии дислипидемии.
Согласно результатам исследования, проведенного в США, каждый пятый взрослый, участвовавший в Национальном обследовании здоровья и питания (NHANES) за 2017–2018 годы, использовал лекарственные средства, прием которых ассоциирован с усугублением риска развития ожирения («obesogenic»). Важным ограничением этого исследования является то, что нет единого списка лекарств, вызывающих ожирение, тем не менее, отмечено, что наиболее распространенными препаратами, вызывающими ожирение, были ?-блокаторы (9,8%) и гипогликемизирующие препараты (включая, в первую очередь, производные сульфонилмочевины и инсулин) (5,7%). Нейролептики были наименее часто назначаемыми препаратами, вызывающими ожирение, только у 1% пациентов [43].
В заключение приводим результаты исследования LOOK AHEARD, название которого в вольном переводе «Взгляд в будущее», определяет актуальность превентивных мер, направленных на устойчивую потерю веса с помощью вмешательства в образ жизни для предупреждения развития сердечно-сосудистых заболеваний, указывая на связь между величиной потери веса и степенью снижения кардиоваскулярного риска [44].
Излечим ли СД2 и предиабет?
Согласно объединенному консенсусу по терминологии American Diabetes Association, the Endocrine Society, the European Association for the Study of Diabetes, and Diabetes UK термин «ремиссия» следует использовать для описания устойчивого улучшения обмена веществ при СД2, так как он не излечивается. Критерием ремиссии СД2 определен уровень НbА1с <6,5% без лечения в течение не менее 3 месяцев [45]. Рекомендации по критериям ремиссии предиабета отсутствуют, по аналогии с оценкой ремиссии СД2, можно считать ремиссией предиабета нормальные значения НbА1с <5,7%, наблюдаемые в течение 3 месяцев.
Наиболее эффективным методом достижения ремиссии СД2 является метаболическая хирургия, эффекты которой в значительной степени опосредованы снижением потребления калорий и потерей веса [46]. При этом предиктором ремиссии была определена малая длительность заболевания, сравнительно невысокий уровень HbA1c, интенсивность лечения СД при меньшей степени ожирения.
Л И Т Е Р А Т У Р А
1. IDF Diabetes Atlas 2021 – 10th edition www:diabetesatlas.ogr
2. Timmis A., Vardas P., Townsend N., et al. Atlas Writing Group, European Society of Cardiology, European Society of Cardiology: cardiovascular disease statistics 2021 // European Heart Journal. – 2022. – Vol.4, N8. – P.716–799.
3. Knowler W.C., Barrett-Connor E., Fowler S.E., et al. // NEJM. – 2002. – Vol.346. – P.393–403.
4. Lindström J., Ilanne-Parikka P., Peltonen M., et al. // Lancet. – 2006. – Vol.368. – P.1673–1679.
5. Chen Y., Zhang P., Wang J., et al. // Diabetologia. – 2021. – Vol.64. – P.1279–1287.
6. Gong Q., Zhang P., Wang J., et al. // Lancet Diabetes Endocrinol. – 2019. – Vol.7, N6. – P.452–461.
7. Tseng E., Durkin N., Clark J.M., et al. // J GEN INTERN MED. – 2022. https://doi.org/10.1007/s11606-022-07412-9
8. Tang O., Matsushita K., Coresh J., et al. // Diabetes Care. – 2020. – Vol.43, N2. – P.382–388.
9. Lindstro?m J., Tuomilehto J. // Diabetes Care. – 2003. – Vol.26, N3. – P.725–731.
10. Постановление Министерства здравоохранения Республики Беларусь от 21.06.2021 №85 Об утверждении клинических протоколов. Клинический протокол «Диагностика и лечение пациентов с сахарным диабетом (взрослое население)».
11. American Diabetes Association Professional Practice Committee; 3. Prevention or Delay of Type 2 Diabetes and Associated Comorbidities: Standards of Medical Care in Diabetes-2022 // Diabetes Care. – 2022. – Vol.45 (Suppl.1). – S39–S45.
12. Bell K., Shaw J.E., Maple-Brown L., et al. A position statement on screening and management of prediabetes in adults in primary care in Australia. // Diabetes Res Clin Pract. – 2020. – Vol.164. – P.108188.
13. Eriksson K.F., Lindgarde F. // Diabetologia. – 1991. – Vol.34. – P.891?898.
14. Pan X.-R., Li G.-W., Hu Y.-H., et al. // Diabetes Care. – 1997. – Vol.20, N4. – P.537–544.
15. Tuomilehto J., Lindström J., Eriksson J.G., et al. // NEJM. – 2001. – Vol.344, N18. – P.1343?1350.
16. The Diabetes Prevention Program Research Group. The Diabetes Prevention Program. Design and methods for a clinical trial in the prevention of type 2 diabetes // Diabetes Care. – 1999. – Vol.22, N8. – P.623–634.
17. Kosaka K., Noda M., Kuzuya T. // Diabetes Res Clin Pract. – 2005. – Vol.67. – P.152–162.
18. Ramachandran A., Snehalatha C., Mary S., et al. // Diabetologia. – 2006. – Vol.49. – P.289–297.
19. Buchanan T.A., Xiang A.H., Peters R.K., et al. // Diabetes. – 2002. – Vol.51. – P.2796–2803.
20. DREAM (Diabetes Reduction Assessment with Ramipril and Rosiglitazone Medication) Trial Investigators. Effect of rosiglitazone on the frequency of diabetes in patients with impaired glucose tolerance or impaired fasting glucose: a randomised controlled trial // Lancet. – 2006. – Vol.368. – P.1096–1105.
21. Chiasson J.L., Gomis R., Hanefeld M., et al. // Lancet. – 2002. – Vol.359. – P.2072–2077.
22. Torgerson J.S., Hauptman J., Boldrin M.N., et al. // Diabetes Care. – 2004. – Vol.27. – P.155–161.
23. Bosch J., et al. // NEJM. – 2006. – Vol.355. – P.1551–1562.
24. de Lauzon-Guillain B., Fournier A., Fabre A., et al. // Diabetologia. – 2009. – Vol.52, N10. – P.2092–2100.
25. Naidoo P., Wing J., Rambiritch V. // JMIR Res Protoc. – 2016. – Vol.5, N3. – e145.
26. Yassin A., Haider A., Haider K.S., et al. // Diabetes Care. – 2019. – Vol.42, N6. – P.1104–1111.
27. Rossing P., Inzucchi S.E., Vart P., et al. // Lancet Diabet Еndocrinol. – 2021. https://doi.org/10.1016/S2213-8587(21)00295-3
28. Liu X., Wu S., Song Q., Wang X. // J Am Heart Assoc. – 2021. – Vol.10, N3. – e019045.
29. Alefishat E.A., Abu Farha R.K., Al-Debei M.M. // Med Princ Pract. – 2017. – Vol.26, N2. – P.157?163.
30. Knowler W.C., Fowler S.E., et al. // Lancet. – 2009. – Vol.374, N9702. – P.1677?1686.
31. Diabetes Prevention Program Research Group. Long-term effects of lifestyle intervention or metformin on diabetes development and microvascular complications over 15-year follow-up: The Diabetes Prevention Program Outcomes Study // Lancet Diabetes Endocrinol. – 2015. – Vol.3, N11. – P.866?875.
32. Nordmo M., Danielsen Y.S., Nordmo M. // Obesity Rew. – 2020. https://doi.org/10.1111/obr.12949
33. Sheng Z., Cao J.Y., Pang Y.C., et al. // Front Endocrinol (Lausanne). – 2019. – Vol.10. – P.455. doi: 10.3389/fendo.2019.00455
34. Han Y., Xie H., Liu Y., et al. // Cardiovasc Diabetol. – 2019. – Vol.18. – P.96. https://doi.org/10.1186/s12933-019-0900-7
35. Lily M., Godwin M. // Can Fam Physician. – 2009. – Vol.55, N4. – P.363–369.
36. Herbert L., Ribar A., Mitchell S., Phillips C. // J Am Assoc Nurse Pract. – 2019. – Vol.33, N2. – P.174–180. doi: 10.1097/JXX.0000000000000312
37. Lalau J.D., Al-Salameh A., Hadjadj S., et al. // Diabetes Metab. – 2021. – Vol.47, N5. – P.101216. doi: 10.1016/j.diabet.2020.101216
38. Crouse A.B., Grimes T., Li P., Might M., et al. // Front Endocrinol (Lausanne). – 2021. – Vol.11. – P.600439. doi:10.3389/fendo.2020.600439
39. Hostalek U., Zilahi Z. // Curr Med Res Opin. – 2020. – Vol.36, N3. – Vol.397–401.
40. Blonde L., Dailey G.E., Jabbour S.A., et al. // Curr Med Res Opin. – 2004. – Vol.20, N4. – P.565?572.
41. Timmins P., Donahue S., Meeker J., Marathe P. // Clin Pharmacokinet. – 2005. – Vol.44, N7. – P.721?729.
42. Nazarzadeh M., Bidel Z., Canoy D., et al. // Lancet. – 2021. – Vol.398. – P.1803–1810.
43. Hales С.M., Gu Q.,. Ogden C.L. Use of prescription medications associated with weight gain among US adults, 1999-2018: A nationally representative survey https://doi.org/10.1002/oby.23299
44. Gregg E.W., Jakicic J.M., Blackburn G., et al. // Lancet Diabetes Endocrinol. – 2016. – Vol.4, N11. – P.913–921.
45. Fried M., Yumuk V., Oppert J., et al. // Obes Surg. – 2014. – Vol.24, N1. – P.42–55.
46. Meerasa A., Dash S. // Diabetes Care. – 2022. – Vol.45, N1. – P.28–30.
Медицинские новости. – 2022. – №12. – С. 16-21.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.