Внимание! Статья адресована врачам-специалистам
Huseynova I.I.
Azerbaijan Medical University,Baku
The value of abdominal oximetry
in the diagnosis of necrotizing enterocolitis in preterm infants
Резюме. Определено раннее диагностическое значение абдоминальной оксиметрии у недоношенных детей с некротизирующим энтероколитом (НЭК). В исследование включено 88 недоношенных детей, поступивших в отделение реанимации и интенсивной терапии новорожденных с подозрением на НЭК. Было установлено, что показатели абдоминальной оксиметрии у недоношенных детей с подозрением на НЭК обладают высокой информативностью в ранней диагностике НЭК. Среди всех вышеуказанных показателей для подтверждения НЭК повышенная sFTOE на фоне низкого уровня rsSO2, маркера ишемии кишечника, является предиктором развития и осложнений НЭК у недоношенных детей.
Keywords: недоношенные дети, некротизирующий энтероколит, абдоминальная оксиметрия.
Медицинские новости. – 2023. – №2. – С. 62–64.
Summary. The aim of our study was to determine the early diagnostic value of abdominal oximetry in preterm infants with necrotizing enterocolitis (NEC). The study included 88 premature infants admitted to the neonatal intensive care unit with suspected NEC. It was found that the indicators of abdominal oximetry in preterm infants with suspected NEC are highly informative in the early diagnosis of NEC. To confirm NEC, among all the above indicators, elevated sFTOE against the background of low levels of rsSO2, a marker of intestinal ischemia, is a predictor of the development and complications of NEC in preterm infants.
Keywords: premature, necrotizing enterocolitis, abdominal oximetry.
Meditsinskie novosti. – 2023. – N2. – P. 62–64.
Некротизирующий энтероколит (НЭК) – тяжелое гетерогенное заболевание мультифакторной этиологии. НЭК (МКБ-10; P77) встречается в 2–16% случаев в неонатальном периоде, 80% из которых составляют недоношенные с малой массой тела [1–3].
Летальность от НЭК составляет 28–54% детей, родившихся недоношенными, с синдромом задержки внутриутробного развития [4, 5]. После оперативного вмешательства у детей с массой тела менее 1500 г этот показатель составляет 60% [6, 7]. По этой причине НЭК называют «болезнью выживших недоношенных». Среди детей с летальным исходом перфоративный перитонит встречается в 80% случаев, полиорганная недостаточность – в 63,3%, сепсис – в 45% случаев [8, 9]. Риск развития неблагоприятного исхода возрастает при наличии у детей с НЭК патологии бронхолегочной системы и врожденных пороков сердца [10, 11].
Время манифестации заболевания продолжается до 3 месяцев после рождения и имеет широкие вариации. Ранняя манифестация НЭК характеризуется острым течением в первые 4–7 дней.
Ограниченность воспалительного процесса и выраженное течение местных реакций чаще характерно для морфофункционально зрелых детей. Для детей с очень малым сроком гестации характерно позднее начало заболевания – на 2–3-й неделе жизни, торпидное течение и системная симптоматика. Подозрение на манифестацию НЭК у детей группы риска возникает при наличии одного неблагоприятного системного симптома и одного симптома со стороны желудочно-кишечного тракта [9, 12]. В настоящее время не существует «золотого» маркера или предиктора этого серьезного заболевания. Диагноз подтверждается на основании динамической оценки многих клинических и лабораторных признаков. Основной причиной, затрудняющей диагностику НЭК в клинической практике, является отсутствие достоверной модели, отражающей патогенез НЭК, и разграничивающей различные фенотипические проявления поражения кишечника. Одним из основных недостатков клинической диагностики НЭК является неполноценность рентгенографии брюшной полости с точки зрения чувствительности и специфичности для выявления различных ее стадий. Хотя и установлена важность ультразвукового исследования брюшной полости для диагностики НЭК, использование этого метода ограничено [3, 11]. В последние годы в литературе появляются отдельные данные об информативности абдоминальной оксиметрии в диагностике НЭК [13–15].
Цель исследования – определить раннее диагностическое значение абдоминальной оксиметрии у недоношенных детей с НЭК.
Материалы и методы
В исследование включено 88 недоношенных детей, поступивших в отделение реанимации и интенсивной терапии новорожденных с подозрением на НЭК, гестационный возраст которых составил 26–36 недель, масса тела – 800–2560 грамм. Диагноз НЭК подтверждался на основании клинических, инструментальных и лабораторных данных. У всех больных наблюдались первые признаки НЭК, такие как абдоминальное напряжение, пищевая непереносимость, наличие крови в кале, болезненность живота при пальпации, вздутие живота, апноэ и т.д.
К критериям исключения относились: новорожденные с наследственными и хромосомными аномалиями; случаи отсутствия подозрения на НЭК в течение первых 3 недель.
В зависимости от срока гестации все обследованные были разделены на 4 группы: 1-я группа – 23 ребенка со сроком гестации менее 28 недель, 2-я группа – 39 детей в возрасте 28–30 недель, 3-я группа – 27 детей в возрасте 31–33 недель, в 4-ю группу вошли 29 детей в возрасте 34–36 недель.
У 29 обследованных детей был установлен диагноз НЭК (1-я группа) и у 59 – НЭК выявлен не был (2-я группа).
Абдоминальную или висцеральную оксиметрию (rsSO2) выполняли на фоне пульсоксиметрии (SpO2) с инфракрасной спектроскопией (somanetics INVOS 5100 Covidien, Medtronic, USA, 2006). Фракционную экстракцию кислорода в висцеральных тканях рассчитывали по формуле ; индекс висцеро-церебральной оксигнации рассчитывался по формуле SCOR (splanchnic-cerebro oxygenation ratio) = rsSO2/rcSO2.
Соматосенсор устанавливали в лобно-теменной области для церебральной оксиметрии и под пупком для абдоминальной оксиметрии. Исследование проводили в неонатальном периоде (раннем и позднем) путем регистрации средних значений каждые 30 минут в течение 2 часов. Показания без артефактов принимались как достоверные результаты.
Все полученные параметры и данные были собраны в таблицу Excel и обработаны с помощью программы IBM SPSS-20. Статистический анализ проводили с использованием непараметрического U-критерия Манна – Уитни и t-критерия Стьюдента. Значения считались статистически значимыми при р<0,05.
Результаты и обсуждение
Показатели церебральной и абдоминальной оксиметрии в зависимости от срока гестации у недоношенных новорожденных, поступивших в отделение НРИИТ с подозрением на НЭК, приведены в таблице и на рисунках 1, 2.
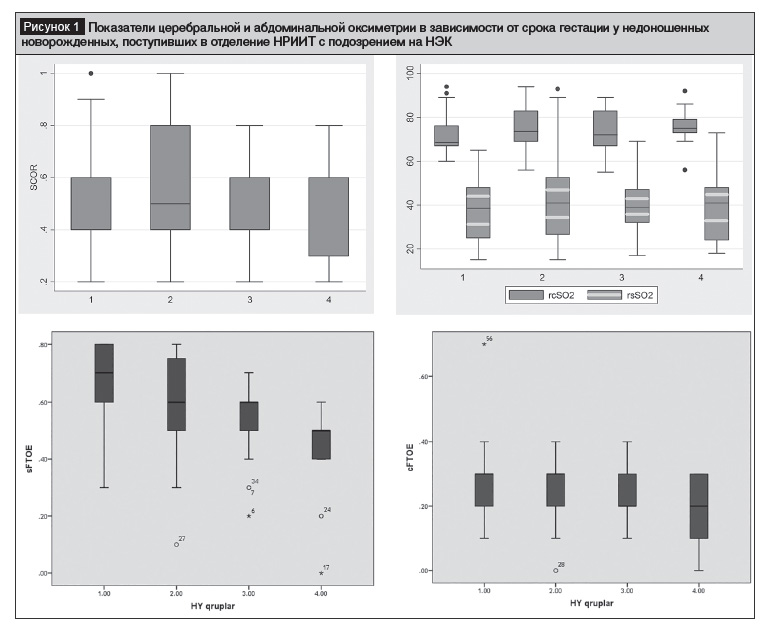
Как видно из данных таблицы, церебральная и абдоминальная регионарная оксигенация меняются в зависимости от гестационного возраста; эти изменения происходят в виде увеличения показателей rcSO2 и rsSO2 и снижения FTOE. При сравнении групп (I–III, II–IV) наблюдалось более выраженное изменение, увеличение более чем в 2 раза уровня О2 – насыщения висцеральных тканей – rsSO2. В отличие от последнего, уровень FTOE снижался с увеличением срока гестации, что свидетельствует о снижении фракционной экстракции кислорода, особенно тканями внутренних органов.
Также уровень SCOR увеличивался с увеличением срока гестации. Так, самый высокий уровень был выявлен у детей IV группы, что свидетельствует о более высоком уровне кишечной перфузии и метаболизма у детей этой группы по сравнению с детьми I группы.
Показатели церебральной и абдоминальной оксигенации (rcSO2, rsSO2, cFTOE, sFTOE, SCOR) в отдельных группах в зависимости от гестационного возраста также были представлены на диаграммах.
Из данных таблицы видно, что rcSO2 был выше в IV группе, показатели церебральной оксиметрии у детей I группы были значительно ниже, чем в других группах, и статистически достоверно отличались от показателей детей IV группы.
Таблица. Средние показатели (min-max) церебральной и абдоминальной оксиметрии у новорожденных в зависимости от гестационного возраста
|
Показатель оксиметрии
|
Группа
|
|
I
|
II
|
III
|
IV
|
|
rcSO2 %
|
71,5
(56–89)
|
74,5
(55–94)
|
74,4
(56–94)
|
78,4
(65–92)
|
|
cFTOE
|
0,295
(0,1–0,7)
|
0,250
(0,0–0,4)
|
0,243
(0,1–0,4)
|
0,200
(0,0–0,3)
|
|
rsSO2 %
|
28,68
(15,0–65)
|
38,42*
(17–89)
|
47,05*^
(26–78)
|
57,22*^
(38–93)
|
|
sFTOE
|
0,691
(0,30–0,80)
|
0,619
(0,10–0,80)
|
0,529*^ (0,20–0,70)
|
0,422*^ (0,0–0,60)
|
|
SCOR
|
0,409
(0,20–1,00)
|
0,514*
(0,20–1,00)
|
0,638*^ (0,30–1,00)
|
0,722*^ (0,50–1,00)
|
Примечание: * – достоверность показателей в сравнении с таковыми в I группе, p<0,05; ^ – в сравнении с показателями во II группе, p<0,05.
При изучении показателей абдоминальной оксиметрии было выявлено, что эти показатели в I группе были ниже, незначительно отличаясь от других групп. Эта разница между I группой и III и IV группами была статистически достоверной. Отмечалась статистически значимая разница между показателями sFTOE I и III, IV групп. Показатель SCOR во всех группах статистически достоверно отличался. По мере увеличения гестационного возраста отмечали увеличение SCOR, по показателям cFTOE не было статистических различий между группами. Таким образом, показатели оксиметрии улучшаются по мере увеличения гестационного возраста.
Изменение уровня SCOR в ранний период, с одной стороны, связано с нарушением церебральной ауторегуляции в результате гемодинамической нестабильности, с другой, – связанное с усилением перфузии крови в кишечнике вследствие воспаления, снижение rcSO2 и увеличение rsSO2.
В воспалительной фазе НЭК, на фоне усиления кровотока в кишечнике, определяется относительно высокий rsSO2. Такой показатель наблюдается как при первой, так и второй стадии НЭК по классификации Белла, поэтому не имеет дифференциально-диагностического значения.
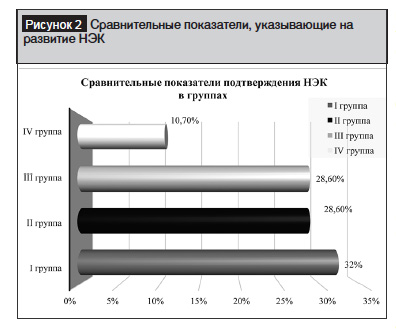
Подтверждение обнаружения НЭК в отдельных группах в зависимости от гестационного возраста представлено на диаграмме. Подтвержденный НЭК у недоношенных детей I группы встречался в 3 раза чаще, чем у детей IV группы.
Отсутствие различий в показателях sFTOE у недоношенных с подтвержденным НЭК и без НЭК предполагает, что баланс между доставкой и усвоением кислорода в кишечнике одинаков в обеих группах. Последнее характеризовалось по существенно не отличавшемуся в этих группах среднему показателю sFTOE.
Более низкий уровень sFTOE у детей с подтвержденным НЭК по сравнению с детьми без подтвержденного НЭК указывает на усиление перфузии и снижение усвоения кислорода у них. Более низкая sFTOE на ранней стадии НЭК, по-видимому, связана со снижением перфузии кишечника без каких-либо изменений в усвоении кислорода. Во время последующей третьей фазы снижаются как кишечная перфузия, так и усвоение кислорода. Представляет особый интерес комплексное изучение и анализ этих показателей при проспективных исследованиях.
Таким образом, показатели абдоминальной оксиметрии у недоношенных детей с подозрением на НЭК обладают высокой информативностью в ранней диагностике НЭК. Среди всех указанных показателей для подтверждения НЭК повышенная sFTOE на фоне низкого уровня rsSO2, маркера ишемии кишечника, является предиктором развития и осложнений НЭК у недоношенных детей.
Л И Т Е Р А Т У Р А
1. Гнедько Т.В. // Педиатрия. Восточная Европа. – 2015. – Т.2, №10. – С.24–31.
2. Никулина Е.Н., Елчина С.И., Липкова Ю.А., Липков С.В. // Мать и Дитя в Кузбаce. – 2017. – №3(70). – С.21–25.
3. Пыков М.И., Балашов В.В., Филиппова Е.А. и др. // Медицинский Совет. – 2019. – №2. – С.215–221.
4. Fitzgibbons S.C., Ching Y., Yu D., et al. // J. Pediatr. Surg. – 2009. – Vol.44. – P.1072–1076.
5. Battersby B., Santhaingan T., Costeloe K., et al. // Archives of Disease in Childhood: Fetal and Neonatal. – 2018. – Vol.103. – F282–F189.
6. Goswami Sribas, Sahai Mavjar // European Journal of Medical. – 2014. – Vol.4, N6. – P.215–225.
7. Есиркепова А.Д., Сейдинова Ш.М. // Вестник KазНMУ. – 2018. – №1. – С.134–136.
8. Patel A.L., Panogos P.G., Silvestri J.M. // Clinics in Perinatology. – 2017. – Vol.44. – P.683–700.
9. Nino D.F., Sodhi NI., Hackam DJ. // Nature Reviews Gastroenterelogy and Hepatology. – 2016. – Vol.13. – P.590.
10. Schat T.E., et al. // Early trem. Dev. – 2014. – Vol.90, N7. – P.371–375.
11. Staryszak J., Stopa J., Kucharska-Miasik J., et al. // Polih Journal of radiology. – 2015. – Vol.80. – P.1–9.
12. Zhang L.P., Lei P., Luo LJ., Dong W.B. // J. Matern Fetal Neonatol Med. – 2017. – №1–2. – P.1–6.
13. Beena G. Sood, Kathleen Mclaughlin, Josef Cortez. Near-infrared spectroscopy: Applications in neonates. Seminars in Fetal and Neonatal Medicine. – 2015. – N20. – P.164–172.
14. Bailey S.M., Hendricks-Munoz K.D., Mally P. // Transfusion. – 2012. – Vol.52, N2. – P.252–260.
15. Martin Van der Heide, et al. // Pediatrics Research. Doi.029/10-1038/s.41390-020-011.
Медицинские новости. – 2023. – №2. – С. 62-64.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.