Внимание! Статья адресована врачам-специалистам
Mammadova N.V., Orujоva P.A., Dunyamaliyeva H.U.
Azerbaijan Medical University,Baku
Prognostic value of blood count in cerebral hemorrhage
in preterm infants with asphyxia
Резюме. Изучена прогностическая значимость показателей периферической крови и эритропоэтина в первые сутки в развитии кровоизлияния у недоношенных детей, родившихся с асфиксией. У 46 детей, перенесших асфиксию, определяли анализ периферической крови в первые сутки и уровень эритропоэтина на 1–3-е сутки и динамику на 5–7-е сутки. Сравнение детей проведено в 2 группах: 12 детей с внутрижелудочковыми кровоизлияниями в мозг и 34 ребенка без кровоизлияния. Кровоизлияние в мозг определяли и классифицировали по результатам УЗИ на 3-й день жизни. В целом кровоизлияние I степени отмечено у 8 детей, II степени – у 2, III степени – у 2 детей.
Для предотвращения и снижения риска возникновения кровоизлияний у недоношенных детей целесообразно проводить подробные исследования показателей крови новорожденных, а также бороться с анемией у матерей.
Ключевые слова: недоношенные новорожденные, асфиксия, кровоизлияние, железодефицитная анемия, эритропоэтин, MCV.
Медицинские новости. – 2023. – №2. – С. 65–68.
Summary. Aim of the present study was to study the prognostic significance of peripheral blood parameters and erythropoietin (EPO) on the first day in the development of hemorrhage in babies born prematurely and exposed to asphyxia. In 46 asphyxiated babies, peripheral blood analysis on the first day and the level of EPO protein on 1–3 days and dynamics on 5–7 days were determined. Comparison of infants was made in 2 groups: 12 infants with cerebral ventricular hemorrhage and 34 infants without hemorrhage. Cerebral hemorrhage was determined and graded based on USM results on the 3rd day of life.
To prevent and reduce the risk of hemorrhage in premature babies, it is advisable to conduct detailed studies of blood counts of newborns, as well as to combat anemia in mothers.
Keywords: premature birth, asphyxia, hemorrhage, iron deficiency anemia, erythropoietin, MCV.
Meditsinskie novosti. – 2023. – N2. – P. 65–68.
Гипоксия и ишемия развивающейся мозговой ткани является одной из основных причин формирования гипоксически-ишемических энцефалопатий у новорожденных. Однако преобладание того или иного фактора в развитии патологии индивидуально [1–3].
Перинатальная гипоксия повышает проницаемость клеточной мембраны, ускоряет разрушение нейрональных и глиальных клеток в результате некроза и апоптоза. Кроме того, при перинатальной гипоксии происходит нарушение структурной целостности гематоэнцефалического барьера, а также кальциевого гемостаза. Попадание мозгового антигена в циркулирующий кровоток стимулирует синтез аутоцеребральных антител в иммунной системе [4].
При перинатальных энцефалопатиях эти функции могут нарушаться как в совокупности, так и по отдельности. Морфологический субстрат повреждения характеризуется преходящими нарушениями кровообращения в диэнцефально-гипоталамической области, а в тяжелых случаях – стойкими ишемическими нарушениями и кровоизлияниями [2].
Установлено, что нарушения, наблю-даемые в результате последствий асфиксии, особенно у недоношенных детей, вызывают ряд тяжелых осложнений, в том числе внутрижелудочковые кровоизлияния. У недоношенных детей с экстремально низкой массой тела при перинатальном поражении головного мозга развиваются тяжелые соматовегетативные расстройства – глубокое коматозное состояние, кардиальные и респираторные нарушения, гипо- и гипертермия, трофическая дисфункция. Кровоизлияниями другой локализации являются субэпендимальные кровоизлияния, развивающиеся в результате нарушения целостности мелких сосудов между хвостатым ядром и луковицей зрительного нерва, что сопровождается вегетативно-трофической дисфункцией [5–7].
Несмотря на высокие темпы развития детской гематологии в современных условиях, некоторые трудности все еще неизбежны. В частности, анемия, возникающая в перинатальном перио-де у детей с экстремально низкой массой тела при рождении, приводит к развитию множества осложнений [8–10].
Изменения в периферической крови находятся в центре внимания при изучении клинической картины различных патологических состояний и их дифференциальной диагностики у новорожденных, особенно недоношенных детей. Однако в литературе очень мало фактов, касающихся особенностей гематологических показателей у недоношенных новорожденных [11–13]. Тем не менее, очень важно анализировать эти данные в зависимости от перинатального фона, гестационного возраста (ГВ) и степени морфофункциональной незрелости.
Цель исследования – изучение прогностической значимости показателей периферической крови и эритропоэтина (ЭПО) в первые сутки в развитии кровоизлияния у недоношенных детей, перенесших асфиксию.
Материалы и методы
С этой целью у 46 детей, перенесших асфиксию, проводили анализ периферической крови и определяли уровень ЭПО на 1–3-и сутки и в динамике на 5–7-е сутки. Сравнение детей было проведено в 2 группах: 12 детей с кровоизлиянием в желудочки мозга и 34 ребенка без признаков кровоизлияния. Кровоизлияние в мозг определяли и классифицировали по результатам УЗИ на 3-й день жизни (Toshibа applio-400). В целом кровоизлияние I степени отмечено у 8 детей, II степени – у 2, III степени – у 2 детей. Анализ цифровых данных выполнен в программах Excel-2019 и SPSS-24.
Результаты и обсуждение
Частота встречаемости перинатальных факторов у обследованных новорожденных представлена в таблице 1.
Таблица 1. Анамнез беременности матерей новорожденных, виды респираторной терапии в раннем неонатальном периоде и частота патологии сердечно-сосудистой системы у обследованных
|
Показатель
|
С кровоизлиянием
|
Без кровоизлияния
|
p
|
|
Пол:
мальчики
девочки
|
5 (41,7%)
7 (58,3%)
|
17 (50%)
17 (50%)
|
0,742
|
|
Многоплодная беременность
|
3 (25%)
|
11 (32,4%)
|
0,729
|
|
Материнский анамнез:
анемия
преэклампсия
|
7 (58,3%)
6 (50%)
|
15 (44,1%)
21 (61,8%)
|
0,508
0,513
|
|
ЗВУР
|
0
|
4 (11,8%)
|
0,560
|
|
АПВ
|
10 (83,3%)
|
13 (38,2%)
|
0,017
|
|
СДППД
|
5 (41,7%)
|
22 (64,7%)
|
0,190
|
|
Сурфактант
|
5 (41,7%)
|
7 (20,6%)
|
0,250
|
|
ООО
|
8 (66,7%)
|
9 (26,5%)
|
0,019
|
|
ОАП
|
3 (25%)
|
5 (14,7%)
|
0,412
|
Примечание: ЗВУР – задержка внутриутробного развития, АПВ – адаптивная поддерживающая вентиляция, СДППД – спонтанное дыхание с постоянным положительным давлением, ООО – открытое овальное окно, ОАП – открытый артериальный проток.
Хотя частота развития материнской анемии у новорожденных с кровоизлияниями была выше, она статистически не отличалась от группы новорожденных без кровоизлияний. Среди детей с кровоизлияниями преобладали девочки.
В связи с более тяжелым течением респираторного дистресс-синдрома (РДС) у детей раннего возраста с кровоизлияниями чаще выполнялась искусственная вентиляция легких (p<0,05). Терапия сурфактантом также чаще использовалась у новорожденных с кровоизлияниями, но межгрупповых статистических различий не выявлялось. Открытое овальное окно чаще отмечалась у новорожденных с кровоизлияниями (p<0,05), что, вероятно, было обусловлено продолжением фетального кровообращения в связи с тем, что дети подвергались более частому воздействию АПВ. Показатели периферической крови отражены в таблице 2.
Таблица 2. Сравнительная характеристика показателей периферической крови, уровня железа (Fe), трансферрина и ЭПО в первые сутки и в динамике у обследованных новорожденных
|
Показатель
|
Среднее значение (М)
|
Стандартное отклонение (?)
|
Стандартная ошибка (m)
|
95% доверительный интервал
|
Мин
|
Макс
|
p
|
|
нижний предел
|
верхний предел
|
|
ГВ
|
0
|
32.97
|
1.98
|
.34
|
32.28
|
33.66
|
27.00
|
36.00
|
0,006
|
|
1
|
31.16
|
2.08
|
.60
|
29.84
|
32.48
|
29.00
|
36.00
|
|
Всего
|
32.50
|
2.14
|
.32
|
31.86
|
33.13
|
27.00
|
36.00
|
|
Апгар (1 день)
|
0
|
3.76
|
1.10
|
.19
|
3.38
|
4.14
|
1.00
|
5.00
|
0,990
|
|
1
|
3.83
|
.58
|
.17
|
3.46
|
4.20
|
3.00
|
5.00
|
|
Всего
|
3.78
|
.99
|
.15
|
3.48
|
4.07
|
1.00
|
5.00
|
|
Апгар (5 день)
|
0
|
5.55
|
.70
|
.12
|
5.31
|
5.80
|
3.00
|
6.00
|
0,04
|
|
1
|
5.25
|
.45
|
.13
|
4.96
|
5.53
|
5.00
|
6.00
|
|
Всего
|
5.47
|
.66
|
.10
|
5.28
|
5.67
|
3.00
|
6.00
|
|
Госпититализация
|
0
|
13.20
|
6.26
|
1.07
|
11.02
|
15.39
|
4.00
|
28.00
|
0,333
|
|
1
|
13.25
|
7.64
|
2.21
|
8.39
|
18.10
|
1.00
|
21.00
|
|
Всего
|
13.22
|
6.56
|
.97
|
11.26
|
15.16
|
1.00
|
28.00
|
|
Масса, г
|
0
|
1775.29
|
404.35
|
69.35
|
1634.21
|
1916.37
|
1000.00
|
3100.00
|
0,812
|
|
1
|
1606.66
|
388.80
|
112.24
|
1359.63
|
1853.70
|
1050.00
|
2200.00
|
|
Всего
|
1731.30
|
403.06
|
59.43
|
1611.61
|
1850.99
|
1000.00
|
3100.00
|
|
Эритроциты,
М/mm2
|
0
|
4.30
|
.97
|
.17
|
3.96
|
4.63
|
2.60
|
5.99
|
0,416
|
|
1
|
4.03
|
.98
|
.28
|
3.40
|
4.65
|
2.42
|
5.10
|
|
Всего
|
4.23
|
.98
|
.14
|
3.94
|
4.51
|
2.42
|
5.99
|
|
Hb, g/dL
|
0
|
14.08
|
3.93
|
.67
|
12.70
|
15.44
|
8.80
|
22.00
|
0,196
|
|
1
|
12.15
|
2.78
|
.80
|
10.38
|
13.91
|
8.80
|
18.00
|
|
Всего
|
13.57
|
3.73
|
.55
|
12.46
|
14.68
|
8.80
|
22.00
|
|
MCV, fL
|
0
|
105.65
|
7.73
|
1.32
|
102.95
|
108.34
|
90.00
|
118.00
|
0,005
|
|
1
|
92.33
|
14.47
|
4.18
|
83.14
|
101.52
|
73.00
|
109.00
|
|
Всего
|
102.17
|
11.40
|
1.68
|
98.78
|
105.55
|
73.00
|
118.00
|
|
Лейкоциты,
109/L
|
0
|
12.54
|
6.24
|
1.07
|
10.36
|
14.72
|
5.00
|
32.00
|
0,556
|
|
1
|
11.39
|
4.11
|
1.19
|
8.77
|
14.00
|
5.90
|
22.00
|
|
Всего
|
12.24
|
5.74
|
.85
|
10.53
|
13.94
|
5.00
|
32.00
|
|
Тромбоциты, 109/L
|
0
|
207.58
|
102.40
|
17.56
|
171.86
|
243.31
|
37.00
|
524.00
|
0,079
|
|
1
|
147.67
|
89.07
|
25.71
|
91.07
|
204.26
|
37.00
|
319.00
|
|
Всего
|
191.96
|
101.67
|
14.99
|
161.76
|
222.14
|
37.00
|
524.00
|
|
Нейтрофилы, %
|
0
|
45.76
|
16.99
|
2.91
|
39.83
|
51.69
|
10.00
|
77.00
|
0,738
|
|
1
|
43.92
|
14.18
|
4.09
|
34.90
|
52.92
|
26.00
|
73.00
|
|
Всего
|
45.28
|
16.17
|
2.38
|
40.48
|
50.08
|
10.00
|
77.00
|
|
Лимфоциты, %
|
0
|
45.50
|
17.18
|
2.95
|
39.50
|
51.49
|
13.00
|
82.00
|
0,415
|
|
1
|
41.00
|
13.25
|
3.82
|
32.58
|
49.41
|
15.00
|
58.00
|
|
Всего
|
44.33
|
16.23
|
2.39
|
39.50
|
49.14
|
13.00
|
82.00
|
|
ЭПО
1 день
|
0
|
3.54
|
2.48
|
.42
|
2.66
|
4.40
|
1.00
|
14.60
|
0,068
|
|
1
|
8.20
|
11.02
|
3.18
|
1.19
|
15.20
|
1.17
|
41.10
|
|
Всего
|
4.75
|
6.20
|
.91
|
2.91
|
6.59
|
1.00
|
41.10
|
|
ЭПО 5–7 день
|
0
|
12.99
|
4.90
|
.84
|
11.27
|
14.69
|
5.60
|
22.00
|
0,045
|
|
1
|
16.07
|
9.82
|
2.84
|
9.82
|
22.30
|
6.40
|
44.00
|
|
Всего
|
13.79
|
6.57
|
.97
|
11.83
|
15.73
|
5.60
|
44.00
|
|
Железо, mg/dL
|
0
|
90.79
|
23.33
|
4.00
|
82.65
|
98.92
|
29.80
|
145.00
|
0,01
|
|
1
|
74.00
|
16.75
|
4.84
|
63.35
|
84.64
|
50.00
|
105.00
|
|
Всего
|
86.41
|
22.88
|
3.37
|
79.61
|
93.20
|
29.80
|
145.00
|
|
Трансферрин, mg/dL
|
0
|
279.97
|
23.79
|
4.08
|
271.67
|
288.27
|
240.00
|
325.00
|
0,023
|
|
1
|
298.33
|
15.69
|
4.53
|
288.37
|
308.29
|
265.00
|
315.00
|
|
Всего
|
284.76
|
23.28
|
3.43
|
277.85
|
291.67
|
240.00
|
325.00
|
В общем анализе крови показатель MCV (англ. – mean corpuscular volume, средний объем эритроцита) был особенно низким у детей с кровоизлияниями в первые сутки (р<0,05). Низкий уровень Fe (р<0,05) отражает наличие у этих детей железодефицитной анемии с первых суток. В соответствии с состоянием Fe уровень трансферрина у данной группы детей был статистически значимо выше.
Согласно полученным результатам, ROC-кривая значения MCV была статистически значимой для новорожденных с кровоизлияниями (рисунок).
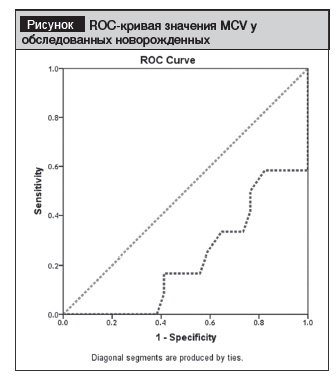
Оптимальный уровень cut off для MCV при наличии кровоизлияния составил 99,5, чувствительность – 55%, специ-фичность – 23,5% (р<0,05). Пороговый уровень ЭПО в первый день составил 4,26, чувствительность – 66%, специ-фичность – 72%, но результаты не были статистически значимыми.
Новорожденные с кровоизлияниями имели более низкую оценку по шкале Апгар в первые 5 минут (р<0,05) и больше подвергались реанимационным мероприятиям в сравнении с новорожденными без кровоизлияний. В связи с респираторным дистресс-синдромом у этих детей была проведена АПВ в режиме SIMV (англ. – Synchronized Intermittent mandatory ventilation, синхронизированная перемежающаяся принудительная вентиляция), 50% детей данной категории получали сурфактант в виде ингаляции. Известно, что вентиляция с положительным давлением поддерживает фетальное кровообращение за счет повышения давления в малом круге кровообращения. Тот факт, что у данной группы детей овальное окно остается открытым, доказывает это предположение. Помимо этого, повышение давления в грудной клетке вызывает уменьшение объема сердечного выброса, а также нарушение мозгового кровообращения, что в свою очередь является причиной увеличения частоты внутрижелудочковых кровоизлияний и кровоизлияний в паренхиму головного мозга. В нашем исследовании, акцентируя внимание на диагностическую и прогностическую роль показателей периферической крови, мы обнаружили, что MCV у новорожденных с кровоизлиянием был ниже в первые сутки, чем в другой группе.
Известно, что гипореактивность тромбоцитов и снижение уровня факторов свертывания угнетаются при высоком неонатальном гематокрите и значениях MCV. Это уравновешивает неонатальную систему гемостаза и приводит к возникновению протромботического фенотипа. Хотя количество тромбоцитов у детей с кровоизлияниями было ниже в первые сутки, разница не была статистически значимой. Нарушение этого баланса при преждевременных родах может привести к анемии и гипокоагуляции у новорожденных.
Уровень Fe у этих детей в первые сутки был низким, а повышение трансферрина подтверждает наличие железодефицитной анемии у обследованных нами новорожденных с кровоизлияниями. На фоне анемий уровни ЭПО у данной группы были высокими в течение первого дня, что отражает воздействие гипоксии. В динамике ЭПО повышался у всех детей, при этом у детей с кровоизлияниями увеличение было примерно в 2 раза, у остальных детей – до 3 раз. Меньший прирост в динамике у детей с кровоизлияниями также свидетельствует о вероятном исчерпании компенсаторных возможностей.
Заключение
Осложненный анамнез беременности, особенно анемия у матери, повышая риск возникновения анемии и гипоксии у новорожденных, может служить причиной кровоизлияния в мозг. Низкое значение MCV делает железодефицитную анемию особенно важным фактором в развитии кровоизлияний. Следует признать целесообразными лечение и профилактику анемии при беременности. В дальнейшем необходимо провести исследования в более широком масштабе и определить взаимосвязь между внутрижелудочковыми кровоизлияниями у новорожденных и показателями крови у матерей, а также определить оптимальный cut-off уровень показателей материнской крови для кровоизлияний у новорожденных.
Л И Т Е Р А Т У Р А
1. Jacobs, S.E. Cooling for newborns with hypoxic-ischaemic encephalopathy / S.E. Jacobs, M. Berg, R. Hunt [et al.] // Cochrane Database Syst Rev. – 2013. – CD003311.
2. Johnston, M.V. Encephalopathies / M.V. Johnston. In: Kliegman R.M., Stanton B.F., St. Geme J.W., Schor N.F., eds. Nelson Textbook of Pediatrics. 20th ed. – Philadelphia, 2016. – p.598.
3. Kadooka, M. Effect of neonatal hemoglobin concentration on long-term outcome of infants affected by fetomaternal hemorrhage / M. Kadooka, H. Kato, A. Kato [et al.] // Early Hum Dev. – 2014. – Vol.90. – P.431–434.
4. Volpe, J.J. The encephalopathy of prematurity – brain injury and impaired brain development inextricably intertwined // Semin Pediatr Neurol. – 2009. – Vol.16, N4. – P.167–178.
5. Christensen, R.D. Association, among very-low-birth weight neonates, between red blood cell transfusions in the week after birth and severe intra ventricular hemorrhage / R.D. Christensen, V.L. Baer, D.K. Lambert [et al.] // Transfusion. – 2014. – Vol.54. – P.104–108.
6. Ahearne, C.E. Short and long term prognosis in prenatal asphyxia: an update / C.E. Ahearne, G.B. Boylan, D.M. Murray // World J Clin Pediatr. – 2016. – Vol.5. – P.67–74.
7. Du Plessis, A.J. «Cerebellar development» in Volpe’s Neurology of the Newborn / A.J. Du Plessis, C. Limperopoulos, J.J. Volpe. – Philadelphia, 2018. – p.73–99.
8. Razak R., Adisasmita A. Low Birth Weight and Asphyxia Neonatorum Risk: A Case-Control Study / Conference: 2nd Sriwijaya International Conference of Public Health (SICPH 2019). – 19 June 2020.
9. Rocha-Ferreira, E. Plasticity in the neonatal brain following hypoxic-ischemic injury / E. Rocha-Ferreira, M. Hristova // Neural Plast. – 2016. – 4901014.
10. Angelidou, A. Anemia. In: Cloherty Stark editors / A. Angelidou, H. Christou. – Manual of neonatal care. – 2017. – P.613–623.
11. Туш, Е.В. Гематология детского возраста издательство НижГМА Учебное пособие / Е.В. Туш, О.В. Халецкой. – Н.Новгород, 2016. – 194 с.
12. Auzmendi, J. EPO and EPO-Receptor System as Potential Actionable Mechanism for the Protection of Brain and Heart in Refractory Epilepsy and SUDEP / J. Auzmendi, M.B. Puchulu, J.C. García Rodríguez [et al.] //Current Pharmaceutical Design. – 2020. – Vol.26, N12. – P.1356–1364.
13. Bersani, I. Early predictors of perinatal brain damage: the role of neurobiomarkers / Bersani I., F. Pluchinotta, A. Dotta [et al.] // Clinical Chemistry and Laboratory Medicine (CCLM). – 2020. – Vol.58, N4. – P.471–486.
Медицинские новости. – 2023. – №2. – С. 65-68.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.